Relationship between microRNA-146a and the Plaque Stability in Coronary Heart Disease Patients
-
摘要:
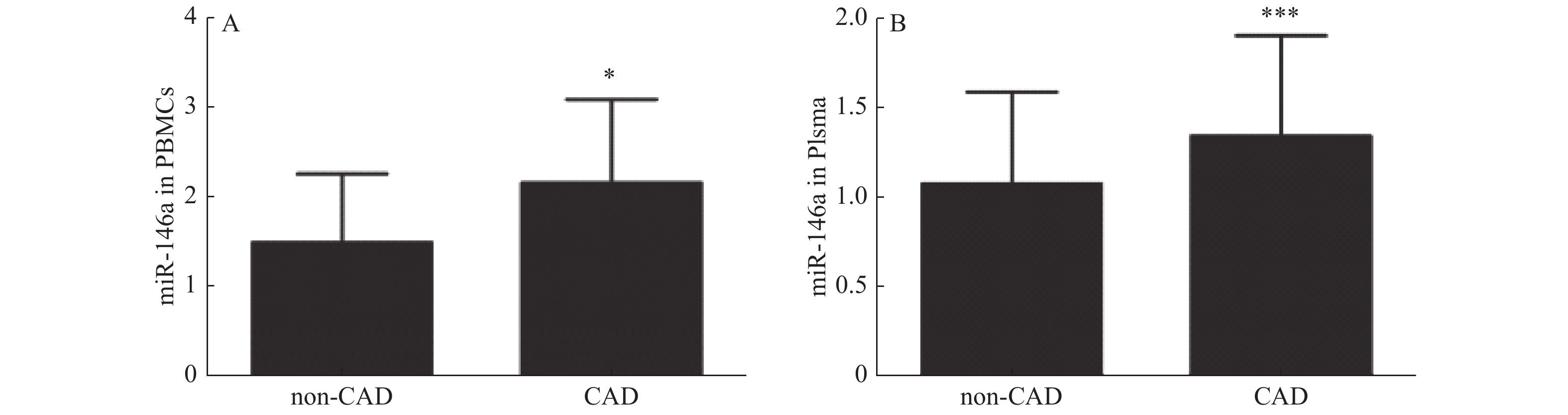
目的 探讨microRNA-146a(miR-146a)与冠心病斑块稳定性的相关性。 方法 共收集胸痛患者324例。采用实时聚合酶链反应(Real-time PCR)检测miR-146a的表达。ELISA法检测hs-CRP、IL-6、IL-8水平。采用冠脉造影评价冠状动脉狭窄程度。应用血管内超声(IVUS)评价冠状动脉狭窄病变斑块稳定性。 结果 (1)UAP组和AMI组hs-CRP、IL-6、IL-8水平较CPS组明显升高(P < 0.01);(2)冠心病患者外周血单个核细胞(PBMCs)和血浆miR-146a表达明显高于非冠心病组(P < 0.05,P < 0.001);(3)miR-146a在SAP组、UAP组和AMI组的表达高于CPS组(P < 0.01,P < 0.001,P < 0.001),miR-146a在血浆中的表达模式与PBMCs一致;(4)易损斑块组外周血单个核细胞和血浆miR-146a的表达明显高于稳定斑块组(P < 0.05);(5)软斑块组PBMCs和血浆miR-146a水平显著高于纤维斑块组和钙化斑块组(P < 0.05)。 结论 miR-146a的表达与冠状动脉狭窄病变斑块稳定性密切相关。 Abstract:Objectives To investigate the association between microRNA-146a(miR-146a)and the plaque stability in patients with coronary heart disease. Methods Real-time PCR was used to measure miR-146a expression in 324 patients. ELISA was used to measure the level of hs-CRP, IL-6 and IL-8. Coronary angiography was used to evaluate the degree of coronary artery stenosis. Intravascular ultrasound(IVUS)was used to evaluate the plaque stability of coronary stenotic lesions. Results (1)The levels of hs-CRP, IL-6 and IL-8 were significantly increased in the UAP and AMI groups compared with the CPS groups(P < 0.01).(2)The miR-146a expression in peripheral blood mononuclear cells(PBMCs)and plasma was significantly higher in CAD patients than those in non-CAD group(P < 0.05, P < 0.001).(3)The miR-146a expression in PBMCs was higher in SAP, UAP and AMI group than CPS group(P < 0.01, P < 0.001, P < 0.001). The expression patterns of miR-146a in plasma was consistent with that of PBMCs.(4)The expression of miR-146a in PBMCs and plasma were significantly higher in vulnerable plaque group than those in stable plaque group(P < 0.05).(5)The level of miR-146a in PBMCs and plasma was significantly higher in soft plaque group than those in fibrous plaque group and calcified plaque group(P < 0.05). Conclusions The expression of miR-146a is associated with the plaque stability of coronary stenotic lesions. -
Key words:
- miR-146a /
- Coronary artery disease /
- IVUS /
- Plaque stability
-
表 1 基础临床资料(
$\bar x \pm s $ )Table 1. Basic clinical data(
$\bar x \pm s $ )项目 CPS组 SAP组 UAP组 AMI组 F/χ2 P 人数 86 91 105 52 年龄 60 ± 8 62 ± 8 3 ± 7 61 ± 7 F = 2.44 0.06 性别(男/女) 35/51 45/46 52/53 26/28 χ2 = 1.89 0.60 危险因素[n (%)] 高血压 39(45) 41(45) 43(41) 21(40) χ2 = 0.67 0.88 糖尿病 19(22) 34(37) 40(38) 19(37) χ2 = 6.84 0.08 高脂血症 30(35) 37(41) 45(43) 17(33) χ2 = 2.23 0.53 吸烟 29(35) 31(35) 37(38) 17(33) χ2 = 0.11 0.99 hs-CRP(mg/L) 1.16 ± 0.38 1.79 ± 0.52 2.62 ± 0.92* 3.98 ± 0.76*&# F = 231.4 0.00 IL-6(ng/L) 2.30 ± 1.05 4.04 ± 0.99 8.95 ± 2.99*& 12.48 ± 4.86*&# F = 234.8 0.00 IL-8(ng/L) 17.40 ± 6.24 75.23 ± 19.65* 87.54 ± 13.12* 108.72 ± 23.25*&# F = 513.9 0.00 与CPS组比较,*P < 0.01;与SAP组比较,&P < 0.05;与UAP组比较,#P < 0.05。 表 2 两组患者PBMCs及血浆中miR-146a、IL-6、Il-8及hs-CRP的水平(
$\bar x \pm s $ )Table 2. Levels of miR-146a,IL-6,IL-8 and hs-CRP in PBMCs and plasma of the two groups(
$\bar x \pm s $ )项目 n PBMCs中miR-146a 血浆中miR-146a IL-6(ng/L) Il-8(ng/L) hs-CRP(mg/L) 稳定斑块组 53 1.42 ± 0.36 1.11 ± 0.20 6.51 ± 2.65 72.40 ± 23.20 2.25 ± 0.95 易损斑块组 60 2.94 ± 0.78 2.04 ± 0.49 7.13 ± 2.98 80.32 ± 17.82 2.31 ± 0.90 F值 26.16 32.29 2.425 1.501 0.885 P值 0.029* 0.032* 0.545 0.058 0.663 *P < 0.05。 表 3 三组患者PBMCs及血浆中miR-146a、IL-6、IL-8及hs-CRP的水平(
$\bar x \pm s $ )Table 3. Levels of miR-146a,IL-6,IL-8 and hs-CRP in PBMCs and plasma of three groups(
$\bar x \pm s $ )项目 n PBMCs中miR-146a 血浆中miR-146a IL-6(ng/L) Il-8(ng/L) hs-CRP(mg/L) 钙化斑块 33 1.41 ± 0.30 1.19 ± 0.18 5.78 ± 2.26 75.08 ± 24.96 2.42 ± 0.90 纤维斑块 37 2.88 ± 0.74* 1.82 ± 0.46* 5.98 ± 3.25 78.56 ± 22.20 2.04 ± 0.90 软斑块 43 3.40 ± 0.92*# 2.28 ± 0.66*# 7.82 ± 2.94 82.40 ± 14.02 2.50 ± 0.90 F 113.2 99.24 4.652 1.178 2.251 P 0.000 0.000 0.598 0.785 0.842 与钙化斑块组比较,*P < 0.05;与纤维斑块组比较,#P < 0.05。 -
[1] 胡盛寿,高润霖,刘力生,等. 《中国心血管病报告2018》概要[J].中国循环杂志,2019,34(3):209-220. doi: 10.3969/j.issn.1000-3614.2019.03.001 [2] Geovanini G R,Libby P. Atherosclerosis and inflammation:overview and updates[J]. Clin Sci(Lond),2018,132(12):1243-1252. doi: 10.1042/CS20180306 [3] Zhong L,Simard M J,Huot J. Endothelial microRNAs regulating the NF-κB pathway and cell adhesion molecules during inflammation[J]. FASEB J,2018,32(8):4070-4084. doi: 10.1096/fj.201701536R [4] Churov A,Summerhill V,Grechko A,et al. MicroRNAs as potential biomarkers in atherosclerosis[J]. Int J Mol Sci,2019,20(22):5547. doi: 10.3390/ijms20225547 [5] Bostjancic E,Glavac D. Importance of microRNAs in skin morphogenesis and diseases[J]. Acta Dermatovenerol Alp Panonica Adriat,2008,17(3):95-102. [6] Stanczyk J,Pedrioli D M,Brentano F,et al. Altered expression of MicroRNA in synovial fibroblasts and synovial tissue in rheumatoid arthritis[J]. Arthritis Rheum,2008,58(4):1001-1009. doi: 10.1002/art.23386 [7] Chen X,Gao Q,Zhou L,et al. MiR-146a alleviates inflammation of acute gouty arthritis rats through TLR4/MyD88 signal transduction pathway[J]. Eur Rev Med Pharmacol Sci,2019,23(21):9230-9237. [8] Yao R,Ma Y,Du Y,et al. The altered expression of inflammation-related microRNAs with microRNA-155 expression correlates with Th17 differentiation in patients with acute coronary syndrome[J]. Cell Mol Immunol,2011,8(6):486-495. doi: 10.1038/cmi.2011.22 [9] Zhu G F,Yang L X,Guo R W,et al. microRNA-155 is inversely associated with severity of coronary stenotic lesions calculated by the Gensini score[J]. Coron Artery Dis,2014,25(4):304-310. doi: 10.1097/MCA.0000000000000088 [10] Mintz G S,Nissen S E,Anderson W D,et al. American college of cardiology clinical expert consensus document on standards for acquisition,measurement and reporting of Intravascular Ultrasound Studies(IVUS). A report of the American college of cardiology task force on clinical expert consensus documents[J]. J Am Coll Cardiol,2001,37(5):1478-1492. doi: 10.1016/S0735-1097(01)01175-5 [11] Endo M,Hibi K,Shimizu T,et al. Impact of ultrasound attenuation and plaque rupture as detected by intravascular ultrasound on the incidence of no-reflow phenomenon after percutaneous coronary intervention in ST-segment elevation myocardial infarction[J]. J Am Coll Cardiol Intv,2010,3(5):540-549. doi: 10.1016/j.jcin.2010.01.015 [12] Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J]. Methods,2001,25(4):402-408. doi: 10.1006/meth.2001.1262 [13] Tayefi M,Tajfard M,Saffar S,et al. hs-CRP is strongly associated with coronary heart disease(CHD):A data mining approach using decision tree algorithm[J]. Comput Methods Programs Biomed,2017,141:105-109. doi: 10.1016/j.cmpb.2017.02.001 [14] Tajfard M,Latiff L A,Rahimi H R,et al. Serum concentrations of MCP-1 and IL-6 in combination predict the presence of coronary artery disease and mortality in subjects undergoing coronary angiography[J]. Mol Cell Biochem,2017,435(1-2):37-45. doi: 10.1007/s11010-017-3054-5 [15] Glaser R,Selzer F,Faxon D P,et al. Clinical progression of incidental,asymptomatic lesions discovered during culprit vessel coronary intervention[J]. Circulation,2005,111(2):143-149. doi: 10.1161/01.CIR.0000150335.01285.12 [16] Taganov K D,Boldin M P,Chang K J,et al. NF-kappaB-dependent induction of microRNA miR-146,an inhibitor targeted to signaling proteins of innate immune responses[J]. Proc Natl Acad Sci USA,2006,103(33):12481-12486. doi: 10.1073/pnas.0605298103 [17] Zeng Z,Gong H,Li Y,et al. Upregulation of miR-146a contributes to the suppression of inflammatory responses in LPS-induced acute lung injury[J]. Exp Lung Res,2013,39(7):275-282. doi: 10.3109/01902148.2013.808285 [18] Gao M,Wang X,Zhang X,et al. Attenuation of cardiac dysfunction in polymicrobial sepsis by microRNA-146a is mediated via targeting of IRAK1 and TRAF6 expression[J]. J Immunol,2015,195(2):672-682. doi: 10.4049/jimmunol.1403155 [19] Pundziute G,Schuijf J D,van Velzen J E,et al. Assessment with multi-slice computed tomography and gray-scale and virtual histology intravascular ultrasound of gender-specific differences in extent and composition of coronary atherosclerotic plaques in relation to age[J]. Am J Cardiol,2010,105(4):480-486. doi: 10.1016/j.amjcard.2009.09.054 [20] Blaha M J,Nasir K,Rivera J J,et al. Gender differences in coronary plaque composition by coronary computed tomography angiography[J]. Coron Artery Dis,2009,20(8):506-512. doi: 10.1097/MCA.0b013e328331368d -






 下载:
下载: