Clinical Trial of Rivaroxaban after Implantation of Stent for Femoral Popliteal Atherosclerosis Occlusion
-
摘要:
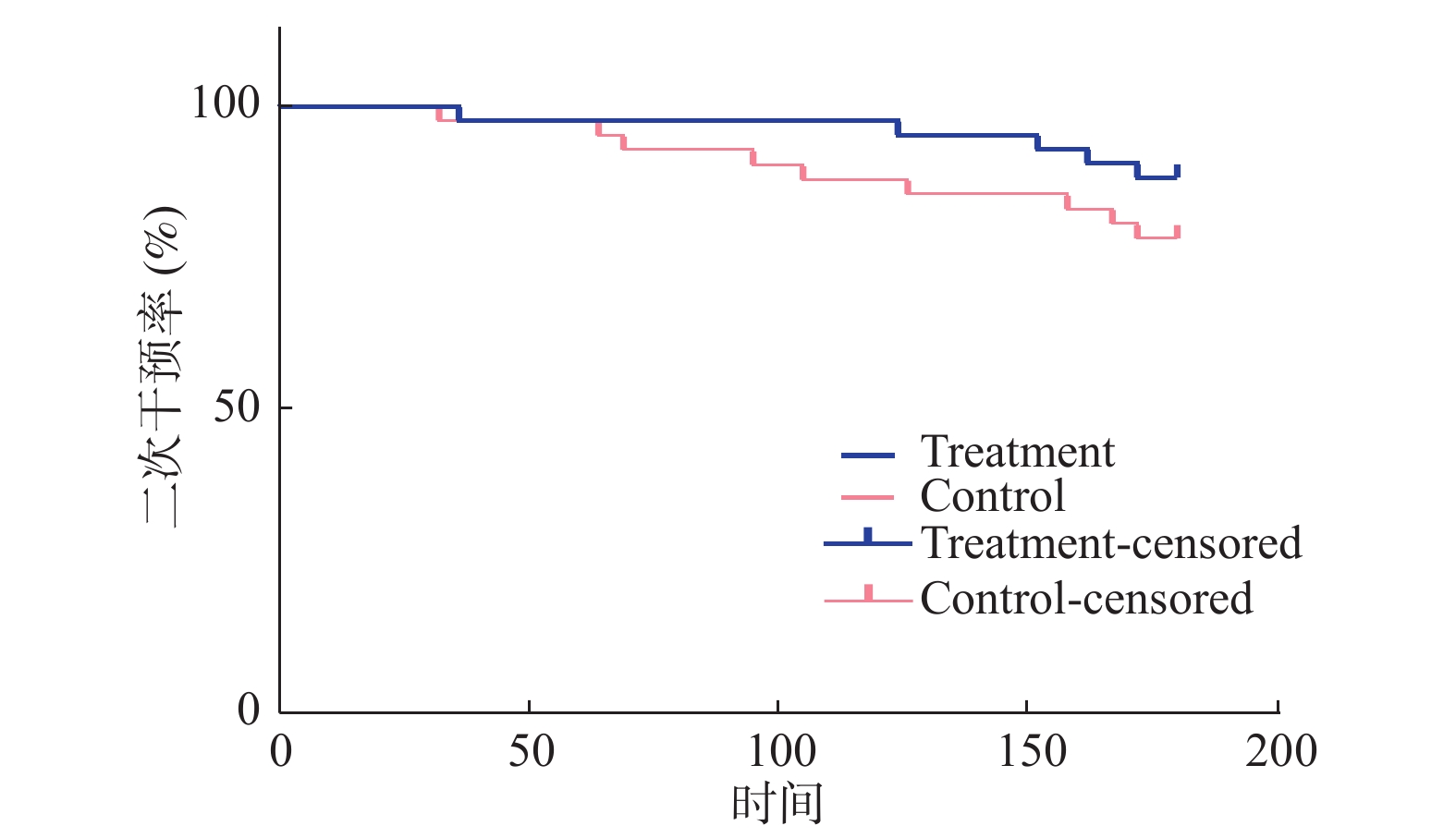
目的 研究利伐沙班在股腘动脉粥样硬化闭塞支架植入术后的疗效及安全性。 方法 将满足标准的87患者随机分为试验组45例和对照组42例,两组患者一般资料差异无统计学意义。试验组予利伐沙班片每次10 mg,po,qd和阿司匹林肠溶片每次100 mg,po,qd;对照组予阿司匹林肠溶片每次100 mg,po,qd,两组患者均予阿托伐他汀10 mg,po,qd和贝前列素钠40 μg,po,tid,嘱所有患者戒烟。观察随访术后当天、治疗后3个月和6个月两组患者ABI、跛行距离、支架再狭窄、支架附壁血栓形成以及二次干预率等相关疗效指标,并统计药物不良反应、不良心脑血管事件、轻度和严重出血情况等安全性指标,对随访观察的结果进行统计学分析。 结果 6个月时两组患者附壁血栓形成、ABI和跛行距离差异有统计学意义(P < 0.05),支架再狭窄差异无统计学意义(P > 0.05),两组患者二次干预率的Log-rank检验差异无统计学意义(P > 0.05),两组患者安全性对比无统计学意义(P > 0.05)。 结论 利伐沙班联合阿司匹林治疗明显的减少了支架内附壁血栓形成并延缓了术后ABI和跛行距离的下降趋势,可能对患者的长期预后有益。 Abstract:Objective To study the efficacy and safety of rivaroxaban after stent implantation of the femoral popliteal atherosclerosis occlusion stent. Methods Eighty-seven patients who met the criteria were randomly divided into 45 cases in the treatment group and 42 cases in the control group. There was no statistically significant difference in the general information between the two groups. The treatment group was given rivaroxaban tablets 10 mg each time, po, qd and aspirin enteric-coated tablets 100 mg each time, po, qd; the control group was given aspirin enteric-coated tablets 100 mg, po, qd each time, both groups were given Atorvastatin 10 mg, po, qd and Beraprost sodium tablets 40 μg, po, tid, all patients were urged to quit smoking. Observe the relevant efficacy indicators such as ABI, claudication distance, stent restenosis, stent mural thrombosis, and secondary intervention rate of the two groups of patients on the day of postoperative day, 3 months and 6 months after treatment, and the safety indicators such as adverse drug reactions, major adverse cardiacand cerebrovascular events, minor and major bleeding, the results were analyzed statistically. Results At 6 months, there were differences in the stent mural thrombosis, ankle brachial index and claudication distance between the two groups(P < 0.05), no significant difference in in-stent restenosis(P > 0.05), There was no statistically significant difference in the log-rank test of the second intervention rate between the two groups(P > 0.05), and there was no statistical difference in safety comparison between the two groups(P > 0.05). Conclusion Rivaroxaban combined with aspirin can significantly reduce stent mural thrombosis and delay the decline in postoperative ABI and claudication distance, which may benefit the long-term prognosis of patients. -
表 1 两组患者的一般资料比较(
$\bar x \pm s$ )Table 1. Comparison of general information between two groups(
$\bar x \pm s$ )项目 治疗组(n = 42) 对照组(n = 41) χ2/t P 性别(男/女) 29/13 26/15 0.96 0.756 年龄(岁) 69.92±8.91 71.06±6.83 −0.587 0.559 BMI(kg/m2) 26.82±3.38 26.12±2.82 0.126 0.911 既往史[n (%)] 吸烟史 15(35.71) 13(30.70) 0.149 0.699 糖尿病 11(26.19) 8(19.51) 0.524 0.469 高血压 24(57.14) 21(51.22) 0.293 0.588 冠心病 9(21.43) 7(17.07) 0.253 0.615 脑卒中 5(11.90) 4(9.76) 0.099 0.753 高脂血症 22(52.38) 19(46.34) 0.303 0.582 心率(次/min) 74.52±5.43 73.14±5.51 1.241 0.218 收缩压(mmHg) 143.20±11.92 141.43±11.51 0.703 0.484 舒张压(mmHg) 71.83±9.64 70.53±7.64 0.689 0.493 空腹血糖(mmol/L) 5.52±1.62 5.60±1.50 −2.132 0.167 C-反应蛋白(mg/L) 7.34±3.23 7.81±2.98 −1.919 0.195 总胆固醇(mmol/L) 4.14±1.22 4.24±1.68 −0.305 0.789 甘油三酯(mmol/L) 1.67±0.40 1.60±0.53 0.665 0.508 低密度脂蛋白(mmol/L) 1.73±0.31 1.77±0.57 −0.381 0.704 BMI(Body Mass Index):肥胖指数。 表 2 两组患者术前血管评估及术中支架植入数量对比(
$\bar x \pm s$ )Table 2. Comparison of preoperative vascular assessment and Number of stent implants in surgery of patients between two groups(
$\bar x \pm s$ )项目 治疗组(n = 42) 对照组(n = 41) Z/t P 卢瑟福分级[n (%)] III 11(26.19) 9(21.95) IV 28(66.67) 30(73.17) −0.221 0.825 V 3(7.14) 2(4.87) ABI 0.34±0.09 0.35±0.06 0.555 0.581 跛行距离(m) 130.53±29.34 132.29±21.38 −0.301 0.764 植入支架数量[n (%)] 1 37(88.10) 39(95.12) 2 4(9.52) 2(4.88) −1.163 0.245 3 1(2.38) 0(0) ABI(Ankle brachial index):踝肱指数。 表 3 两组患者临床疗效比较[(
$\bar x \pm s$ ),M(P25,P75)]Table 3. Comparison of clinical efficacy between two groups[(
$\bar x \pm s$ ),M(P25,P75)]组别 附壁血栓 ISR[n (%)] ABI[n (%)] 跛行距离(m) 术后当天 治疗组(n = 42) 0(0) 0(0) 0.93 ± 0.10 − 对照组(n = 41) 0(0) 0(0) 0.96 ± 0.24 − P − − 0.581 − 术后3月 治疗组(n = 42) 8(19.05) 3(7.14) 0.87(0.81,0.94) 694.00(682.00,712.00) 对照组(n = 41) 11(26.83) 4(9.76) 0.88(0.82,0.92) 682.00(660.00,713.50) P 0.399 0.668 0.069 0.566 术后6月 治疗组(n = 42) 10(23.81)* 7(16.67) 0.81(0.74,0.89)* 661.00(642.00,684.00)* 对照组(n = 41) 19(46.34)* 11(26.83) 0.76(0.71,0.82)* 631.00(605.00,672.50)* P 0.031 0.261 0.001 0.000 ISR(In-stent restenosis):支架内再狭窄; ABI(Ankle brachial index):踝肱指数;“−”:未测量,*P < 0.05。 表 4 两组患者安全性比较[n (%)]
Table 4. Comparison of safety between two groups [n (%)]
项目 治疗组(n = 42) 对照组(n = 41) χ2 P 药物不良反应 4(9.52) 3(7.32) 0.131 0.718 MACCE 2(4.76) 1(2.44) 0.321 0.571 轻度出血 4(9.52) 2(4.88) 0.155 0.694 重度出血 2(4.76) 1(2.44) 0.321 0.571 MACCE(major adverse cardiovascular and cerebrovascular events):主要不良心脑血管事件。 -
[1] 中华医学会外科学分会血管外科学组. 下肢动脉硬化闭塞症诊治指南[J].中华普通外科学文献(电子版),2006,10(01):1-18. [2] 袁丁,赵纪春,王铁皓,等. 下肢动脉硬化闭塞症最新指南解读及意义[J].中国普外基础与临床杂志,2018,25(01):25-31. [3] 苏少飞,李全成,陈林宝,等. 抗凝联合抗血小板预防糖尿病下肢动脉硬化闭塞症支架植入后再狭窄的效果观察[J].中国糖尿病杂志,2017,25(03):218-221. doi: 10.3969/j.issn.1006-6187.2017.03.006 [4] Suzuki K,Iida O,Soga Y,et al. Long-term results of the S.M.A.R.T. Control(TM)stent for superficial femoral artery lesions,J-SMART registry[J]. Circ J:Official Journal of the Japanese Circulation Society,2011,75(4):939-944. doi: 10.1253/circj.CJ-10-1029 [5] 毛由军,李晓强. 下肢动脉支架内再狭窄的诊断和治疗[J].中华普通外科学文献(电子版),2020,1(14):76-80. [6] Dagher N N,Modrall J G. Pharmacotherapy before and after revascularization:anticoagulation,antiplatelet agents,and statins[J]. Semin Vasc Surg,2007,20(1):10-14. doi: 10.1053/j.semvascsurg.2007.02.006 [7] Anand S S,Bosch J,Eikelboom J W,et al. Rivaroxaban with or without aspirin in patients with stable peripheral or carotid artery disease:an international,randomised,double-blind,placebo-controlled trial[J]. Lancet,2018,391(10117):219-229. doi: 10.1016/S0140-6736(17)32409-1 [8] Zafar M U,Vorchheimer D A,Gaztanaga J,et al. Antithrombotic effects of factor Xa inhibition with DU-176b:Phase-I study of an oral,direct factor Xa inhibitor using an ex-vivo flow chamber[J]. Thromb Haemost,2007,98(4):883-888. [9] Sanmartín M,Bellmunt S,Cosín-Sales J,et al. Role of rivaroxaban in the prevention of atherosclerotic events[J]. Expert Rev Clin Pharmacol,2019,12(8):771-780. doi: 10.1080/17512433.2019.1637732 [10] Akkaya G,Bilen Ç,Gençpınar T,et al. Effects of rivaroxaban on intimal hyperplasia and smooth muscle cell proliferation at the carotid artery anastomosis site in rabbits[J]. Anatol J Cardiol,2017,18(4):261-265. [11] Woźniak E,Broncel M,Bukowska B,et al. The Protective effect of dabigatran and rivaroxaban on DNA oxidative changes in a model of vascular endothelial damage with oxidized cholesterol[J]. Int J Mol Sci,2020,21(6):1953. doi: 10.3390/ijms21061953 -






 下载:
下载: