OCT Evaluation on the Establishment of A Mouse Model of Chronic Ocular Hypertension Induced by Magnetic Beads Injection
-
摘要:
目的 探索磁性微珠前房注射诱导高眼压模型的可行性及特点,OCT在模型评估中的作用。 方法 将C57BL/6小鼠分为正常组、对照组与实验组。实验组前房内注射磁性微珠诱导高眼压,对照组前房内注射等量生理盐水,正常组不做任何处理。术前及术后第1天开始隔天检测眼压波动;建模3周后行荧光金逆行标记,建模4周后使用OCT检测两组小鼠视盘旁神经纤维厚度,并行视网膜行铺片计数各组RGCs数量。 结果 小鼠前房内注射磁性荧光微珠后,微珠可均匀分布于房角处堵塞房角。实验组小鼠眼压自注射术后1 d开始升高,平均眼压为(19.37±4.38)mmHg,3周开始眼压下降;荧光金逆行标记RGCs,建立微珠诱导小鼠高眼压模型后4周,行OCT检测RNFL厚度。实验组RNFL厚度为(27.67±6.15)μm,较对照组明显变薄,两组比较差异有统计学意义(P = 0.0082)。检测OCT后收集眼球计数RGCs,实验组RGCs为(203.83±26.35)个,与对照组比较明显减少,差异有统计学意义(P = 0.009 4)。 结论 小鼠前房注射磁性微珠可以诱导持续稳定的眼压升高并引起明显RGC数量减少,可通过OCT无创、快速、重复的检测神经纤维层厚度发现RGC损伤。 Abstract:Objective To explore the feasibility and characteristics of magnetic microbead anterior chamber injection inducing ocular hypertension model, and to study the role of OCT in model evaluation. Methods C57BL/6 mice were divided into the normal group, control group and experimental group. The normal group was not treated. The intraocular pressure fluctuations were detected before the surgery and on the first day after the surgery; After 3 weeks of modeling, fluorescent gold retrograde labeling was performed, and after 4 weeks of modeling, OCT was used to detect the thickness of para-optical nerve fibers in two groups of mice, and the number of RGCs in each group was counted by parallel retinal plating. Results After the injection of magnetic fluorescent microbeads into the anterior chamber of the mice, the microbeads were able to be evenly distributed at the angle of the anterior chamber to block the angle. In the experimental group, the intraocular pressure of the mice began to increase 1 day after the injection, and the average intraocular pressure was 19.37 ± 4.38 mmHg. The intraocular pressure decreased slightly after three weeks. In the 4th week, OCT was used to detect the thickness of RNFL. The thickness of RNFL in the experimental group was 27.67 ± 6.15 μm, which was significantly thinner than that in the control group. The difference between the two groups was statistically significant(p = 0.0082). After detecting OCT, RGCs were counted in wholemount retina and the RGCs in the experimental group were 203.83 ± 26.35, which was significantly reduced compared with the control group, and the difference was statistically significant(p = 0.0094). Conclusion The injection of magnetic microbeads in the anterior chamber of mice can induce a sustained and stable increase in intraocular pressure and cause a significant decrease in the number of RGCs. RGC damage can be found by non-invasive, rapid, and repeated detection of the thickness of the nerve fiber layer by OCT. -
Key words:
- Magnetic microbeads /
- High intraocular pressure /
- OCT /
- Glaucoma /
- Animal model
-
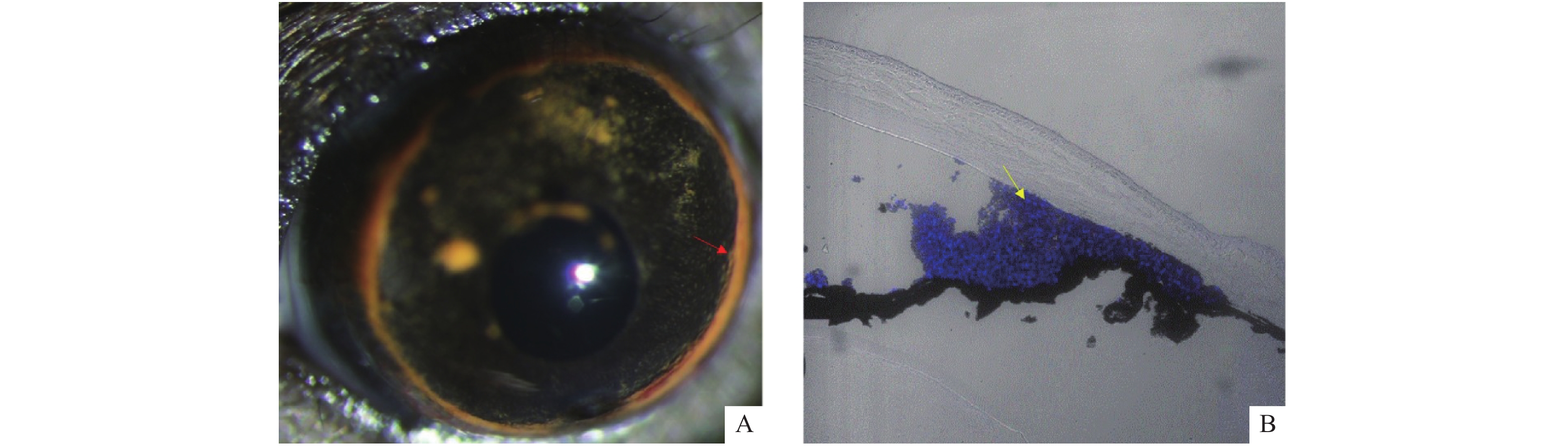
图 4 微珠注射高眼压诱导RGCs数量减少。术后3周行各组小鼠荧光金逆行标记RGC,1周后取视网膜行铺片检查计数RGC数量。结果显示,对照组为254±27.89个,实验组为203.83±26.35个。正常组与对照组比较差异无统计学意义,对照组与实验组比较差异有统计学意义(p = 0.0094)。(比例尺50 μm,×20)
A:术后3周行各组小鼠荧光金逆行标记RGC;B:1周后取视网膜行铺片检查计数RGC数量。与对照组比较,**P < 0.01。
Figure 4. Microbead injection of high intraocular pressure induces a decrease in the number of RGCs
-
[1] Quigley H A,Broman A T. The number of people with glaucoma worldwide in 2010 and 2020[J]. Br J Ophthalmol,2006,90(3):262-267. doi: 10.1136/bjo.2005.081224 [2] 孔蕾,胡敏,华启云,等. 实验性视网膜缺血-再灌注损伤中坏死性凋亡相关因子的表达变化[J].眼科新进展,2016,36(12):1109-1112. [3] Samuels B C,Siegwart J T,Zhan W,et al. A novel tree shrew(Tupaia belangeri)model of glaucoma[J]. Invest Ophthalmol Vis Sci,2018,59(7):3136-3143. doi: 10.1167/iovs.18-24261 [4] Wu X,Pang Y,Zhang Z,et al. Mitochondria-targeted antioxidant peptide SS-31 mediates neuroprotection in a rat experimental glaucoma model[J]. Acta Biochim Biophys Sin(Shanghai),2019,51(4):411-421. [5] Dai C,Xie J,Dai J,et al. Transplantation of cultured olfactory mucosal cells rescues optic nerve axons in a rat glaucoma model[J]. Brain Res,2019,7(1):45-51. doi: 10.1016/j.brainres.2019.02.010 [6] Liu H, Ding C. Establishment of an experimental glaucoma animal model: A comparison of microbead injection with or without hydroxypropyl methylcellulose[J]. Experimental and Therapeutic Medicine,2017,14(3):1953-1960. [7] Fischer R A,Roux A L,Wareham L K,et al. Pressure-dependent modulation of inward-rectifying K(+)channels:implications for cation homeostasis and K(+)dynamics in glaucoma[J]. Am J Physiol Cell Physiol,2019,317(2):375-389. doi: 10.1152/ajpcell.00444.2018 [8] Cui Q N,Bargoud A R,Ross A G,et al. Oral administration of the iron chelator deferiprone protects against loss of retinal ganglion cells in a mouse model of glaucoma[J]. Exp Eye Res,2020,193(4):107961. doi: 10.1016/j.exer.2020.107961 [9] Biswas S,Wan K H. Review of rodent hypertensive glaucoma models[J]. Acta Ophthalmol,2019,97(3):e331-e340. doi: 10.1111/aos.13983 [10] Pang I H,Clark A F. Inducible rodent models of glaucoma[J]. Prog Retin Eye Res,2019,97(3):100799. [11] Kimura A,Noro T,Harada T. Role of animal models in glaucoma research[J]. Neural Regen Res,2020,15(7):1257-1258. doi: 10.4103/1673-5374.272578 [12] Samsel P A,Kisiswa L,Erichsen J T,et al. A novel method for the induction of experimental glaucoma using magnetic microspheres[J]. Invest Ophthalmol Vis Sci,2011,52(3):1671-1675. doi: 10.1167/iovs.09-3921 [13] Jiang S M,Zeng L P,Zeng J H,et al. beta-III-Tubulin:a reliable marker for retinal ganglion cell labeling in experimental models of glaucoma[J]. Int J Ophthalmol,2015,8(4):643-652. [14] Urcola J H,Hernndez M,Vecino E. Three experimental glaucoma models in rats:comparison of the effects of intraocular pressure elevation on retinal ganglion cell size and death[J]. Exp Eye Res,2006,83(2):429-437. doi: 10.1016/j.exer.2006.01.025 [15] Ito Y A,Belfortn N,Cueva V J,et al. A Magnetic Microbead Occlusion Model to Induce Ocular Hypertension-Dependent Glaucoma in Mice[J]. J Vis Exp,2016,32(109):e53731. [16] Cone F E,Gelman S E,Son J L,et al. Differential susceptibility to experimental glaucoma among 3 mouse strains using bead and viscoelastic injection[J]. Experimental Eye Research,2010,91(3):415-424. [17] Yang Q,Cho K S,Chen H,et al. Microbead-induced ocular hypertensive mouse model for screening and testing of aqueous production suppressants for glaucoma[J]. Invest Ophthalmol Vis Sci,2012,53(7):3733-3741. doi: 10.1167/iovs.12-9814 [18] 金尚丽,曾锦,陈智慧,等. 频域光学相干断层扫描(OCT)测量视盘参数及视网膜厚度在早期青光眼诊断中的作用[J].眼科新进展,2018,38(5):452-456.JIN Shang L,Zeng J,Chen Z H,et al. Role of the optic disc parameters and retinal thickness measured by frequency domain OCT in early glaucoma diagnosis[J]. Recent Advances in Ophthalmology,2018,38(5):452-456. [19] Ohno Y,Makita S,Shimazawam,et al. Thickness mapping of the inner retina by spectral-domain optical coherence tomography in an N-methyl-D-aspartate-induced retinal damage model[J]. Exp Eye Res,2013,113(8):19-25. doi: 10.1016/j.exer.2013.05.009 [20] Nagata A,Higashide T,Ohkubo S,et al. In vivo quantitative evaluation of the rat retinal nerve fiber layer with optical coherence tomography[J]. Invest Ophthalmol Vis Sci,2009,50(6):2809-2815. doi: 10.1167/iovs.08-2764 -






 下载:
下载: