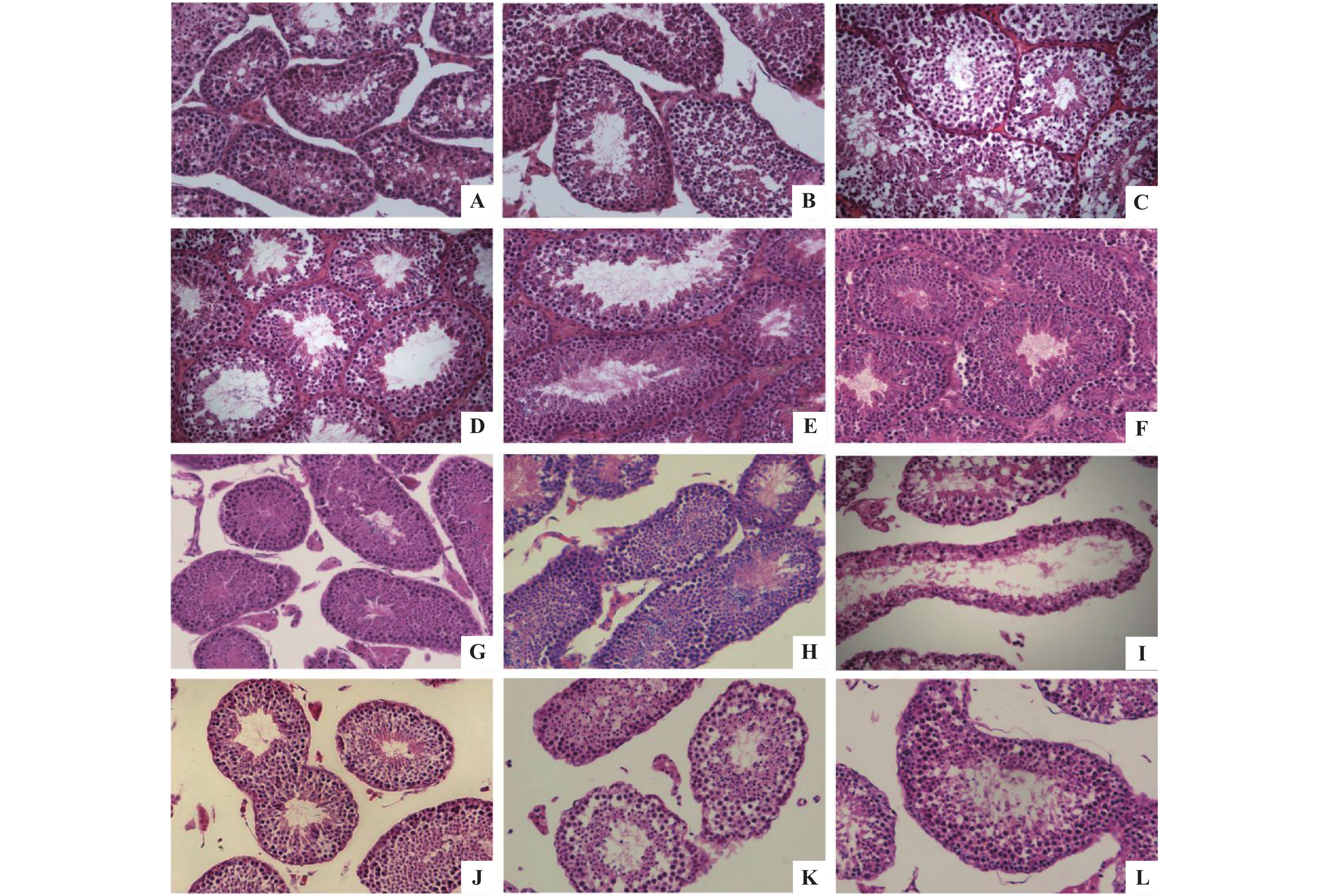
|
[1]
|
沈培清, 角建林, 郑红, 等. 中国树鼩实验动物化研究进展和展望[J].动物学研究,2011,32(1):109-114.
|
|
[2]
|
Zhong S, Zhang S, Xing H, et al. Revealing histological and morphological features of female reproductive system in tree shrew (Tupaia belangeri)[J]. Zoomorphology,2018,137(1):191-199. doi: 10.1007/s00435-017-0374-7
|
|
[3]
|
曹筱梅. 树鼩(TUPAIA BELANGERI CHINENSIS)精子发生的季节性变化[J].动物学研究,1989,10(1):15-22.
|
|
[4]
|
刘汝文, 角建林, 陈丽玲, 等. 树鼩驯养中环境条件初步探讨[J].实验动物与比较医学,2010,30(5):381-383. doi: 10.3969/j.issn.1674-5817.2010.05.016
|
|
[5]
|
Wang H Y, Zhang B, Zhou J N, et al. Arsenic trioxide inhibits liver cancer stem cells and metastasis by targeting SRF/MCM7 complex[J]. Cell Death Dis,2019,10(6):453. doi: 10.1038/s41419-019-1676-0
|
|
[6]
|
Emmanuelle Com, Antoine D. Rolland, Myriam Guerrois, et al. Identification, molecular cloning, and cellular distribution of the rat homolog of minichromosome maintenance protein 7 (MCM7) in the rat testis[J]. Mol Reprod Dev,2006,73(7):866-877. doi: 10.1002/mrd.20453
|
|
[7]
|
Lee J K, Hurwitz J. Isolation and characterization of various complexes of the minichromosome maintenance proteins of Schizosaccharomyces pombe[J]. The Journal of Biological Chemistry,2000,275(25):18871-18878. doi: 10.1074/jbc.M001118200
|
|
[8]
|
Zheng D, Ye S, Wang X, et al. Pre-RC protein MCM7 depletion promotes mitotic exit by inhibiting CDK1 activity[J]. Sci Rep,2017,7(1):2854. doi: 10.1038/s41598-017-03148-3
|
|
[9]
|
Zhou Y M, Zhang X F, Cao L, et al. MCM7 expression predicts post-operative prognosis for hepatocellular carcinoma[J]. Liver Int,2012,32(10):1505-1509. doi: 10.1111/j.1478-3231.2012.02846.x
|
|
[10]
|
罗兰, 吴艳瑞, 张闻, 等. PCNA基因在小鼠睾丸发育过程中的表达研究[J].云南大学学报(自然科学版),2016,38(5):820-826.
|
|
[11]
|
Haldar S, Roy A, Banerjee S. Differential regulation of MCM7 and its intronic miRNA cluster miR-106b-25 during megakaryopoiesis induced polyploidy[J]. RNA Biol,2014,11(9):1137-1147. doi: 10.4161/rna.36136
|
|
[12]
|
Lobato S, Tafuri A, Fernandes P A, et al. Minichromosome maintenance 7 protein is a reliable biological marker for human cervical progressive disease[J]. J Gynecol Oncol,2012,23(1):11-15. doi: 10.3802/jgo.2012.23.1.11
|






 下载:
下载: