Analysis of Serum Fat-soluble Vitamin Levels in Infants and Children in Anning City
-
摘要:
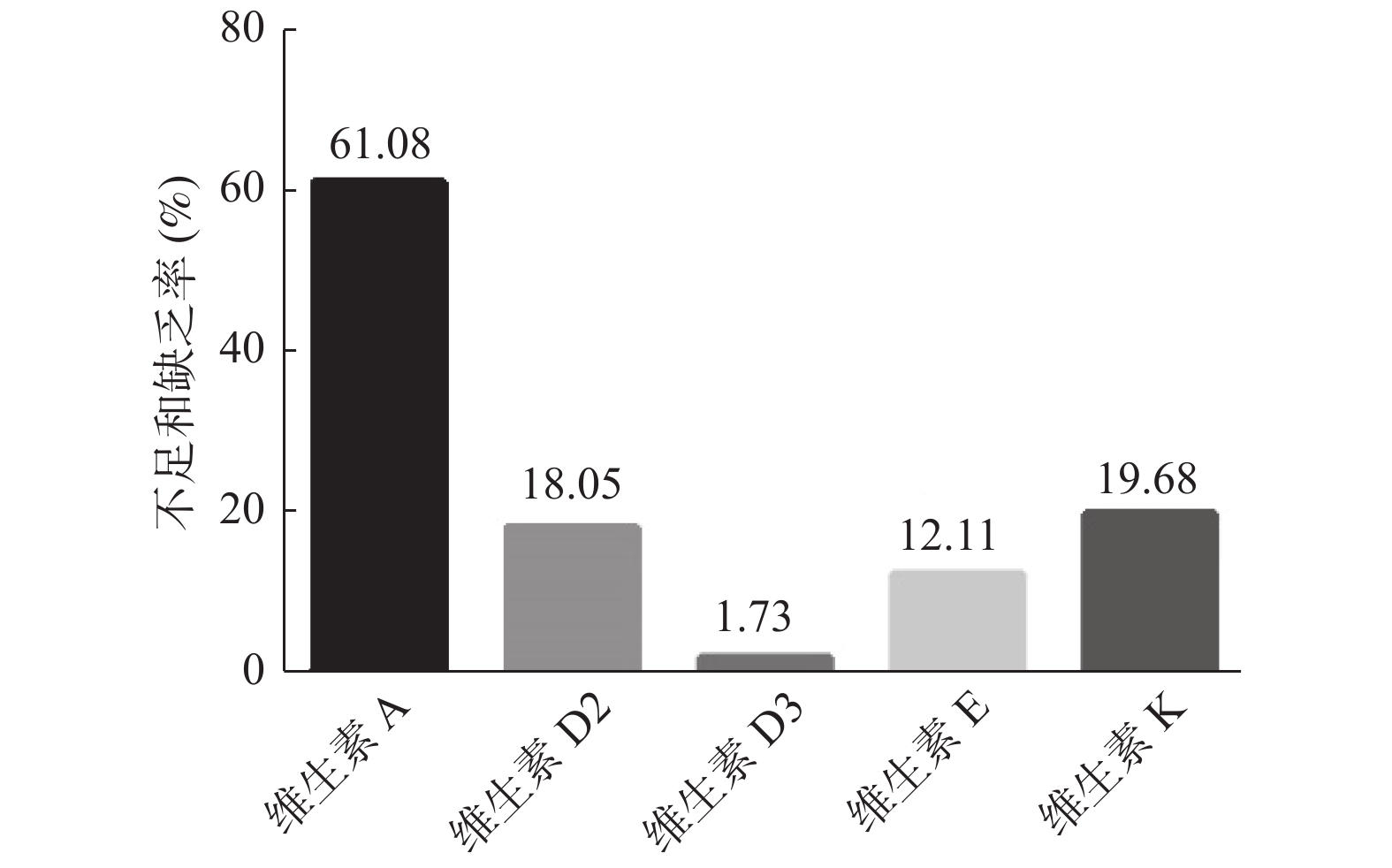
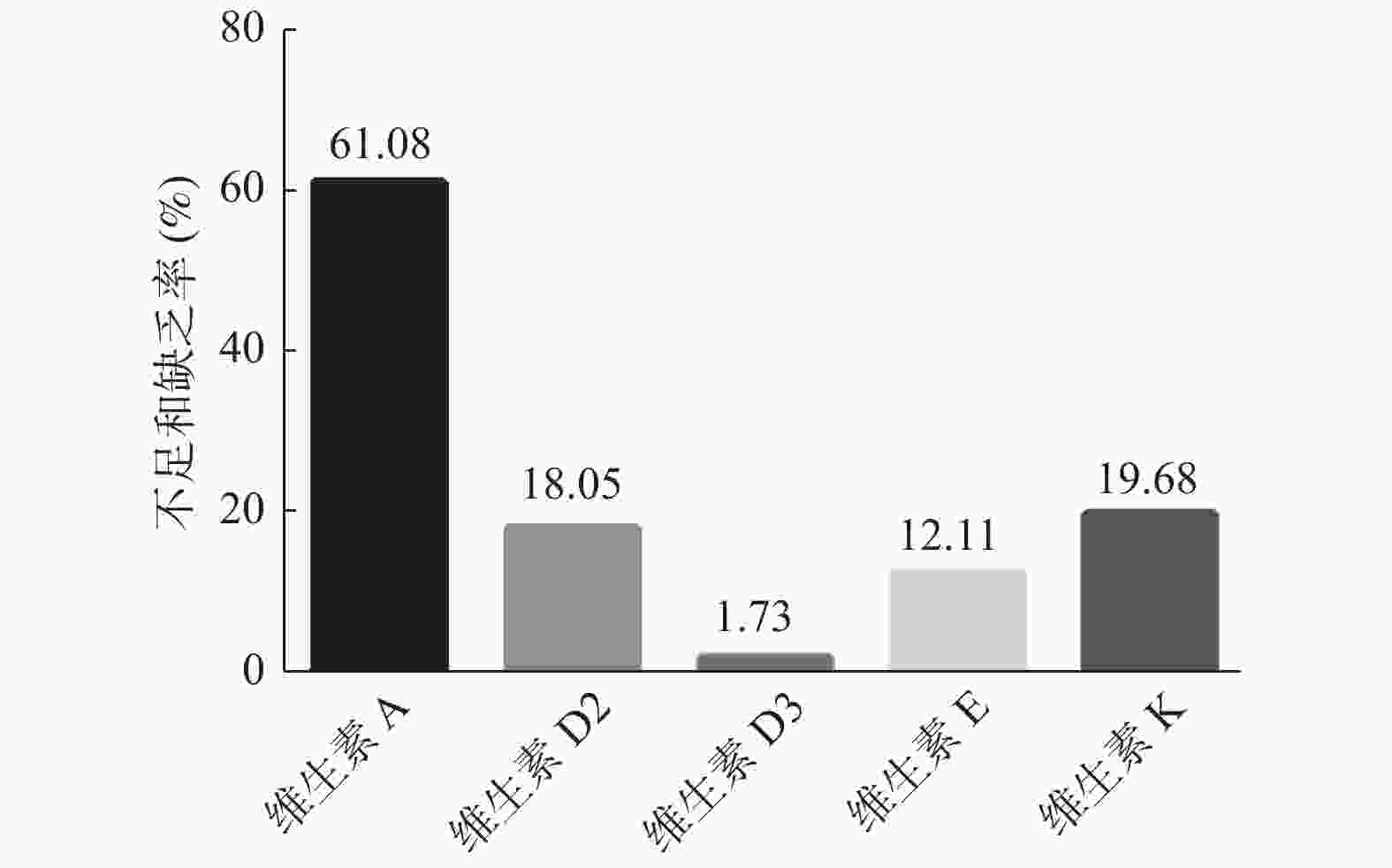
目的 了解安宁市婴幼儿及儿童血清脂溶性维生素水平,为安宁市儿童合理补充脂溶性维生素提供参考。 方法 于2019年6月至2020年7月,选取昆钢医院儿童体检中心925名婴幼儿及儿童,使用高效液相色谱-串联质谱法(HPLC-MS/MS)定量检测血清中脂溶性维生素;根据不同年龄、性别和季节进行脂溶性维生素营养水平分析。 结果 925例婴幼儿及儿童血清维生素A、25-羟基维生素D3、维生素E和维生素K的平均水平及不足和缺乏率分别为:(284±3.84)ng/mL,61.08%(565/925);(34.27±0.46)ng/mL,1.73%(16/925);(8.47±0.16)μg/mL,12.11%(112/925);(0.46±0.03)ng/mL,19.68%(182/925)。不同年龄段(3岁以下,4~6岁,7~12岁)之间及不同季节之间脂溶性维生素水平,差异有统计学意义(P < 0.01)。 结论 安宁市婴幼儿及儿童维生素A严重缺乏,需要密切关注,合理补充。由于天然的日照优势,维生素D营养水平较好,因避免盲目过度补充。 Abstract:Objective To investigate the serum fat-soluble vitamins levels in infants and children in Anning City, to provide reference data for reasonable fat-soluble vitamin supplementation. Methods From June 2019 to July 2020, 925 infants and children from Children’ s Physical Examination Center of Kungang Hospital were selected. High performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) was used to test the serum fat-soluble vitamins quantitatively. Then the fat-soluble vitamins levels were analyzed based on different ages, genders, and seasons. Results The average levels as well as insufficiency and deficient rates of serum vitamin A, 25-hydroxyvitamin D3, vitamin E and vitamin K in 925 infants and children were (284±3.84) ng/mL, 61.08%(565/925); (34.27±0.46)ng/mL, 1.73%(16/925); (8.47±0.16)μg/mL, 12.11%(112/925) and (0.46±0.03)ng/mL, 19.68%(182/925), respectively. There were differences between different age groups (age range 0-3, 4-6, 7-12) and seasons (P < 0.01). Conclusion There was a serious deficiency of vitamin A, which requires close attention and reasonable supplement. Due to the natural sunshine advantage in Yunnan, vitamin D nutrition level is relatively good, and excessive supplementation should be avoided. -
表 1 不同性别血清脂溶性维生素水平比较(
$\bar x\pm s$ )Table 1. Comparison of fat-soluble vitamin levels in serum between different genders (
$\bar x\pm s$ )性别 维生素A
(ng/mL)25-羟基维生素D2
(ng/mL)25-羟基维生素D3
(ng/mL)维生素E
(μg/mL)维生素K
(ng/mL)男(n = 508) 281.16 ± 4.85 4.82 ± 0.26 35.19 ± 0.61 8.29 ± 0.15 0.41 ± 0.03 女(n = 417) 289.53 ± 6.11 4.95 ± 0.23 33.15 ± 0.68 8.70 ± 0.30 0.51 ± 0.05 t −1.086 −0.375 2.243 −1.298 −1.753 p 0.278 0.708 0.025* 0.194 0.080 *P < 0.05。 表 2 不同性别血清脂溶性维生素的正常、不足和缺乏率比较[n(%)]
Table 2. Comparison of normal,insufficiency and deficient rates of serum fat-soluble vitamin levels between different genders [n(%)]
性别 维生素A 25-羟基维生素D2 25-羟基维生素D3 维生素E 维生素K 缺乏和不足 正常 缺乏和不足 正常 缺乏和不足 正常 缺乏和不足 正常 缺乏和不足 正常 男(n = 508) 327(64.37) 181(35.63) 98(19.29) 410(80.71) 8(1.57) 500(98.43) 61(12.00) 447(88.00) 112(22.05) 396(77.95) 女(n = 417) 245(58.75) 172(41.25) 69(16.55) 348(83.45) 8(1.92) 409(98.08) 51(12.23) 366(87.77) 70(16.79) 347(83.21) x2 3.015 1.17 0.159 0.011 4.010 P 0.082 0.280 0.690 0.918 0.045* *P < 0.05。 表 3 不同季节血清脂溶性维生素水平比较(
$\bar x\pm s$ )Table 3. Comparison of fat-soluble vitamin levels in serum among seasons (
$\bar x\pm s$ )季节 维生素A
(ng/mL)25-羟基维生素D2
(ng/mL)25-羟基维生素D3
(ng/mL)维生素E
(μg/mL)维生素K
(ng/mL)春季(n = 91) 250.91 ± 12.85 5.37 ± 0.48 33.11 ± 1.59 8.48 ± 0.34 0.28 ± 0.03 夏季(n = 196) 326.79 ± 10.78a 3.37 ± 0.33a 39.48 ± 1.15a 10.44 ± 0.31a 0.72 ± 0.11a 秋季(n = 230) 262.64 ± 5.74b 3.99 ± 0.43a 35.88 ± 0.88b 9.22 ± 0.49b 0.49 ± 0.05 冬季(n = 408) 284.98 ± 5.19 abc 5.99 ± 0.24bc 31.12 ± 0.58bc 7.11 ± 0.12abc 0.36 ± 0.02 合计(n = 925) 284.93 ± 3.84 4.88 ± 0.18 34.27 ± 0.46 8.47 ± 0.16 0.46 ± 0.03 F 14.389 13.942 18.501 25.196 8.876 P < 0.001 < 0.001 < 0.001 < 0.001 < 0.001 与春季比较,aP < 0.01;与夏季比较,bP < 0.01;与秋季比较,cP < 0.01。 表 4 不同年龄段血清脂溶性维生素水平比较(
$\bar x\pm s$ )Table 4. Comparison of fat-soluble vitamin levels in serum among age groups (
$\bar x\pm s$ )年龄段 n 维生素A
(ng/mL)25-羟基维生素D2
(ng/mL)25-羟基维生素D3
(ng/mL)维生素E
(μg/mL)维生素K
(ng/mL)年龄 婴幼儿期 667 277.51 ± 4.35 4.80 ± 0.22 36.80 ± 0.53 8.85 ± 0.21 0.43 ± 0.03 学龄前期 144 287.95 ± 9.84 5.17 ± 0.40 30.34 ± 1.08a 7.69 ± 0.26a 0.53 ± 0.14 学龄期 114 324.53 ± 12.33ab 4.99 ± 0.45 24.41 ± 0.86ab 7.25 ± 0.26a 0.52 ± 0.06 总体 925 284.93 ± 3.84 4.88 ± 0.18 34.27 ± 0.46 8.47 ± 0.16 0.46 ± 0.03 F 8.088 31.5 50.807 7.624 10.37 P < 0.001 < 0.001 < 0.001 < 0.001 < 0.001 与婴幼儿期比较,aP < 0.01;与学龄前期比较,bP < 0.01。 -
[1] 白英杰, 黄姗姗, 汪云. 维生素A和维生素D及维生素E与儿童反复呼吸道感染的相关性研究[J]. 中国医药,2020,15(10):1542-1544. [2] 杨春, 陈竞, 云春凤, 等. 中国中小城市小学生维生素A缺乏和贫血现况调查[J]. 卫生研究,2016,45(3):489-491. [3] Alshamrani Hassan A, Alloub Hana, Burke Derek, et al. Vitamin D intake, calcium intake and physical activity among children with wrist and ankle injuries and the association with fracture risk[J]. Nutr Health,2019,25(2):113-118. doi: 10.1177/0260106019826422 [4] Kuchan Matthew J, Jensen Søren K, Johnson Elizabeth J, et al. The naturally occurring α-tocopherol stereoisomer RRR-α-tocopherol is predominant in the human infant brain[J]. Br J Nutr,2016,116(1):126-31. doi: 10.1017/S0007114516001719 [5] 刘永英, 李昉明, 陈一菁, 程明, 李宏. 133例非创伤性婴儿颅内出血的临床特征分析[J]. 新医学,2020,51(2):113-116. doi: 10.3969/j.issn.0253-9802.2020.02.007 [6] Holick Michael F, Binkley Neil C, Bischoff-Ferrari Heike A, et al. Evaluation, treatment, and prevention of vitamin deficiency: an Endocrine Society clinical practice guideline[J]. J Clin Endocrinol Metab,2011,96(7):1911-1930. doi: 10.1210/jc.2011-0385 [7] Zhang Yuning, Bala Veenu, Mao Zhihao, et al. Quantification of fat-soluble vitamins and their metabolites in biological matrices: an updated review[J]. Bioanalysis,2020,12(9):625-640. doi: 10.4155/bio-2020-0069 [8] Le Juan, Yuan Tengfei, Zhang Yan, et al. New LC-MS/MS method with single-step pretreatment analyzes fat-soluble vitamins in plasma and amniotic fluid[J]. Journal of Lipid Research,2018,59(9):1783-1790. doi: 10.1194/jlr.D087569 [9] Albahrani A A, Rotarou V, Roche P J, et al. A simultaneous quantitative method for vitamins A, D and E in human serum using liquid chromatography-tandem mass spectrometry[J]. J Steroid Biochem Mol Biol,2016,159(5):41-53. [10] Katsa M, Papalouka N, Mavrogianni T, et al. Comparative study for the determination of fat-soluble vitamins in rice cereal baby foods using HPLC-DAD and UHPLC-APCI-MS/MS[J]. Foods,2021,10(3):648. doi: 10.3390/foods10030648 [11] 金春华.中国儿童维生素A、E缺乏与呼吸道感染[M].北京:人民卫生出版社, 2019: 176-690. [12] 李少维, 林惠玲, 叶桂青, 等. 婴幼儿及儿童血清维生素A、维生素E及维生素D水平分析[J]. 中国妇幼健康研究,2020,31(9):1161-1165. doi: 10.3969/j.issn.1673-5293.2020.09.008 [13] Chen Yu-Juan, Liu Miao, Mao Cui-Yin, et al. An Investigation of Vitamin Levels Status in the Serum of children in China[J]. Biomed Res Int,2018,18(11):6592757. [14] Miyazawa Taiki, Burdeos Gregor C, Itaya Mayuko, et al. Vitamin E: Regulatory redox interactions[J]. IUBMB Life,2019,71(4):430-441. doi: 10.1002/iub.2008 [15] 陈曦, 宫照龙, 沈葹. 超高效液相色谱-三重四级杆串联质谱法测定血清中维生素A和维生素E[J]. 卫生研究,2021,50(2):301-307. [16] 荣爽, 徐凯, 李婷婷, 等. 维生素与免疫功能[J]. 营养学报,2020,42(6):613-617. doi: 10.3969/j.issn.0512-7955.2020.06.020 [17] 谢荣, 李少维, 郑春梅, 等. 健康儿童血清维生素E水平现状分析[J]. 中国儿童保健杂志,2020,28(6):696-698. [18] 吴碧琛, 丁妞, 饶花平, 等. 不同年龄罹患不同呼吸道疾病儿童维生素A、E的水平分析[J]. 中国医师杂志,2020,22(10):1497-1500. doi: 10.3760/cma.j.cn431274-20200623-00857 [19] 傅卓, 付俊鲜, 杨光路. 儿童肺炎支原体肺炎外周血血清维生素A、D、E的变化及相关性[J]. 内蒙古医科大学学报,2020,42(5):495-496. [20] 陈洁琳, 覃敏, 杨晓祥, 等. 反复呼吸道感染儿童的免疫状态与维生素A/E缺乏情况[J]. 广西医学,2020,42(17):2199-2201. [21] 金春华, 王晓燕, 张丽丽, 等. 健康儿童脂溶性维生素A、D、E现状分析[J]. 中华临床营养杂志,2016,24(6):349-353. doi: 10.3760/cma.j.issn.1674-635X.2016.06.005 [22] 蒋益忠, 夏天爽, 辛海量, 等. 维生素K对成骨细胞骨形成和破骨细胞骨吸收的影响[J]. 药学实践杂志,2020,38(4):340-345. [23] 王倩, 赵莉, 武艳梅, 等. 盘锦市0~6岁儿童骨密度调查及其与血清维生素K的关系研究[J]. 中国实用医药,2020,15(25):164-165. [24] 于雪, 王明月, 赵雪, 等. 血清维生素A、维生素D、维生素K水平与营养性矮身材(脾气虚证)的相关性研究[J]. 中医药导报,2020,26(14):64-66. -





 下载:
下载: