Effects of Different Concentrations of Magnesium Ions on Endothelial Progenitor Cells in Women with Gestational Diabetes
-
摘要:
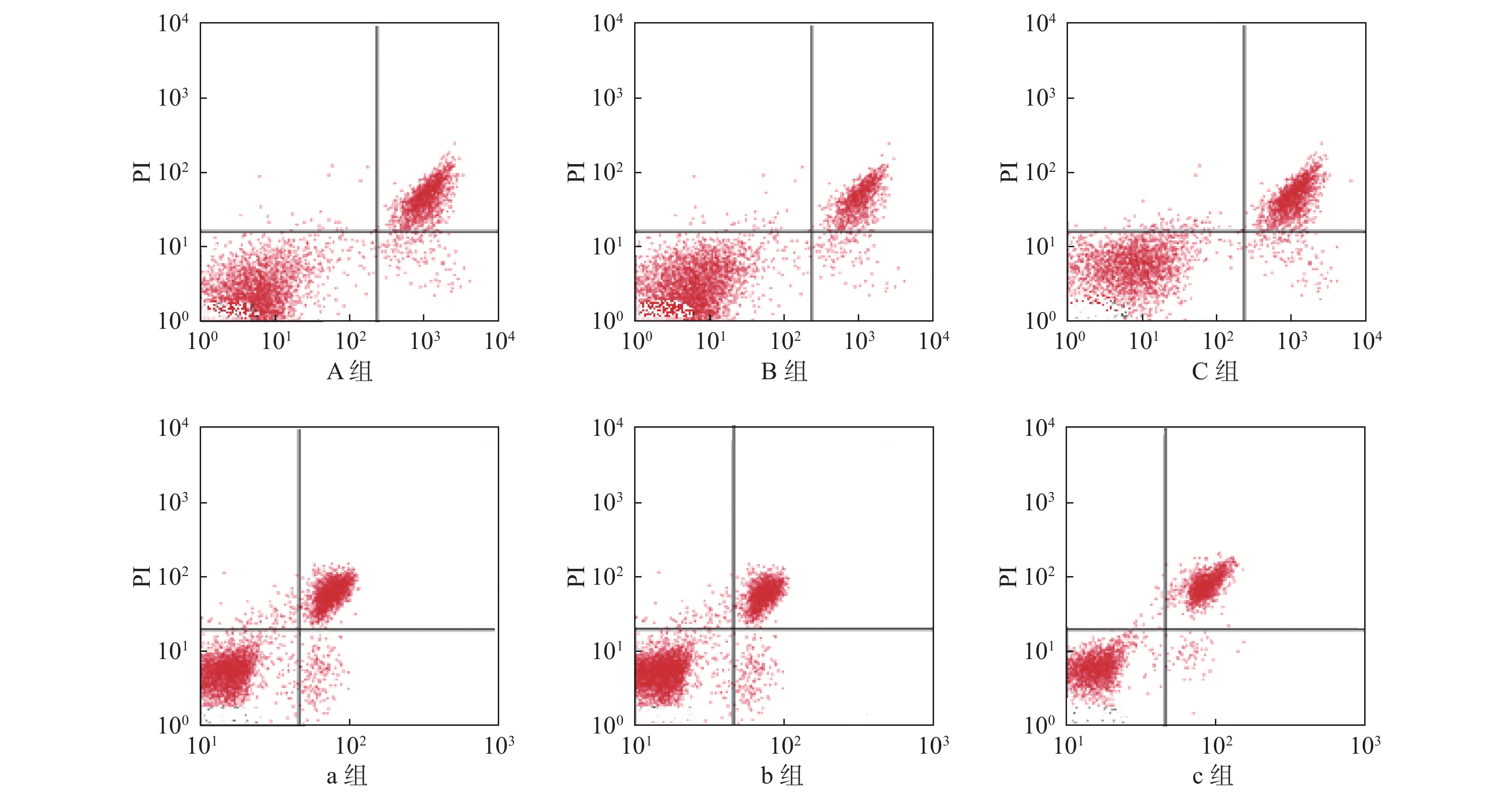
目的 探究不同浓度镁离子干预对妊娠糖尿病(gestaional diabetes mellitus,GDM)妇女内皮祖细胞(endothelial progenitor cells,EPCs)的影响。 方法 选取2016年5月至2020年3月的204例妊娠期糖尿病患者为观察组,并选取同期住院的204例正常妊娠妇女为对照组,采用随机数字表法将观察组分为3组,并分别给予浓度不同的镁离子进行干预,A组(4 mmol/L)、B组(8 mmol/L)、C组(16 mmol/L);采用同样的方法将对照组分为3组,并分别给予浓度不同的镁离子进行干预,a组(4 mmol/L)、b组(8 mmol/L)、c组(16 mmol/L)。6组患者中每组均为68例。6组患者中每位孕妇均入组进行脐血分离培养,每例均为6孔细胞入组。对EPCs细胞增殖、凋亡、粘附、细胞周期进行比较。 结果 观察组3组妇女的增殖能力均低于对照组3组,且B组优于A组,A组优于C组;b组优于a组,a组优于c组;以正常人群的细胞凋亡率为100%,观察组3组妇女的增殖能力均高于对照组3组,且B组低于A组,A组低于C组,b组低于a组,a组低于c组,差异有统计学有意义(P < 0.05)。使用Image J软件计算,观察组3组妇女的细胞面积和细胞密度均低于对照组3组,且B组高于A组,A组高于C组,b组高于a组,a组高于c组,差异有统计学有意义(P < 0.05)。观察组3组妇女细胞生长停滞在G0/G1期少于对照组3组,且B组优于A组,A组优于C组,b组优于a组,a组优于c组,差异有统计学有意义(P < 0.05)。 结论 8 mmol/L的镁离子可能与妊娠期妇女EPCs的增殖和粘附相关,进而抑制凋亡,改善细胞周期,且对GDM妇女的作用更显著,进一步研究后可用于帮助改善GDM孕产妇的妊娠结局。 Abstract:Objective To explore the effects of different concentrations of magnesium ion intervention on endothelial progenitor cells (endothelial progenitor cells, EPCs) in women with gestational diabetes (gestaional diabetes mellitus, GDM). Methods 204 cases of gestational diabetes mellitus from May 2016 to March 2020 were selected as the observation group, and 204 cases of normal pregnant women hospitalized during the same period were selected as the control group. The observation group was divided into group A (4 mmol/L), group B (8 mmol/L) and group C (16 mmol/L) by random number table method, and were treated with different concentrations of magnesium ions. Using the same method, the control group was divided into group a (4 mmol/L), group b (8 mmol/L) and group c (16 mmol/L), and was also given different concentrations of magnesium ions. There were 68 patients in each of the six groups. In the six groups of patients, each pregnant woman was enrolled for cord blood isolation and culture, and each case was enrolled with 6-well cells. The cell proliferation, apoptosis, adhesion and cell cycle of EPCs were compared. Results The proliferative capacity of the three groups of women in the observation group was lower than the those of control group, with group B better than group A, group A better than group C, group b better than group a, and group a better than group c. The apoptosis rate is 100% in normal population. The proliferative capacity of the three groups of women in the observation group is higher than that in the control group, with group B lower than group A, group A lower than group C, group b lower than group a, group a lower than group c, the difference is statistically significant (P < 0.05). According to the calculation using Image J software, the cell area and cell density in the observation group were lower than those in the control group, with group B higher than group A, group A higher than group C, group b higher than group a, and group a higher than group c; the difference is statistically significant (P < 0.05). The occurrence of G0 / G1 phase cell cycle arrest in the observation group was lower than that in control group, with group B better than group A, group A better than group C, group b better than group a, and group a better than group c, the difference is statistically significant (P < 0.05). Conclusion 8 mmol/L magnesium ion may be associated with the proliferation and adhesion of EPCs in pregnant women, thus inhibiting apoptosis and upregulating cell cycle, and its effect on women with GDM is more evident, which can be used to help improve the pregnancy outcome of pregnant women with GDM after further study. -
Key words:
- Gestational diabetes /
- Endothelial progenitor cells /
- Magnesium ion
-
表 1 对EPCs细胞增殖和凋亡的影响(
$\bar x \pm s$ )Table 1. Effects on proliferation and apoptosis of EPCs (
$\bar x \pm s$ )分组 n CCK-8(λ = 450 mm) 凋亡率(%) A组 68 0.20 ± 0.05 279.07 ± 59.84 B组 68 0.23 ± 0.06 214.43 ± 57.76 C组 68 0.18 ± 0.03 317.65 ± 63.32 a组 68 0.28 ± 0.04 121.67 ± 34.52 b组 68 0.30 ± 0.05 95.78 ± 21.34 c组 68 0.25 ± 0.03 156.64 ± 30.09 F 73.541 53.652 P < 0.001 < 0.001 表 2 对EPCs细胞粘附的影响(
$\bar x \pm s$ )Table 2. Effects on EPCs cell adhesion (
$\bar x \pm s$ )分组 n 细胞面积(μm2) 细胞密度(cells/mm2) A组 68 5744.38 ± 1022.47 73.32 ± 7.10 B组 68 6193.26 ± 983.77 76.45 ± 6.31 C组 68 5489.05 ± 883.21 70.78 ± 5.57 ` a组 68 7348.79 ± 1143.25 81.06 ± 8.22 b组 68 7548.43 ± 1290.83 82.90 ± 7.43 c组 68 7054.27 ± 1075.43 79.13 ± 8.63 F 63.891 43.857 P < 0.001 < 0.001 表 3 对EPCs细胞周期的影响(
$\bar x \pm s$ )Table 3. Effects on EPCs cell cycle (
$\bar x \pm s$ )分组 n G0/G1 S G2/M A组 68 81.33 ± 2.78 13.36 ± 2.08 3.92 ± 1.43 B组 68 79.19 ± 3.07 15.64 ± 2.77 4.35 ± 1.70 C组 68 84.52 ± 3.14 11.97 ± 1.88 3.65 ± 1.23 a组 68 72.13 ± 2.56 22.98 ± 1.95 5.06 ± 0.78 b组 68 67.56 ± 2.61 26.24 ± 3.17 5.67 ± 1.32 c组 68 77.35 ± 3.56 17.89 ± 2.03 4.98 ± 1.56 F 49.976 63.532 17.037 P < 0.001 < 0.001 < 0.001 -
[1] Lee K W,Ching S M,Hoo F K,et al. Neonatal outcomes and its association among gestational diabetes mellitus with and without depression,anxiety and stress symptoms in Malaysia:A cross-sectional study[J]. Midwifery,2020,81(1):102586. [2] Pâmela A D S,José M M,Emerson RDS,et al. Gestational diabetes in the population served by brazilian public health care. prevalence and risk factors[J]. Rev Bras Ginecol Obstet,2020,42(1):12-18. doi: 10.1055/s-0039-1700797 [3] Gao L,Lin LY,Shan N,et al. The impact of omega-3 fatty acid supplementation on glycemic control in patients with gestational diabetes:A systematic review and meta-analysis of randomized controlled studies[J]. J Matern Fetal Neonatal Med,2020,33(10):1767-1773. doi: 10.1080/14767058.2018.1526916 [4] Jacinda M N,Chloe A Z,Ellen W S. Predictors of very early postpartum weight loss in women with recent gestational diabetes mellitus[J]. J Matern Fetal Neonatal Med,2020,33(1):120-126. doi: 10.1080/14767058.2018.1487937 [5] Li F J,Li P,Huang G N,et al. Influence of omega-3 fatty acid and vitamin co-supplementation on metabolic status in gestational diabetes:A meta-analysis of randomized controlled studies[J]. Eur J Obstet Gynecol Rreprod Biol,2020,247(1):191-197. [6] 刘玉花,翟露. 内皮祖细胞与糖尿病患者心血管并发症关系的研究进展[J]. 医学研究生学报,2020,33(1):88-92. [7] International Association of Diabetes and Pregnancy Study Groups Consensus Panel,Metzger B E,Gabbe SG,et a1. International association of diabetes and pregnancy study groups recommendations on the diagnosis and classification of hyperglycemia in pregnancy[J]. Diabetes Care,2010,33(3):676-682. doi: 10.2337/dc09-1848 [8] 许旭,李俊林. 妊娠期糖尿病产妇分娩的新生儿低血糖发生率及产科危险因素分析[J]. 川北医学院学报,2019,34(4):419-422. doi: 10.3969/j.issn.1005-3697.2019.04.26 [9] Beatriz B,Lucrecia H,Nuria M S,et al. Increased risk of neonatal complications or death among neonates born small for gestational age to mothers with gestational diabetes[J]. Diabetes Res Clin Pract,2020,159(1):1688-1693. [10] 刘阳,吴艳,喻荷淋,等. 格列齐特结合舒洛地特对2型糖尿病早期肾病患者血管内皮功能的影响[J]. 广西医科大学学报,2016,33(2):325-327. [11] Harper L M,Jauk V,Longo S,et al. Early gestational diabetes screening in obese women:A randomized controlled trial[J]. Am J Obstet Gynecol,2020,1(9):3284-3290. [12] Buemi M,Allegra A,DAnna R,et al. Concentrarion of circulating endothelialprogenitor cells(EPC)in normal pregnancy and in preset women with diabetes and hypertension[J]. Am J Obstet Gynaeol,2007,196(1): 1- 6. doi: 10.1016/j.ajog.2006.08.032 [13] 熊雯,初红霞,张宪党,等. 滤泡调节性T细胞促进修复糖尿病损伤颈动脉内皮的作用及机制研究[J]. 中国糖尿病杂志,2019,27(9):701-706. doi: 10.3969/j.issn.1006-6187.2019.09.012 [14] 郭梓. 内皮祖细胞与糖尿病血管再生障碍的研究进展[J]. 临床与病理杂志,2019,39(7):1548-1554. doi: 10.3978/j.issn.2095-6959.2019.07.028 [15] 刘景雪,黄瑾. 改善糖尿病内皮祖细胞功能的研究进展[J]. 药学实践杂志,2020,38(1):18-21. [16] 李波,胡海艳,杨茂春,等. 妊娠糖尿病患者血清镁离子、铬离子水平及其临床意义[J]. 广西医学,2018,40(14):1565-1567. [17] 马晓婕,金兰. 葛根芩连汤联合普罗布考对糖尿病视网膜病变患者血清钙镁离子sICAM-1及CTGF水平影响研究[J]. 现代中西医结合杂志,2018,27(6):657-660. doi: 10.3969/j.issn.1008-8849.2018.06.027 [18] 杨舒羽,王明娇,曾素根,等. 血清镁水平与糖尿病前期及糖尿病发生风险的相关性研究[J]. 川北医学院学报,2018,33(3):395-397. doi: 10.3969/j.issn.1005-3697.2018.03.026 [19] 褚晨,王从容. 血清镁与糖尿病及其并发症相关性的研究进展[J]. 中华老年多器官疾病杂志,2017,16(4):300-303. doi: 10.11915/j.issn.1671-5403.2017.04.070 [20] 王永霞. 糖尿病肾病患者血清生化指标水平与病情的关系分析[J]. 中国民康医学,2018,30(4):14-15,31. doi: 10.3969/j.issn.1672-0369.2018.04.006 [21] Mishu F A,Boral N,Ferdous N,et al. Estimation of serum zinc,copper and magnesium levels in bangladeshi women with gestational diabetes mellitus attending in a tertiary care hospital[J]. Mymensingh Med J,2019,28(1):157-162. [22] Corvera A C E, Pedroza E D, Irais C M, et al. Deranged fractional excretion of magnesium and serum magnesium levels in relation to retrograde glycaemic regulation in patients with type 2 diabetes mellitus[J]. Current Diabetes Reviews,2021,17(1):91-100. [23] Asbaghi O, Hosseini R, Boozari B, et al. The effects of magnesium supplementation on blood pressure and obesity measure among type 2 diabetes patient: A systematic review and Meta-analysis of randomized controlled trials[J]. Biological Trace Element Research,2021,199(2):413-424. [24] Shah I U,Sameen A, Manzoor M F,et al. Association of dietary calcium, magnesium, and vitamin D with type 2 diabetes among US adults: National health and nutrition examination survey 2007—2014—A cross-sectional study[J]. Food Science & Nutrition,2021,9(3):1480-1490. [25] 于望舒,任新慧,郭晓宇,等. 哈尔滨居民膳食镁摄入量及膳食模式与2型糖尿病患病风险的关联研究[J]. 中华预防医学杂志,2019,53(6):559-564. doi: 10.3760/cma.j.issn.0253-9624.2019.06.004 [26] Nabouli M R,Lassoued L,Bakri Z,et al. Modification of total magnesium level in pregnant saudi women developing gestational diabetes mellitus[J]. Diabetes Metab Syndr,2016,10(4):183-185. doi: 10.1016/j.dsx.2016.06.001 [27] 王健. 镁离子对成骨细胞生物学行为的促进作用及其机制研究[D]. 西安: 第四军医大学西京医院硕士论文, 2015. [28] Richards C,Thomas-Purcell K B,Vemulapalli K C,et al. Woman to Woman:Implementation of a cervical cancer education training program for grenadian lay health advisors[J]. J Cancer Educ,2020,35(49):557-562. [29] Erenoğlu R,Şengül Y S. The effect of health education given to syrian refugee women in their own language on awareness of breast and cervical cancer,in turkey:A randomized controlled trial[J]. J Cancer Educ,2020,35(1):241-247. [30] Nancy I E,Salome A E,Christiana A,et al. Impact of health education intervention on knowledge and perception of cervical cancer and screening for women in ghana[J]. BMC Public Health,2019,19(1):1505. doi: 10.1186/s12889-019-7867-x -






 下载:
下载: