Adverse Reactions Analysis and Prediction Model of Cefoperazone Sodium Sulbactam Sodium
-
摘要:
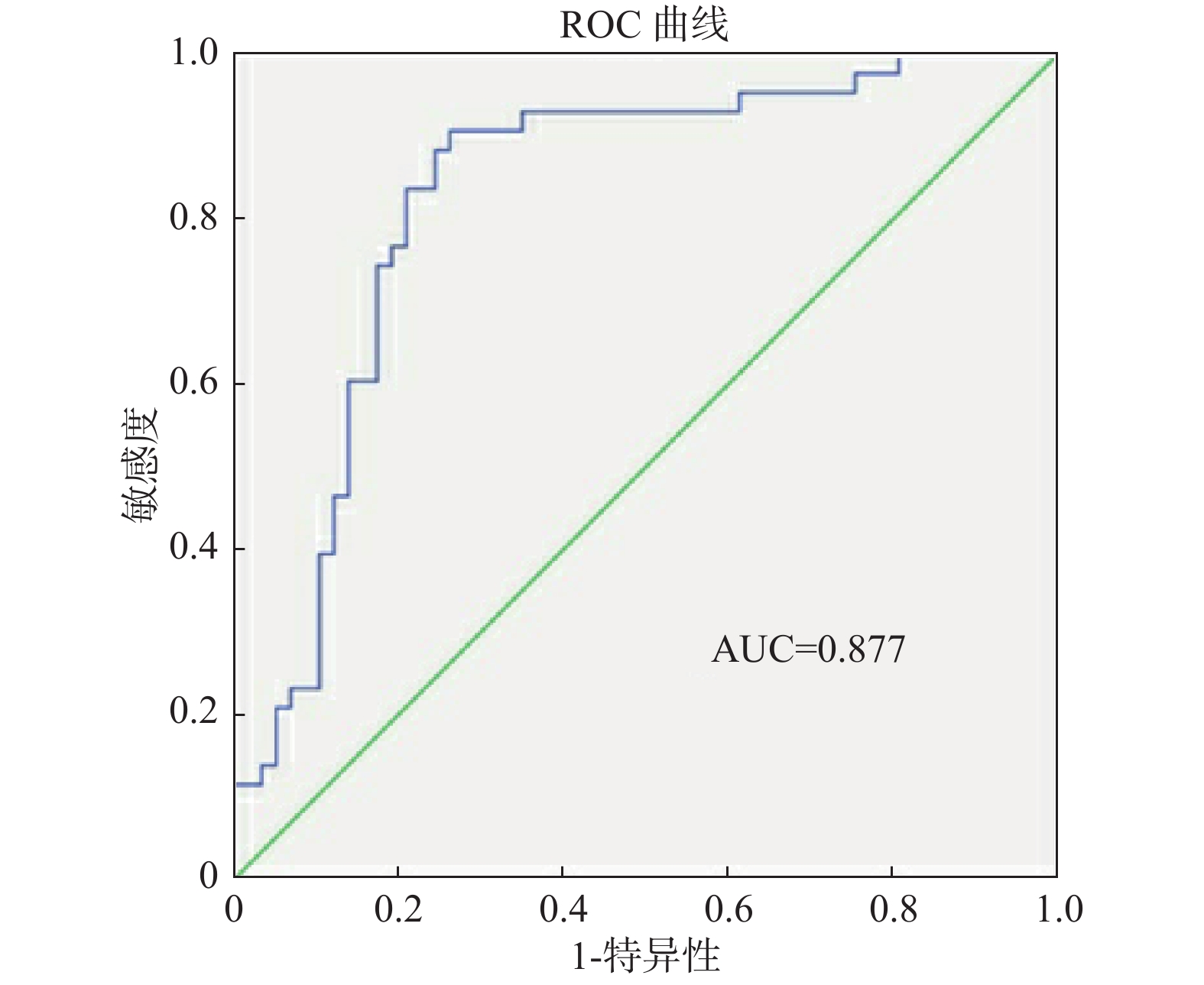
目的 通过分析注射用头孢哌酮钠舒巴坦钠在昆明市医疗机构中使用的安全性,探索其发生不良反应(ADR)的影响因素,以及因素之间的相关性,从而构建其发生不良反应的预测模型,为临床合理应用提供参考。 方法 提取2015年01月至2020年06月期间,昆明市药品不良反应报告监测数据库中注射用头孢哌酮钠舒巴坦钠的不良反应报告222份作为观察组,同期使用注射用头孢哌酮钠舒巴坦钠未发生不良反应的250份病例作为对照组,收集2组患者的临床资料,通过相关性分析因素之间的关系;采用多因素Logistic回归分析发生不良反应的相关因素,根据结果拟合构建发生不良反应的预测模型;通过受试者工作特征(ROC)曲线评价预测模型的效能。 结果 相关性分析结果显示,年龄与原患疾病的例次呈正相关关系(Kendall’ s tau-b = 0.764,P < 0.05);用药时间与住院时间呈负相关关系(r = -0.124,P < 0.05);多因素Logistic回归分析结果显示:退休人员、肝肾功能损伤患者、用药时间在(11~15)d是头孢哌酮钠舒巴坦钠发生不良反应的相关因素,其预测模型为Logit(P) = 1.357 + 3.485 × 肝肾功能损伤 + 2.681 × 用药天数(11~15),该模型ROC曲线下面积为0.877,预测模型的灵敏度为91.8%,特异度为77.4%。 结论 肝肾功能损伤患者、用药时间在11~15 d是头孢哌酮钠舒巴坦钠发生不良反应的相关因素,该预测模型具有较高的临床应用价值。 -
关键词:
- 注射用头孢哌酮钠舒巴坦钠 /
- 药品不良反应 /
- 预测模型
Abstract:Objective To analyze the safety of cefoperazone Sodium and Sulbactam Sodiumfor injection in Kunming medical institutions, explore the influencing factors of adverse reactions (ADR) and the correlation between the factors, so as to construct the prediction model of adverse reactions, and provide reference for the rational application ofcefoperazone Sodium and Sulbactam Sodium in clinical practice. Methods From January 2015 to June 2020, 222 adverse reaction reports of cefoperazone sodium and sulbactam sodium for injection in the Kunming City Adverse Drug Reaction Report Monitoring Database were extracted as the observation group. During the same period, no adverse reaction occurred when using cefoperazone sodium and sulbactam sodium for injection, The 250 responding cases were used as the control group. The clinical data of the two groups of patients were collected, and the relationship between the factors was analyzed through correlation; the related factors of adverse reactions were analyzed by multivariate logistic regression, and the prediction of adverse reactions was constructed according to the results Model. Evaluate the effectiveness of predictive models through receiver operating characteristic (ROC) curves. Results Correlation analysis showed that age was positively correlated with the number of primary diseases (Kendall’ s tau-b = 0.764, P < 0.05). There was a negative correlation between medication time and hospital stay (r = -0.124, P < 0.05). Multivariate logistic regression analysis showed that retirees, patients with liver and kidney dysfunction, and medication time (11-15) days were related factors for the adverse reactions of cefoperazone sodium and sulbactam sodium. The prediction model is logit (P)= 1.357 + 1.739 × retirees + 3.485 × liver and kidney damage + 2.681 × days of medication (11-15). The area under the ROC curve of this model is 0.877, and the sensitivity and specificity are 91.8% and 77.4%, respectively. Conclusion Liver and kidney dysfunction patients, medication time (11~15) d are the related factors of adverse reactions of Cefoperazone Sodium and Sulbactam Sodiumand the prediction model has high clinical value. -
表 1 头孢哌酮钠舒巴坦钠不良反应报告患者的性别与年龄分布(n)
Table 1. Gender and age distribution of patients with adverse reactions of cefoperazone sodium and sulbactam sodium (n)
年龄(岁) 男 女 总例数 构成比(%) 5~14 4 8 12 5.40 15~44 20 25 45 20.27 45~64 23 16 39 17.57 ≥ 65 40 86 126 56.76 合计 87 135 222 100.00 注:《国际疾病分类》(ICD-10)编码分类:婴儿期为不足1岁,幼儿期为1~4岁,少儿期为5~14岁,青壮年期为15~44岁,中年期为45~64岁,老年期为65岁及以上。 表 2 头孢哌酮钠舒巴坦钠不良反应报告患者的原患疾病
Table 2. Primary diseases of ADR patients caused by cefoperazone sodium and sulbactam sodium
序号 原患疾病 n 构成比(%) 1 慢性阻塞性肺疾病伴
急性下呼吸道感染210 28.23 2 心功能不全 111 14.91 3 肝损伤 74 9.95 4 高血压 71 9.54 5 糖尿病 46 6.18 6 腰椎退行性病变 50 6.72 7 肺结核 43 5.78 8 肾损伤 41 5.52 9 脑膜炎 33 4.43 10 前列腺增生 24 3.23 11 腹腔感染 26 3.49 12 胃炎 15 2.02 表 3 头孢哌酮钠舒巴坦钠不良反应报告累及系统-器官分布及临床表现(n)
Table 3. The adverse reaction report of cefoperazone sodium and sulbactam sodium involves system-organ distribution and clinical manifestations(n)
累及系统-器官 临床表现 例次 合计 构成比(%) 皮肤及附件损害 瘙痒
红斑疹
局部肿胀
皮肤发红
口唇发绀154
3
26
27
29239 50.53 血液系统损害 凝血功能障碍
白细胞减少17
421 4.44 呼吸系统损害 呼吸困难 65 65 13.74 全身性损害 发热
畏寒31
1546 9.73 消化系统损害 恶心
呕吐53
49102 21.56 表 4 头孢哌酮钠舒巴坦钠不良反应报告患者的用药时间和住院时间
Table 4. Adverse reactions of cefoperazone sodium and sulbactam sodium are reported on the duration of medication and hospital stay in patients
天数
(d)用药时间
(n)构成比
(%)住院时间/
例数(n)构成比
(%)1~5 163 73.42 8 3.60 6~10 39 17.57 24 10.81 11~15 20 9.01 77 34.68 ≥ 16 − − 113 50.91 合计 222 100.00 222 100.00 表 5 头孢哌酮钠舒巴坦钠不良反应的单因素分析
Table 5. Single factor analysis of adverse reactions of cefoperazone sodium and sulbactam sodium
研究因素 观察组(n = 222) 对照组(n = 250) χ2/t P 性别 男 87 131 女 135 119 8.256 0.004* 婚姻 已婚 199 230 未婚 23 20 0.791 0.373 BMI(kg/m2) 21.21 ± 1.56 22.51 ± 3.78 2.314 0.251 年龄(岁) 5~14 12 1 15~44 45 66 45~64 39 62 ≥ 65 126 121 17.018 0.001* 原患疾病(例次) 感染性疾病 236 250 心脑血管疾病 228 203 肝肾功能损伤 115 93 其他 165 199 7.355 0.003* 给药日剂量 1.5 g/Qd 14 7 1.5 g/Tid 19 13 3 g/Bid 34 46 3 g/Tid 155 184 6.099 0.106 用药时间(d) 1~5 163 84 6~10 39 86 11~15 20 68 ≥ 16 − 12 79.741 0.000* 住院时间(d) 1~5 8 12 6~10 24 31 11~15 77 105 ≥ 16 113 102 4.917 0.177 *P < 0.05。 表 6 头孢哌酮钠舒巴坦钠不良反应的多因素分析
Table 6. Multivariate analysis of adverse reactions of cefoperazone Sodium and Sulbactam Sodium
变量 B S.E OR 95% CI Wald χ2 P 常数 1.357 0.664 3.215 − 3.654 0.021* 原患疾病(例次) 感染性疾病 − − 1.000 − 3.392 − 心脑血管疾病 1.549 1.369 6.226 1.141~9.875 3.331 0.157 肝肾功能损伤 3.485 0.535 2.271 1.004~5.567 3.689 0.012* 其他 1.511 1.255 5.412 0.587~10.246 2.021 0.997 用药时间(d) 1~5 − − 1.000 − 5.224 − 6~10 3.698 2.587 1.358 0.487~5.574 2.541 1.568 11~15 2.681 3.523 0.236 0.059~0.623 6.667 0.010* ≥ 16 1.411 1.524 1.968 0.473~2.369 3.569 0.578 *P < 0.05。 -
[1] 金晶,李青,冷光. 头孢哌酮/他唑巴坦不良反应风险因素分析[J]. 药物流行病学杂志,2016,25(6):346-349. [2] 刘宪军,付娜. 109例头孢哌酮钠舒巴坦钠不良反应报告分析[J]. 中国药物警戒,2014,11(6):355-357. [3] 胡新春,邓超英. 呼吸内科抗菌药物的临床应用与分析研究[J]. 国际呼吸杂志,2015,35(21):1617-1619. doi: 10.3760/cma.j.issn.1673-436X.2015.21.004 [4] 陈菲,王璐,王静. 肺炎克雷伯菌耐药与抗菌药物使用强度现况及其关联分析[J]. 蚌埠医学院学报,2019,44(8):1091-1096. [5] 程英,段菲,权晨. 注射用头孢哌酮钠他唑巴坦钠配伍禁忌临床分析[J]. 中国药业,2019,28(3):73-75. doi: 10.3969/j.issn.1006-4931.2019.03.024 [6] 栗啸阳,郭代红,刘思源,等. 13458例头孢菌素类药品不良反应报告分析[J]. 药物流行病学杂志,2020,29(3):166-169. [7] 张士洋,程军,陈志武. 350例头孢菌素类抗生素不良反应报告分析[J]. 安徽医药,2011,15(4):516-518. doi: 10.3969/j.issn.1009-6469.2011.04.053 [8] 何云开,刘产明,曾晓辉. 头孢哌酮钠/舒巴坦钠致喉头水肿及过敏性休克各1例[J]. 江苏药学与临床研究,2004,12(S1):76-76. [9] 王全一,李彦博,傅蓉. 高效凝胶色谱法测定注射用头孢哌酮钠他唑巴坦钠中的高聚物[J]. 中国药业,2013,22(12):83-84. doi: 10.3969/j.issn.1006-4931.2013.12.053 [10] 钟雪,刘田,冯婉玉. 他唑巴坦致过敏反应案例报道及文献复习[J]. 中国新药杂志,2019,28(14):1784-1788. doi: 10.3969/j.issn.1003-3734.2019.14.020 [11] 石姗平,吴雪,农杰昌,等. 头孢哌酮/舒巴坦致凝血功能异常的影响因素分析[J]. 药物流行病学杂志,2019,28(9):578-580. [12] 庞立峰. 注射用头孢哌酮钠舒巴坦钠致凝血功能异常1例[J]. 中国药物警戒,2018,15(5):62-63. [13] 田艳平,朱燕,尹红,等. 46例注射用头孢哌酮/舒巴坦致过敏性休克分析[J]. 中国药物警戒,2010,7(4):246-248. doi: 10.3969/j.issn.1672-8629.2010.04.019 [14] 代蓉,邹玲,赵丽,李晓华,等. 1例头孢哌酮钠他唑巴坦钠过敏性休克病人的急救护理[J]. 护理研究,2015,29(23):2939-2939. doi: 10.3969/j.issn.1009-6493.2015.23.057 [15] 宋明辉,张建伟,张荣厚. 注射用头孢哌酮钠他唑巴坦钠静脉滴注致过敏性休克1例[J]. 海峡药学,2020,32(1):210-211. doi: 10.3969/j.issn.1006-3765.2020.01.090 [16] 施毅,李培. 根据药代动力学/药效动力学理论合理使用氨基糖苷类抗生素[J]. 中华结核和呼吸杂志,2012,35(10):726-728. doi: 10.3760/cma.j.issn.1001-0939.2012.10.004 [17] 马亚松,李敏,贾玉捷,孙燕,杨宏硕. 注射用头孢哌酮钠他唑巴坦钠与输液配伍稳定性研究[J]. 化工管理,2020,10(4):95-96. doi: 10.3969/j.issn.1008-4800.2020.04.061 [18] 金晶,李青,冷光. 山西省头孢哌酮钠他唑巴坦钠不良反应报告分析[J]. 山西医药杂志,2016,45(10):1159-1161. [19] 张扣兴,唐英春,毕筱刚,等. 头孢哌酮钠/他唑巴坦钠体外抗菌活性和影响因素[J]. 中国临床药理学杂志,2001,17(3):195-198. doi: 10.3969/j.issn.1001-6821.2001.03.010 [20] 朱芸. 浅析静脉滴注头孢哌酮/他唑巴坦所致不良反应的特点[J]. 健康必读,2019(23):16-17. [21] 范晓. 浅析静脉滴注头孢哌酮/他唑巴坦所致不良反应的特点[J]. 当代医药论丛,2017,15(3):8-9. doi: 10.3969/j.issn.2095-7629.2017.03.006 [22] 张楠,郭晓昕,贾海忠. 避免药物不良反应发生的方法学研究进展[J]. 中国药物警戒,2020,17(1):56-62. -






 下载:
下载: