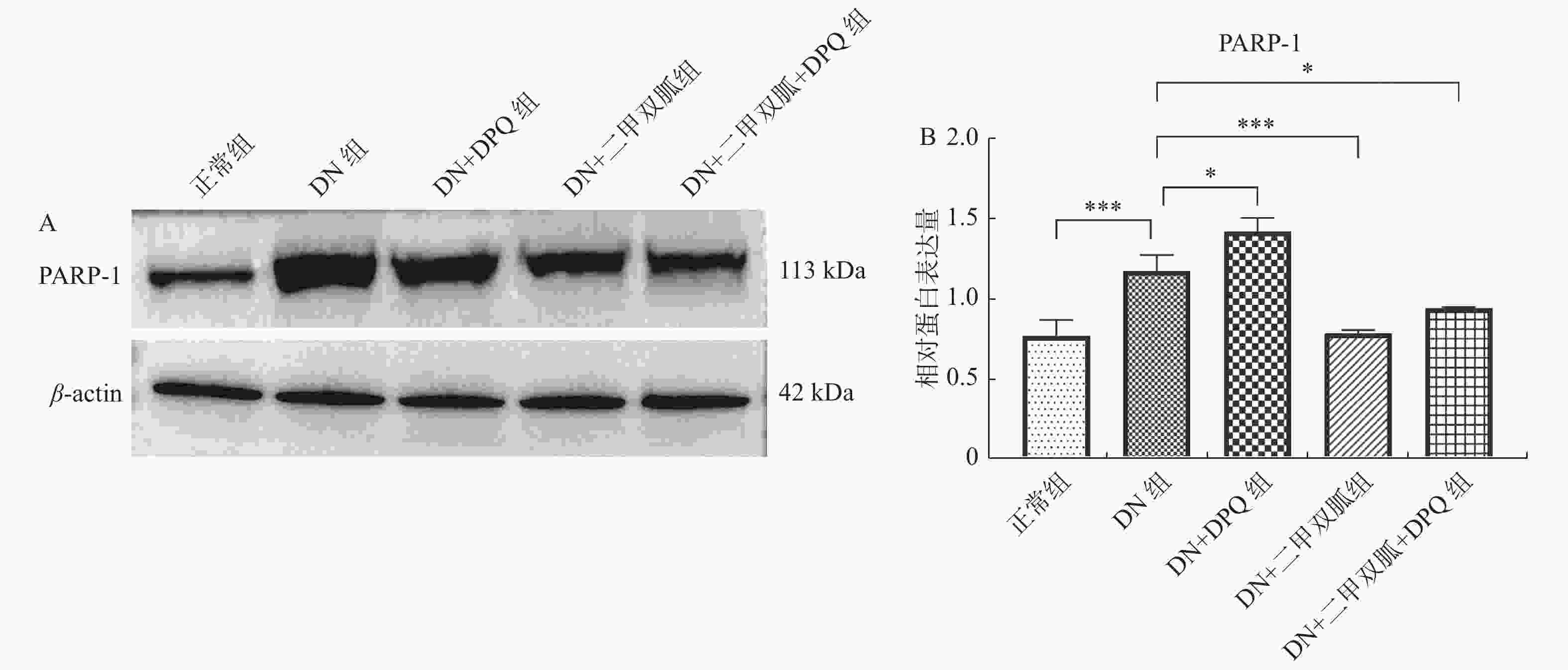
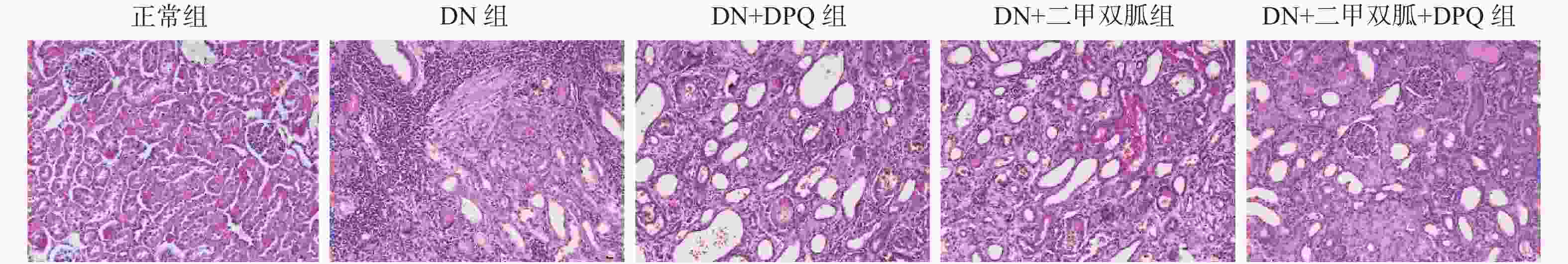
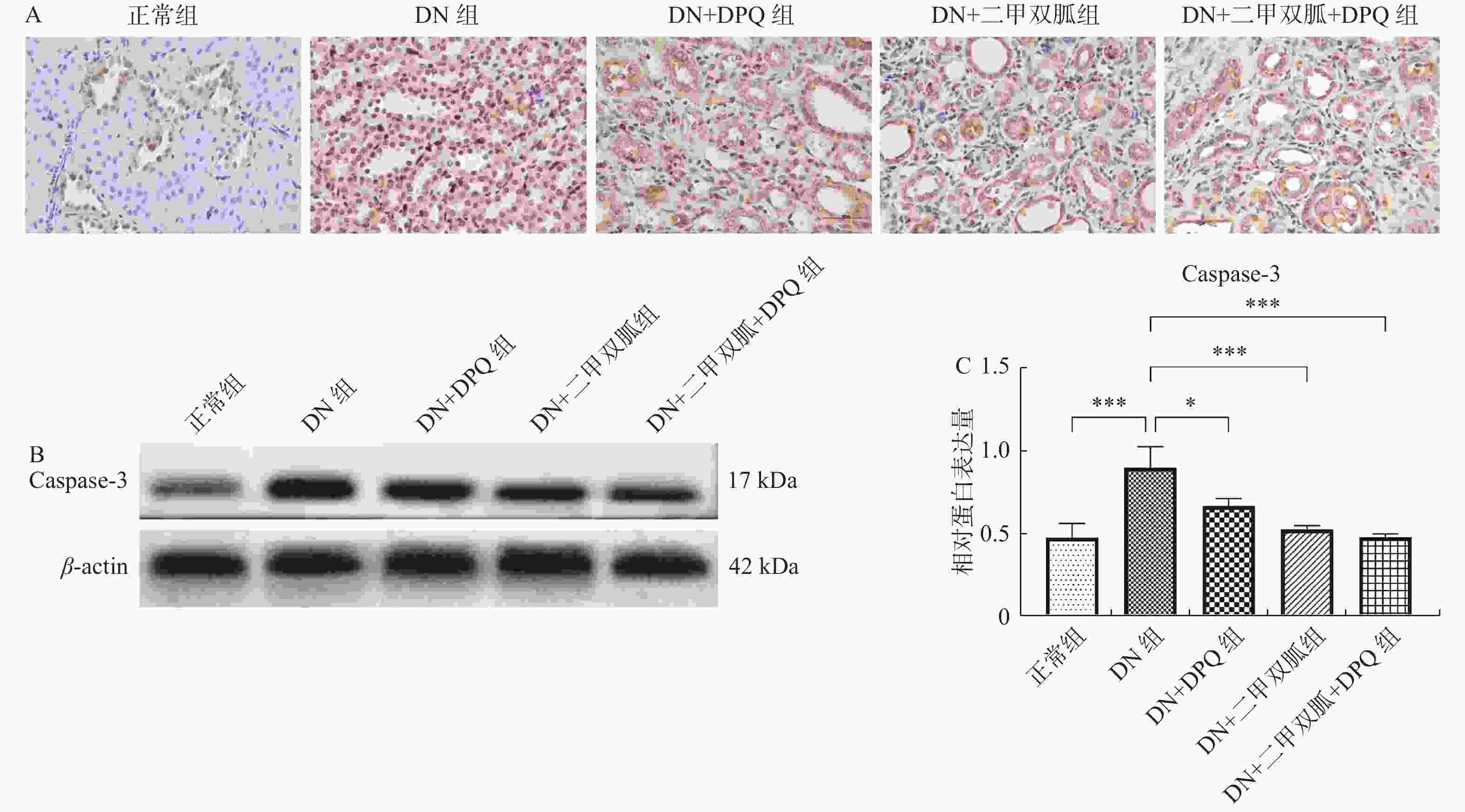
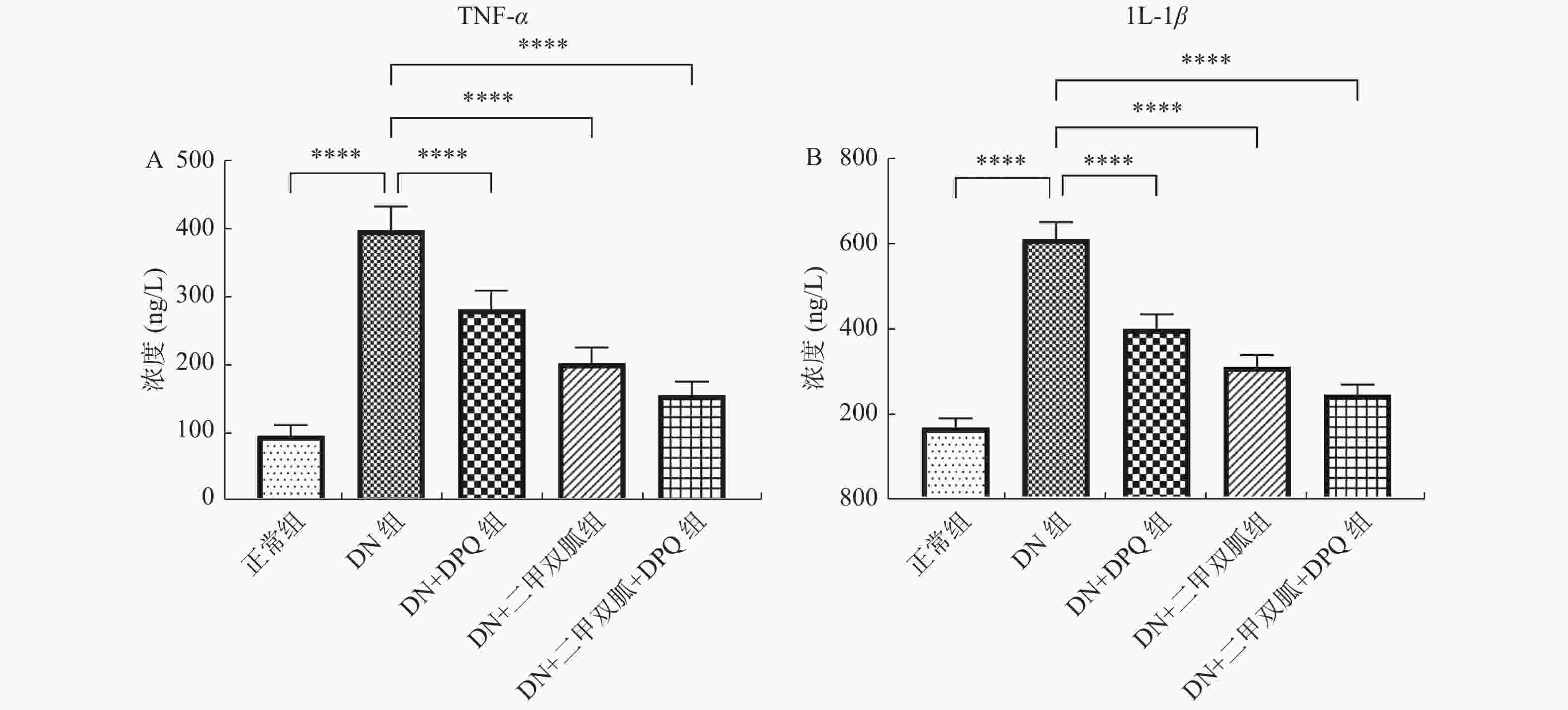
|
[1]
|
Li X,Li C,Li X,et al. Involvement of histone lysine methylation in p21 gene expression in rat kidney in vivo and rat mesangial cells in vitro under diabetic conditions[J]. J Diabetes Res,2016,2016(10):1-12.
|
|
[2]
|
林善锬. 糖尿病肾病[J]. 中华内科杂志,2005,44(3):229-231. doi: 10.3760/j.issn:0578-1426.2005.03.028
|
|
[3]
|
Rogacka D,Audzeyenka I,Rychowski M,et al. Metformin overcomes high glucose-induced insulin resistance of podocytes by pleiotropic effects on SIRT1 and AMPK[J]. Biochim Biophys Acta Mol Basis Dis,2017,1864(1):115-125.
|
|
[4]
|
Foretz M,Hébrard S,Leclerc J,et al. Metformin inhibits hepatic gluconeogenesis in mice independently of the LKB1/AMPK pathway via a decrease in hepatic energy state[J]. J Clin Invest,2010,120(7):2355-2369. doi: 10.1172/JCI40671
|
|
[5]
|
El-Bassossy,Hany M. PARP-1 inhibition alleviates diabetic cardiac complications in experimental animals[J]. Eur J Pharmacol,2016,791:444-454. doi: 10.1016/j.ejphar.2016.09.008
|
|
[6]
|
Guzyk M M,Tykhomyrov A A,Nedzvetsky V S,et al. Poly (ADP-Ribose) polymerase-1 (PARP-1) inhibitors reduce reactive gliosis and improve angiostatin levels in retina of diabetic rats[J]. Neurochem Res,2016,41(10):2526-2537.
|
|
[7]
|
Waldman M,Nudelman V,Shainberg A,et al. PARP-1 inhibition protects the diabetic heart through activation of SIRT1-PGC-1α axis[J]. Experimental Cell Research,2018,373(1-2):112-118. doi: 10.1016/j.yexcr.2018.10.003
|
|
[8]
|
陈小兰,颜安华,郑道国. 二甲双胍通过调控PARP-1活性对心肌梗死大鼠模型发挥保护作用[J]. 中国药师,2019,22(8):1401-1406. doi: 10.3969/j.issn.1008-049X.2019.08.006
|
|
[9]
|
Anisimov V N J A. Metformin for aging and cancer prevention[J]. Aging (Albang NY),2010,2(11):760-774.
|
|
[10]
|
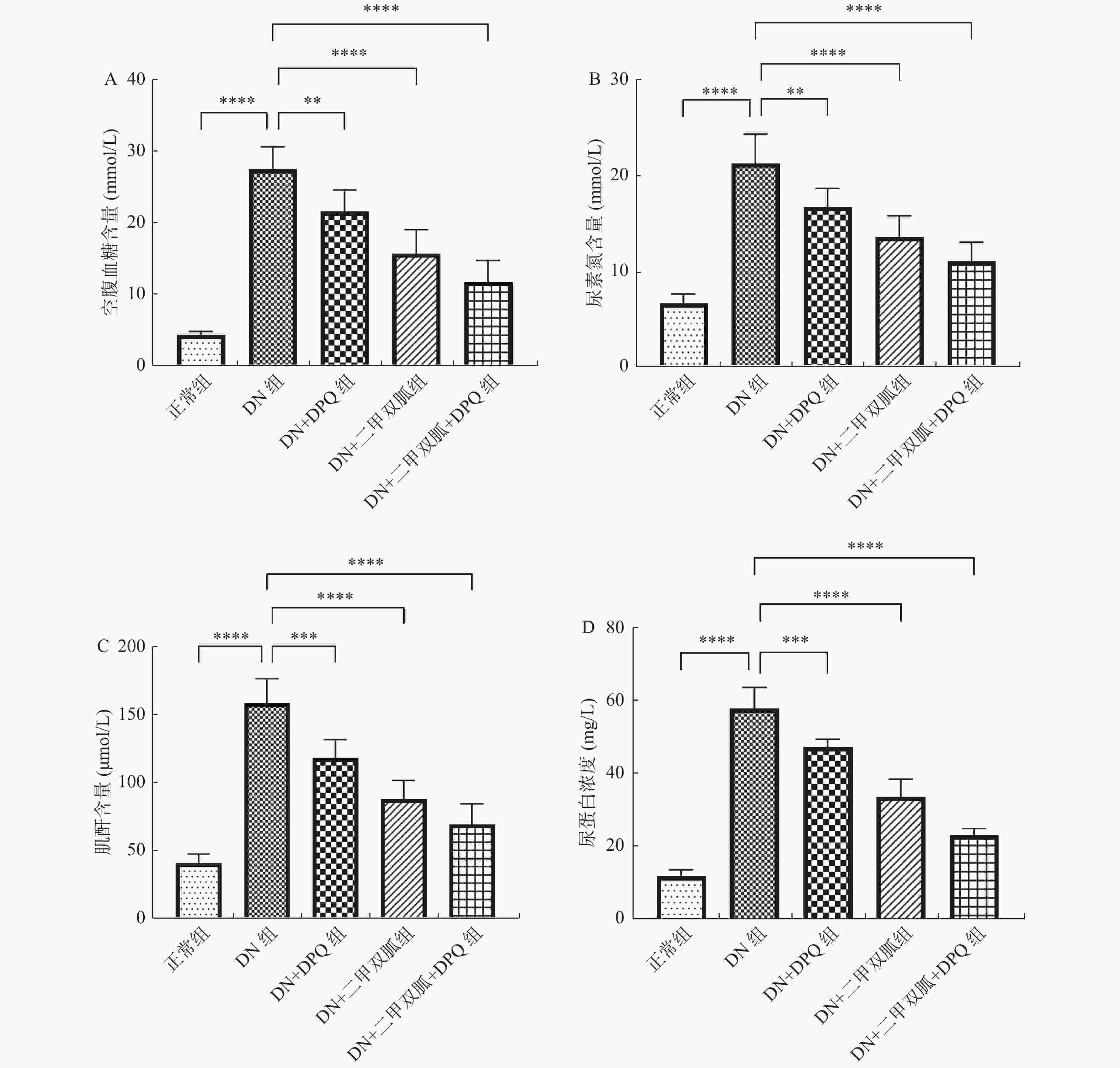
管鑫娟,姚伟峰. 糖尿病肾病[J]. 解放军医学院学报,2012,17(1):116-117.
|
|
[11]
|
杨倩,关天俊. 糖尿病肾病的诊治进展[J]. 世界临床药物,2018,39(2):93-97.
|
|
[12]
|
孙志强. 糖尿病肾病研究进展[J]. 中华实用诊断与治疗杂志,2010,24(6):539-541.
|
|
[13]
|
张舒媛,王东超,李博,等. 糖尿病肾病研究进展[J]. 世界中医药,2015(10):1621-1625. doi: 10.3969/j.issn.1673-7202.2015.10.044
|
|
[14]
|
Denhez B,Rousseau M,Spino C,et al. Saturated fatty acids induce insulin resistance in podocytes through inhibition of IRS1 via activation of both IKKβ and mTORC1[J]. Sci Rep,2020,10(1):21628. doi: 10.1038/s41598-020-78376-1
|
|
[15]
|
Su Y,Chen Q,Ju Y,et al. Palmitate induces human glomerular mesangial cells fibrosis through CD36-mediated transient receptor potential canonical channel 6/nuclear factor of activated T cell 2 activation[J]. Biochim Biophys Acta Mol Cell Biol Lipids,2020,1865(12):158793. doi: 10.1016/j.bbalip.2020.158793
|
|
[16]
|
Xu Y,Gao H,Hu Y,et al. High glucose-induced apoptosis and necroptosis in podocytes is regulated by UCHL1 via RIPK1/RIPK3 pathway[J]. Exp Cell Res,2019,382(2):111463. doi: 10.1016/j.yexcr.2019.06.008
|
|
[17]
|
Alicic R Z, Rooney M T, Tuttle K R. Diabetic kidney disease: Challenges, progress, and possibilities[J]. Clin J Am Soc Nephrol,2017,12(12):2032-2045. doi: 10.2215/CJN.11491116
|
|
[18]
|
Lee M J,Feliers D,Mariappan M M,et al. A role for AMP-activated protein kinase in diabetes-induced renal hypertrophy[J]. Am J Physiol Renal Physiol,2007,292(2):F617.
|
|
[19]
|
Satriano J,Mansoury H,Deng A,et al. Transition of kidney tubule cells to a senescent phenotype in early experimental diabetes[J]. Am J Physiol Cell Physiol,2010,299(2):C374.
|
|
[20]
|
Shang F,Zhang J,Li Z,et al. Cardiovascular Protective Effect of Metformin and Telmisartan:Reduction of PARP1 Activity via the AMPK-PARP1 Cascade[J]. PLos One,2016,11(3):e0151845.
|
|
[21]
|
耿彦平 王,谷剑. 二甲双胍对急性心肌梗死后心肌梗死面积及心功能的影响[J]. 临床荟萃,2016,31(7):805-808.
|
|
[22]
|
林芳芳 张,牛姗姗. 二甲双胍预防糖尿病合并心肌梗死患者再梗死的效果观察[J]. 实用糖尿病杂志,2018,14(3):39.
|
|
[23]
|
赵丽,梁晓春. 多聚(ADP-核糖)聚合酶与糖尿病周围神经病变[J]. 医学研究杂志,2011,40(8):23-25. doi: 10.3969/j.issn.1673-548X.2011.08.008
|
|
[24]
|
凌亦凌 朱 赵. 多聚(ADP-核糖)聚合酶与细胞损伤[J]. 中国病理生理杂志,2002,18(1):104-107. doi: 10.3321/j.issn:1000-4718.2002.01.033
|
|
[25]
|
Pacher P,Szabo C. Role of the Peroxynitrite-Poly(ADP-Ribose)Polymerase Pathway in Human Disease[J]. Am J Palhol,2008,173(1):2-13.
|
|
[26]
|
Liang E S,Bai W W,Wang H,et al. PARP-1(Poly[ADP-Ribose] Polymerase 1)Inhibition Protects From Ang Ⅱ(Angiotensin Ⅱ)-Induced Abdominal Aortic Aneurysm in Mice[J]. Hypertension,2018,72(5):1189-1199. doi: 10.1161/HYPERTENSIONAHA.118.11184
|
|
[27]
|
Chen H,Liu J,Wang B,et al. Protective effect of lncRNA CRNDE on myocardial cell apoptosis in heart failure by regulating HMGB1 cytoplasm translocation through PARP-1[J]. Arch Pharm Res,2020,43(12):1325-1334. doi: 10.1007/s12272-020-01290-7
|
|
[28]
|
Luo H,Liang H,Chen Y,et al. miR-7-5p overexpression suppresses cell proliferation and promotes apoptosis through inhibiting the ability of DNA damage repair of PARP-1 and BRCA1 in TK6 cells exposed to hydroquinone[J]. Chem Biol Interact,2018,283:84-90. doi: 10.1016/j.cbi.2018.01.019
|
|
[29]
|
Nan L,Xie Q,Chen Z,et al. Involvement of PARP-1/AIF Signaling Pathway in Protective Effects of Gualou Guizhi Decoction Against Ischemia-Reperfusion Injury-Induced Apoptosis[J]. Neurochem Res,2020,45(2):278-294. doi: 10.1007/s11064-019-02912-3
|
|
[30]
|
Chowdhury P,Dey P,Ghosh S,et al. Reduction of metastatic potential by inhibiting EGFR/Akt/p38/ERK signaling pathway and epithelial-mesenchymal transition after carbon ion exposure is potentiated by PARP-1 inhibition in non-small-cell lung cancer[J]. BMC Cancer,2019,19(1):829. doi: 10.1186/s12885-019-6015-4
|
|
[31]
|
Leng Y P,Qiu N,Fang W J,et al. Involvement of Increased Endogenous Asymmetric Dimethylarginine in the Hepatic Endoplasmic Reticulum Stress of Type 2 Diabetic Rats[J]. PLoS One,2014,9(2):e97125.
|
|
[32]
|
Lhotak S,Sood S,Brimble E,et al. ER stress contributes to renal proximal tubule injury by increasing SREBP-2-mediated lipid accumulation and apoptotic cell death[J]. Am J Physiol Renal Physiol,2012,303(2):F266. doi: 10.1152/ajprenal.00482.2011
|
|
[33]
|
Lupachyk S,Watcho P,Stavniichuk R,et al. Endoplasmic Reticulum Stress Plays a Key Role in the Pathogenesis of Diabetic Peripheral Neuropathy[J]. Diabetes,2013,62(3):944-952. doi: 10.2337/db12-0716
|
|
[34]
|
Paravicini T M,Touyz R M J D C. NADPH Oxidases,Reactive Oxygen Species,and Hypertension:Clinical implications and therapeutic possibilities[J]. Diabetes Care,2008,31(Supplement 2):S170-S180.
|
|
[35]
|
李宏. PARP-1与氧化应激在糖尿病神经病变发病机制中的作用[J]. 检验医学与临床,2011,8(3):334-338.
|
|
[36]
|
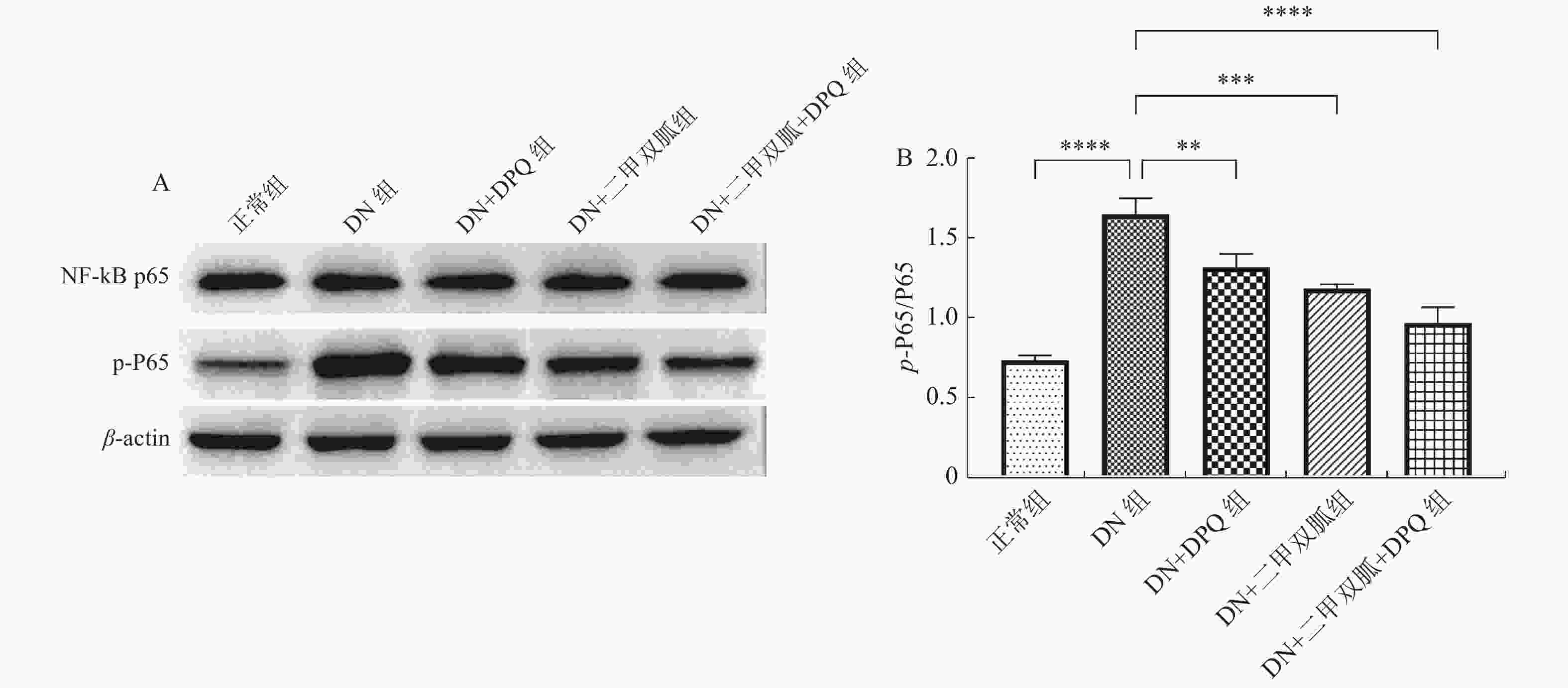
王燕萍,潘晓东,姜苏原,等. 氧化应激可通过NF-κB-iNOS-NO信号通路诱导小鼠胰岛β细胞凋亡[J]. 中国应用生理学杂志,2009,25(2):255-259.
|
|
[37]
|
陆春丽,孙明谨,褚加成,等. 利拉鲁肽通过下调iNOS改善糖尿病前期小鼠胰岛功能[J]. 湖北医药学院学报,2018,37(4):17-20+105.
|
|
[38]
|
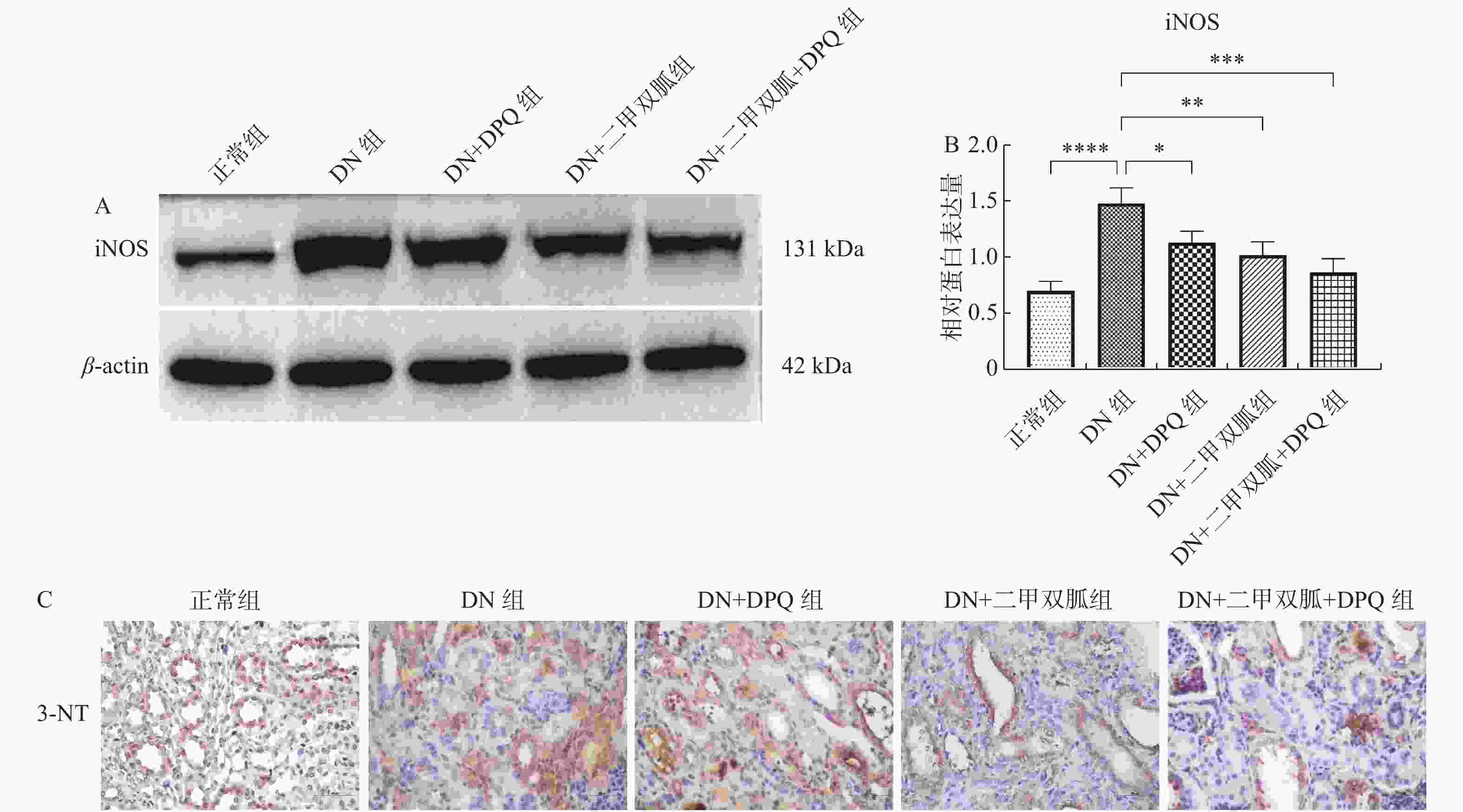
苑天彤,冯丽辉,迟继铭,等. 何首乌提取物对糖尿病肾病早期大鼠肾组织iNOS和NT表达的影响[J]. 中国中医药科技,2015,22(3):280-283.
|





 下载:
下载: