Effect of Norathyriol on the Epithelial-mesenchymal Transition of HK-2 Cells Induced by TGF-β1
-
摘要:
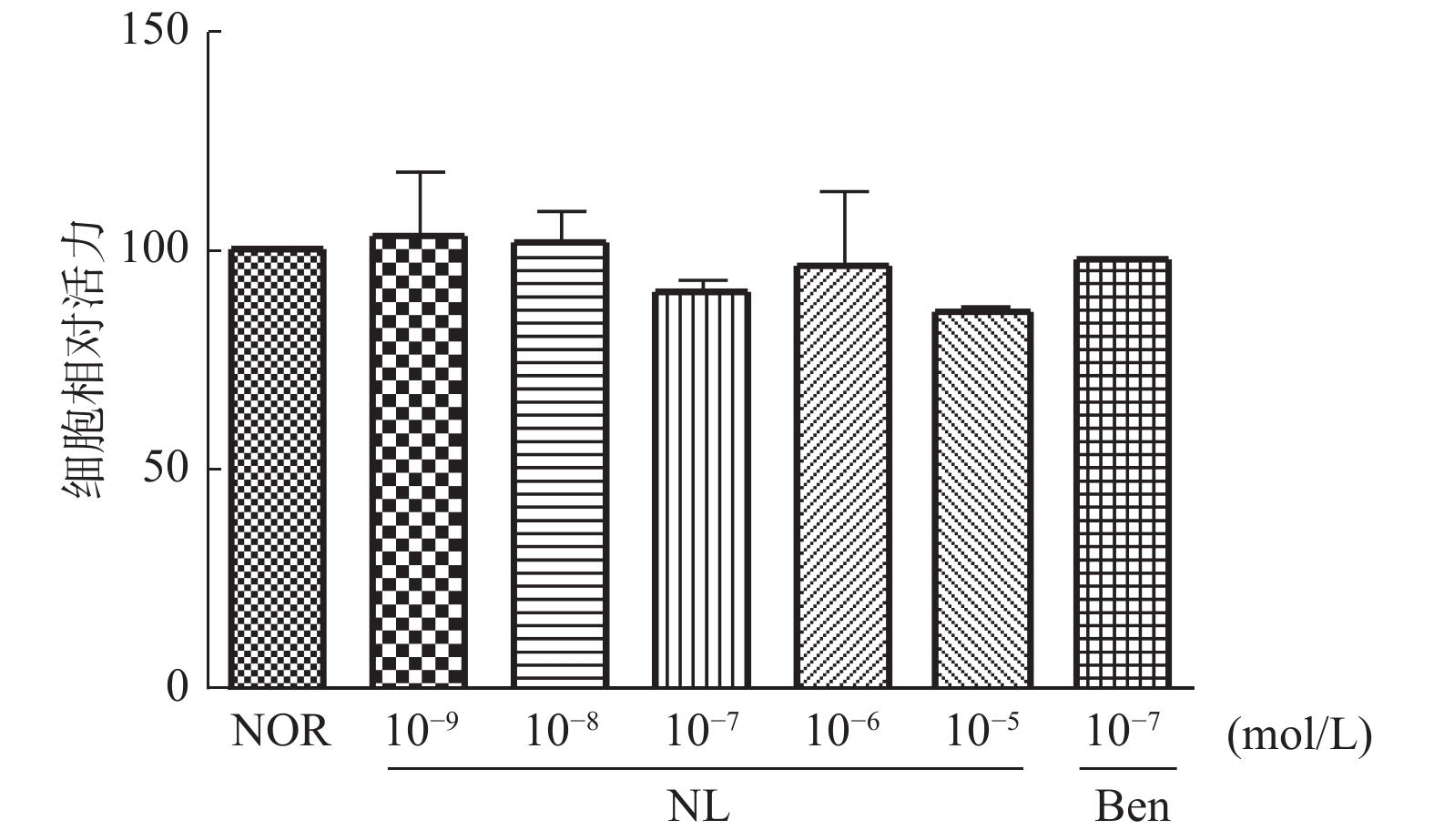
目的 研究芒果苷元对TGF-β1诱导的HK-2细胞EMT的影响。 方法 MTT法检测各浓度芒果苷元对HK-2细胞活力的影响;用TGF-β1诱导HK-2细胞成EMT模型,并给以芒果苷元干预,在TGF-β1诱导24 h时显微镜下拍照记录细胞形态变化,划痕实验法检测细胞迁移能力,Transwell法检测细胞侵袭能力,Western blot法检测纤连蛋白(fibronectin,FN)和Ⅰ型胶原(collagen type Ⅰ,Col Ⅰ)蛋白表达水平。 结果 (1)芒果苷元(10-9~10-5 mol/L)浓度下HK-2细胞活力均无明显变化(P > 0.05);(2)与正常组相比,模型组细胞形态变长变梭,迁移和侵袭能力显著增强( P < 0.05,0.01),FN和ColⅠ蛋白表达水平显著上调( P < 0.05,0.01);与模型组相比,芒果苷元组细胞能维持原来的鹅卵石形,迁移和侵袭能力显著下降( P < 0.05,0.01),FN和ColⅠ蛋白表达水平显著下调( P < 0.05)。 结论 芒果苷元能抑制TGF-β1诱导的HK-2细胞迁移和侵袭,阻止细胞形态的改变,下调细胞外基质成分FN和ColⅠ的蛋白表达,从而抑制EMT的发展。 Abstract:Objective To study the effects of norathyriol on epithelial-mesenchymal transition of HK-2 cells induced by TGF-β1. Methods MTT assay was used to detect the effect of norathyriol on HK-2 cell viability. The HK-2 cells were divided into normal group, model group, norathyriol (10-8, 10-7, 10-6 mol·L-1) groups and positive control (benzbromarone, 10-7 mol/L) group. The norathyriol and benzbromarone were incubated for 4 h before HK-2 cells were treated by TGF-β1 (10 ng/mL) to induce EMT. Then, the HK-2 cells were cultured for another 24 h or 48 h. Scratch assay was used to detect the migration motility of HK-2 cells. Transwell invasion assay was used to detect invasion ability of HK-2 cells. The proteins expression of fibronectin (FN) and collagen type Ⅰ (ColⅠ) were detected by western blot. Results (1) The norathyriol (10-9-10-5 mol/L)has no effects on the HK-2 cell viability, compared with the normal group (P > 0.05). (2) Compared with the normal group, the cells morphology of the model group changed from the original cobblestone shape to a long fusiform shape, the migration rate and the invasive ability of the model group was significantly increased ( P < 0.01). The protein expression of Col and FN in the model group was significantly increased. Compared with the model group, the cells morphology of norathyriol (10 -8, 10-7, 10-6 mol/L) and benzbromarone (10-7 mol/L) groups maintain thecobblestone shape partly, the migration rate (10-8, 10-7, 10-6 mol/L) and the invasive ability (10-6 mol/L) of norathyriol were significantly decreased (P < 0.01); The protein expression of Col and FN were significantly down-regulated in the norathyriol (10 -6 mol/L) group and the benzbromarone group (P < 0.05, 0.01). Conclusion Norathyriol can inhibit the migration and invasion of HK-2 cells induced by TGF-β1 and down-regulate the protein expression of fibronectin (FN) and collagen type Ⅰ (ColⅠ). -
Key words:
- Norathyriol /
- TGF-β1 /
- HK-2 cell /
- Migration /
- Invasion /
- Epithelial-mesenchymal transition (EMT)
-
-
[1] Liu B C,Tang T T,Lv L L,et al. Renal tubule injury:A driving force toward chronic kidney disease[J]. Kidney international,2018,93(3):568-579. doi: 10.1016/j.kint.2017.09.033 [2] Djudiai S,Boor P. Cellular and molecular mechanisms of kidney fibrosis[J]. Molecular Aspects of Medicine,2019,65:16-36. doi: 10.1016/j.mam.2018.06.002 [3] 石咏琪,王墨. 肾间质纤维化发生机制研究进展[J]. 现代医药卫生,2019,35(19):3002-3006. doi: 10.3969/j.issn.1009-5519.2019.19.020 [4] Cruz-Solbes A S,Youker K. Epithelial to mesenchymal transition (EMT) and endothelial to mesenchymal transition (EndMT):role and implications in kidney fibrosis[J]. Results and Problems in Cell Differentiation,2017,60:345-372. [5] Iwano M,Plieth D,Danoff T M,et al. Evidence that fibroblasts derive from epithelium during tissue fibrosis[J]. The Journal of Clinical Investigation,2002,110(3):341-350. doi: 10.1172/JCI0215518 [6] 遆安航,陈瑾,翟康欣,等. 连翘归尾煎对人乳腺癌MCF-7细胞增殖、迁移、凋亡和周期的影响[J]. 山西医科大学学报,2021,52(5):565-571. [7] Saral L,Michael Z,Raghu K. Partial epithelial-to-mesenchymal transition and other new mechanisms of kidney fibrosis[J]. Trends in Endocrinology and Metabolism,2016,27(10):681-695. doi: 10.1016/j.tem.2016.06.004 [8] Meng X M,Nikolic-paterson D J,Lan H Y. TGF-β:the master regulator of fibrosis[J]. Nature Reviews. Nephrology,2016,12(6):325-338. doi: 10.1038/nrneph.2016.48 [9] Xu C G,Zhu X L,Wang W,et al. Ursolic acid inhibits epithelial-mesenchymal transition in vitro and in vivo[J]. Pharmaceutical Biology,2019,57(1):169-175. doi: 10.1080/13880209.2019.1577464 [10] Fan Y,Wang X,Li Y,et al. PAK4 enhances TGF-β1-induced epithelial- mesenchymal transition through activating β-catenin signaling pathway in renal tubular epithelial cells[J]. International Journal of Clinical and Experimental pathology,2018,11(6):3026-3035. [11] Song Y,Lv S S,Wang F,et al. Overexpression of BMP-7 reverses TGF-β1-induced epithelial-mesenchymal transition by attenuating the Wnt3/β-catenin and /Smad2/3 signaling pathways in HK-2 cells[J]. Molecular Medicine Reports,2019,21(2):833-841. [12] 周栋,傅海燕. 细胞外基质的产生、重塑与肾脏纤维化[J]. 江苏医药,2015,41(8):936-938. [13] 李淑菊,詹晓丹,田锋,等. 参地补肾胶囊含药血清对高糖诱导转分HK-2细胞ZO-1、α-SMA表达的影响[J]. 中国中医药科技,2018,25(6):797-800. [14] Louis K,Hertig A. How tubular epithelial cells dictate the rate of renal fibrogenesis?[J]. World Journal of Nephrology,2015,4(3):367-373. doi: 10.5527/wjn.v4.i3.367 -






 下载:
下载: