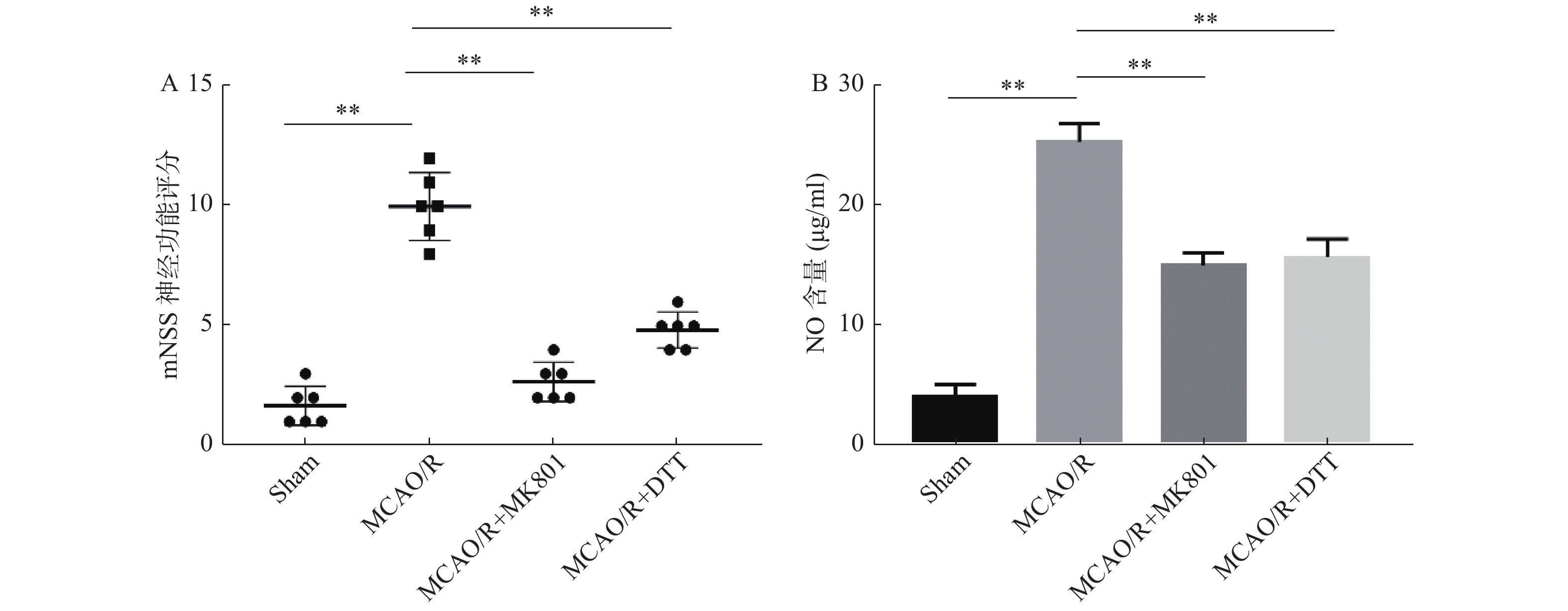
|
[1]
|
Nentwhich L M. Diagnosis of Acute Ischemic Stoke[J]. Emergency medicine clinics of North America,2016,34(4):837-859. doi: 10.1016/j.emc.2016.06.008
|
|
[2]
|
Nie J,Yang X. Modulation of synaptic plasticity by exercise training as a basis for ischemic stroke rehabilitation[J]. Cellular and molecular neurobiology,2017,37(1):5-16. doi: 10.1007/s10571-016-0348-1
|
|
[3]
|
Zhang P,Yu P C,Tsang A H,et al. S-nitrosylation of cyclin-dependent kinase 5 (cdk5) regulates its kinase activity and dendrite growth during neuronal development[J]. The Journal of Neuroscience:The Official Journal of The Society for Neuroscience,2010,30(43):14366-14370. doi: 10.1523/JNEUROSCI.3899-10.2010
|
|
[4]
|
Chen J, Hu R, Liao H, et al. A non-ionotropic activity of NMDA receptors contributes to glycine-induced neuroprotection in cerebral ischemia-reperfusion injury[J]. Sci Rep. 2017 7(1): 3575.
|
|
[5]
|
Martínez Ruiz A,Cadenas S,Lamas S. Nitric oxide signaling:Classical,less classical,and nonclassical mechanisms[J]. Free Radical Biology & Medicine,2011,51(1):17-29.
|
|
[6]
|
Selvakumar B,Huganir R L,Snyder S H. S-nitrosylation of stargazin regulates surface expression of AMPA-glutamate neurotransmitter receptors[J]. Proceedings of the National Academy of Sciences of the United States of America,2009,106(38):16440-16445. doi: 10.1073/pnas.0908949106
|
|
[7]
|
Selvakumar B,Campbell P W,Milovanovic M,et al. AMPA receptor upregulation in the nucleus accumbens shell of cocaine-sensitized rats depends upon S-nitrosylation of stargazin[J]. Neuropharmacology,2014,77(3):28-38.
|
|
[8]
|
Bell J D,Park E,Ai J,et al. PICK1-mediated GluR2 endocytosis contributes to cellular injury after neuronal trauma[J]. Cell Death and Differentiation,2009,16(12):1665-1680. doi: 10.1038/cdd.2009.106
|
|
[9]
|
Diering G H,Huganir R L. The AMPA receptor code of synaptic plasticity[J]. Neuron,2018,100(2):314-329. doi: 10.1016/j.neuron.2018.10.018
|
|
[10]
|
覃启京,覃辉. Stargazin调节AMPA受体功能的相关研究进展[J]. 医学综述,2018,24(18):3564-3569. doi: 10.3969/j.issn.1006-2084.2018.18.006
|
|
[11]
|
Tigaret C M,Thalhammer A,Rast G F,et al. Subunit dependencies of N-methyl-D-aspartate (NMDA) receptor-induced alpha-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid (AMPA) receptor internalization[J]. Mol Pharmacol,2006,69(4):1251-1259.
|
|
[12]
|
Lin D T,Huganir R L. PICK1 and phosphorylation of the glutamate receptor 2 (GluR2) AMPA receptor subunit regulates GluR2 recycling after NMDA receptor-induced internalization[J]. J NEUROSCI,2007,27(50):13903-13908. doi: 10.1523/JNEUROSCI.1750-07.2007
|
|
[13]
|
Sun W, Li X, Tang D, et al. Subacute melamine exposure disrupts task-based hippocampal information flow via inhibiting the subunits 2 and 3 of AMPA glutamate receptors expression[J]. . Hum Exp Toxicol. 2021, 40(6): 928-939.
|
|
[14]
|
Wei Sun,Xiaoliang Li,Dongxin Tang,et al. Subacute melamine exposure disrupts task-based hippocampal information flow via inhibiting the subunits 2 and 3 of AMPA glutamate receptors expression[J]. Human Experimental Toxicology,2021,40(6):928-939. doi: 10.1177/0960327120975821
|






 下载:
下载: