The Rapid Detection of Nucleic Acid in SARS-CoV-2 by Reverse Transcription Loop Mediated Isothermal Amplification
-
摘要:
目的 利用逆转录环介导恒温扩增技术建立新型冠状病毒核酸快速检测方法。 方法 针对新型冠状病毒的特征核壳蛋白N基因和开放阅读框1ab(ORF1ab)基因序列保守区设计引物,获得了 RT-LAMP 检测体系,并评价该体系的特异性、最低检测限、抗干扰能力和最佳反应时间。 结果 经检测新型冠状病毒核酸标准物质,其结果与预期相符,证实了该检测体系的可行性。 结论 利用逆转录环介导恒温扩增技术快速检测新型冠状病毒核酸的反应体系特异性好、灵敏度高,适用于边境条件有限地区。 -
关键词:
- 新型冠状病毒 /
- 核酸检测 /
- 逆转录环介导恒温扩增技术
Abstract:Objective To establish a rapid detection method for the nucleic acid of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) based on the reverse transcription loop mediated isothermal amplification (RT-LAMP). Method The RT-LAMP primers were designed according to the conservative region of N and ORF1ab gene of SARS-CoV-2. And the specificity, the minimum detection limit, the anti-interference ability and the best reaction time of the system were evaluated. Result Artificial synthesized SARS-CoV-2 nucleic acid samples were tested, and the results were consistent with the expected results.It confirmed the feasibility of the detection system. Conclusion The reaction system using RT-LAMP for the rapid detection of SARS-CoV-2 nucleic acid has the high specificity and sensitivity, and is suitable for the border areas with limited conditions. -
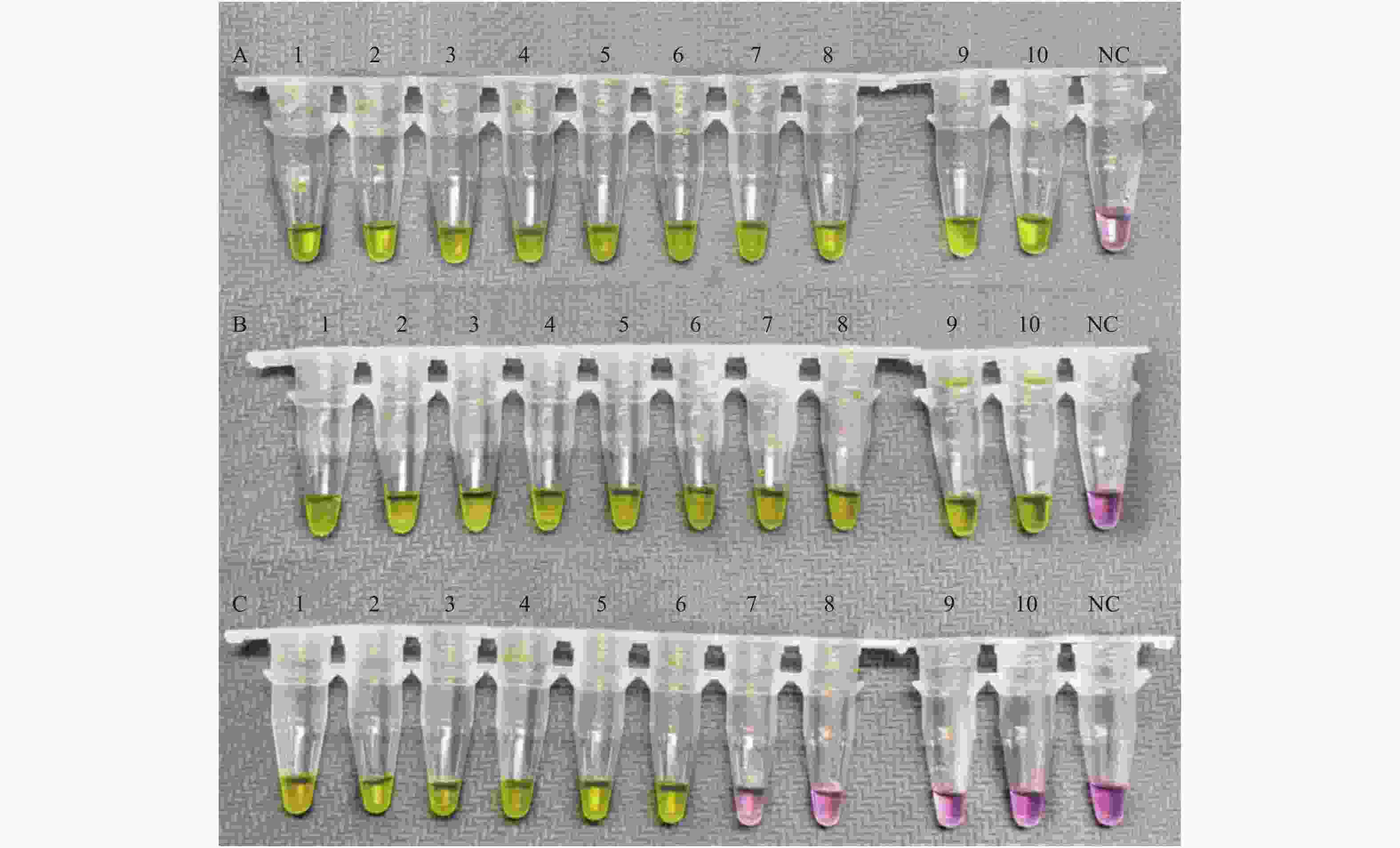
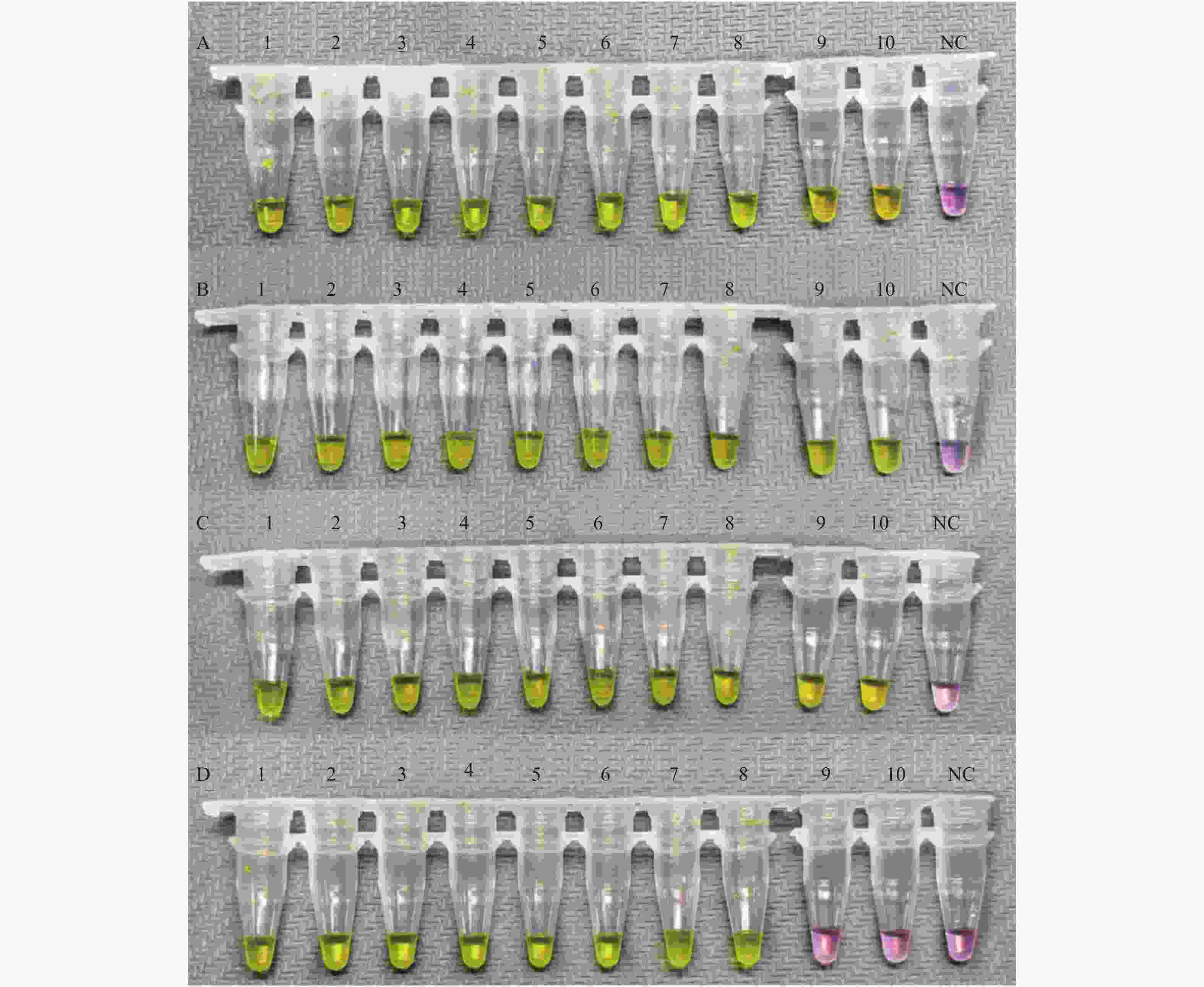
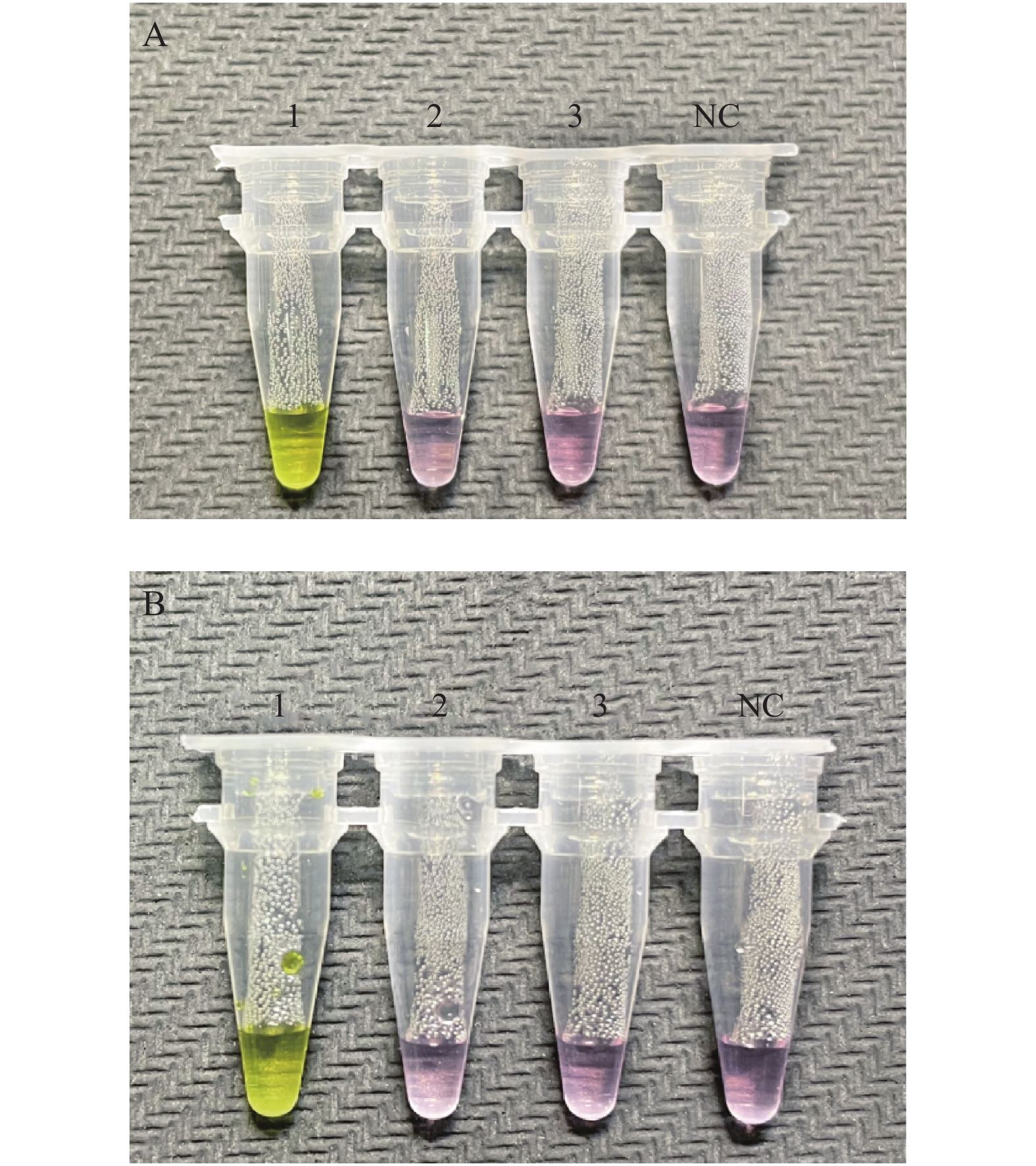
图 3 N基因的最低检测限评价
以N基因引物组为引物,加入不同浓度的新型冠状病毒标准物质为模板,进行RT-LAMP扩增的结果。A:1-10:10个复孔,加入的新型冠状病毒标准物质浓度均为1.73×103 copies/uL;B:1-10:10个复孔,加入的新型冠状病毒标准物质浓度均为0.87×103 copies/uL;C:1-10:10个复孔,加入的新型冠状病毒标准物质浓度均为0.50×103 copies/uL;D:1-10:10个复孔,加入的新型冠状病毒标准物质浓度均为0.40×103 copies/uL;NC为阴性对照。
Figure 3. Evaluation of limit of detection of N gene set
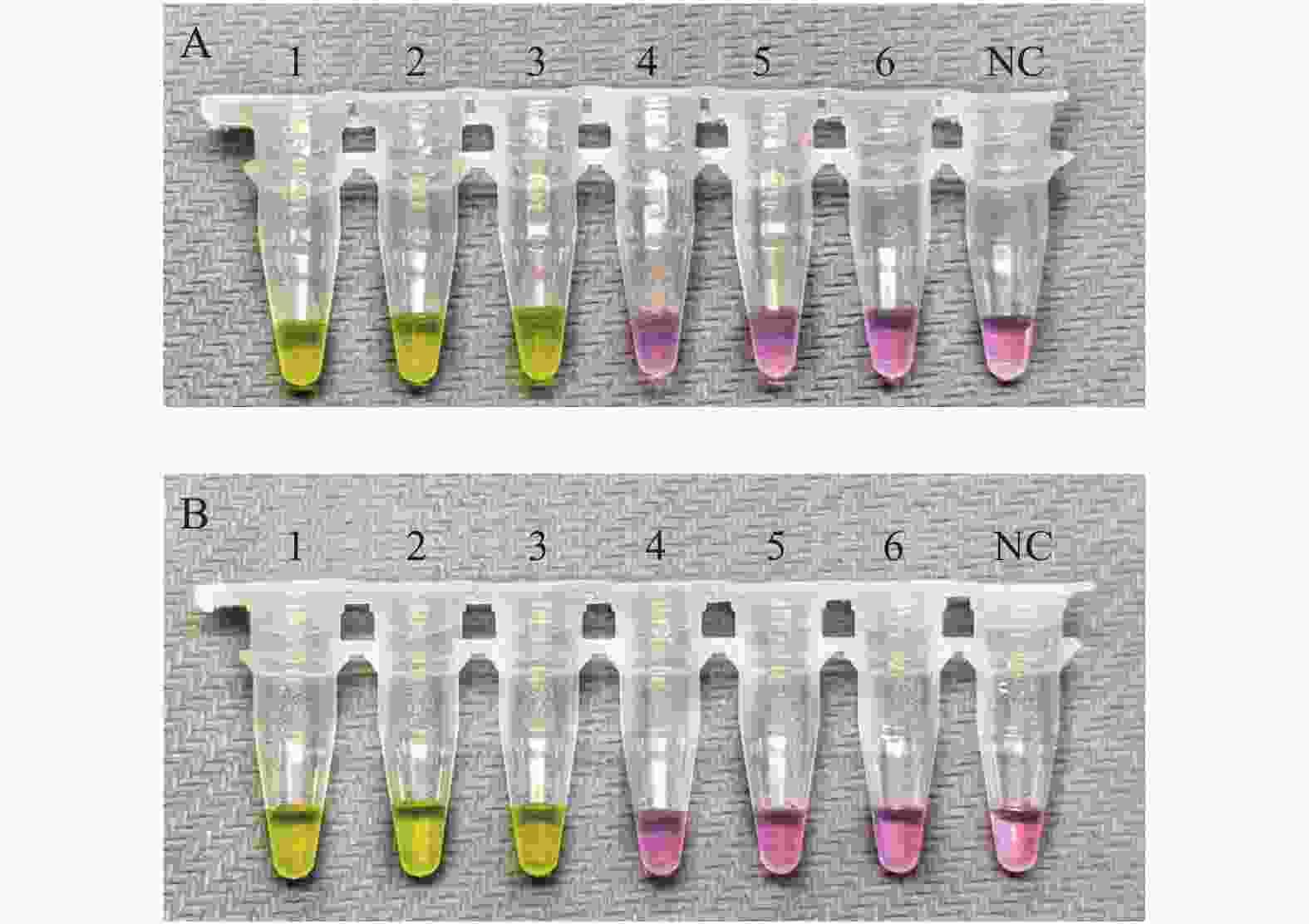
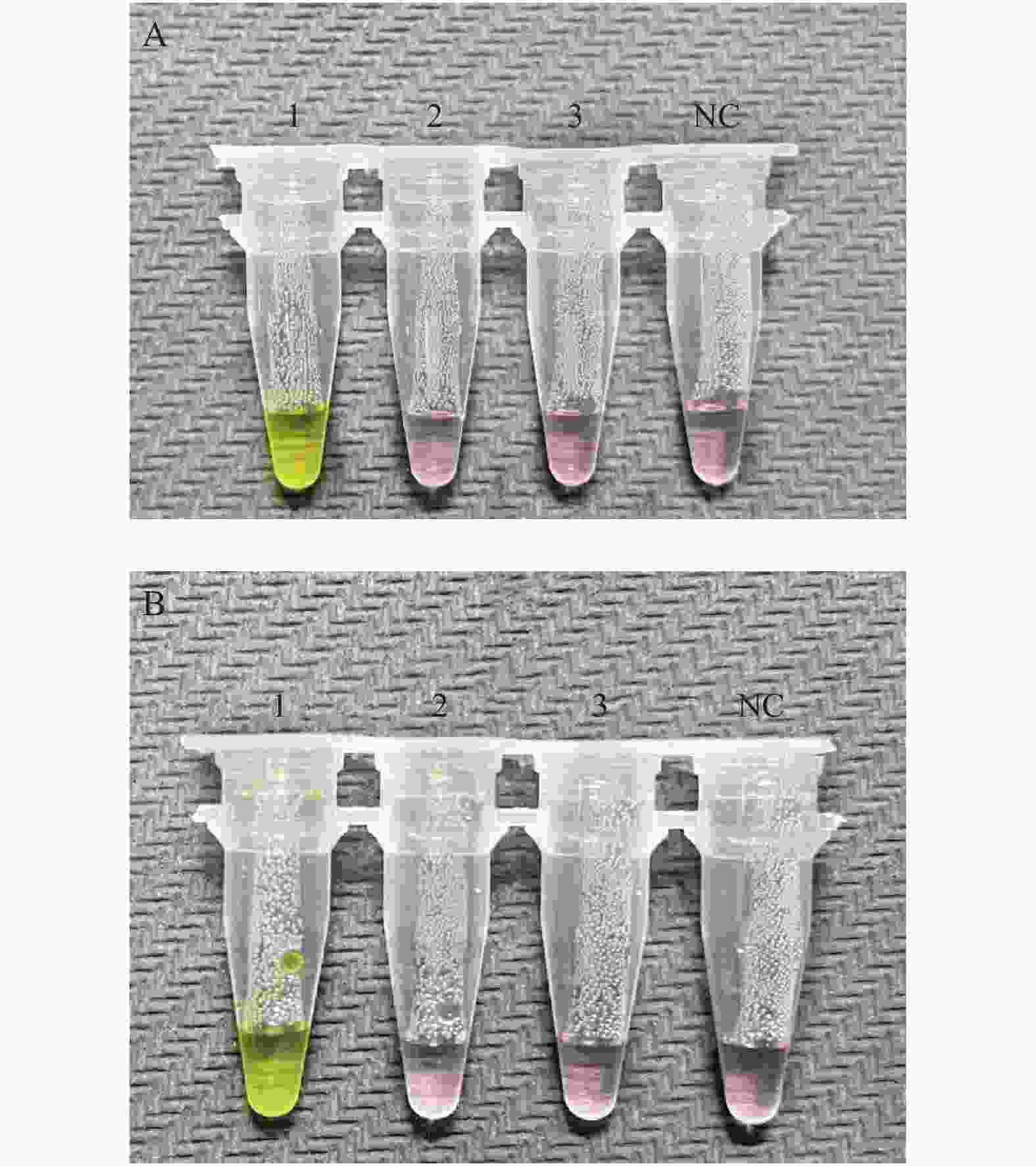
图 4 抗干扰能力评价
A:ORF1ab基因引物组的抗干扰能力评价;B:N基因引物组的抗干扰能力评价。图A以ORF1ab基因引物组为引物,在阳性、阴性模板中加入不同的干扰物质,进行RT-LAMP扩增的结果;图B以N基因引物组为引物,在阳性、阴性模板中加入不同的干扰物质,进行RT-LAMP扩增的结果。1:以新型冠状病毒标准物质和新鲜血液的混合物为模板; 2:以新型冠状病毒标准物质和鼻分泌物的混合物为模板; 3:以新型冠状病毒标准物质和样本保存液的混合物为模板; 4:以灭菌注射用水和新鲜血液的混合物为模板; 5:以灭菌注射用水和鼻分泌物的混合物为模板; 6:以灭菌注射用水和样本保存液的混合物为模板; NC为阴性对照。
Figure 4. Evaluation of anti-interference ability
表 1 RT-LAMP引物序列
Table 1. Primer sequences for RT-LAMP
基因名称 Primer名称 序列(5′-3′) F3 caaacgtaacaccaaccgc B3 ggcgagccttggggata ORF1ab FIP cggcaacaggtaaactccaccacgcccacaggacgtcaag BIP taagtgtgcgcgcgactatgtcgccttccacgagg LF ggaagacttccgagcggt F3 tgcggaaccggtgagt B3 cacggtctacgagacctcc N FIP ggccgggcatagagtgggtcaccggaattgccgggaag BIP ccgcaagactgctagccgagcrccctatcaggcagtacca LB tagcgttgggttgcgaaag 表 2 RT-LAMP反应结果的判读
Table 2. Strategies for judging RT-LAMP results of SARS-COV-2
试验结果 结果判断 ORF1ab基因、N基因均(+) SARS-CoV-2阳性 ORF1ab基因、N基因均(−) SARS-CoV-2阴性 仅有ORF1ab基因(+) 重复检测,若仍为(+),则判为SARS-CoV-2阳性。 仅有N基因(+) 重复检测,若ORF1ab基因、N基因均(+),则判为SARS-CoV-2阳性。 -
[1] Zhou P,Yang X L,Wang X G,et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J]. Nature,2020,579(7798):270-273. doi: 10.1038/s41586-020-2012-7 [2] Gorbalenya A E,Baker S C,Baric R S,et al. The species severe acute respiratory syndrome-related coronavirus:classifying 2019-nCoV and naming it SARS-CoV-2[J]. Nature Microbiology,2020,5(5):536-544. [3] Corman V M,Landt O,Kaiser M,Molenkamp R,et al. Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR[J]. Euro Surveill,2020,25(3):2000045. [4] Wang Y,Kang H,Liu X,et al. Combination of RT-qPCR testing and clinical features for diagnosis of COVID-19 facilitates management of SARS-CoV-2 Outbreak[J]. J Med Virol,2020,92(6):538-539. doi: 10.1002/jmv.25721 [5] Craw P,Balachandran W. Isothermal nucleic acid amplification technologies for point-of-care diagnostics:A critical review[J]. Lab Chip,2012,12(14):2469-2486. doi: 10.1039/c2lc40100b [6] Asiello P J,Baeumner A J. Miniaturized isothermal nucleic acid amplification,a review[J]. Lab Chip,2011,11(8):1420-1430. doi: 10.1039/c0lc00666a [7] 匡慧慧,于梅,于帅,等. 新型冠状病毒实验室核酸检测方法及实践[J]. 中华医院感染学杂志,2020,30(6):830-833. [8] To K K,Tsang O T,Yip C C,et al. Consistent detection of 2019 novel coronavirus in saliva[J]. Clin Infect Dis,2020,71(15):841-843. doi: 10.1093/cid/ciaa149 [9] Tomita N,Mori Y,Kanda H,et al. Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products[J]. Nat Protoc,2008,3(5):877-882. doi: 10.1038/nprot.2008.57 [10] Notomi T,Mori Y,Tomita N,et al. Loop-mediated isothermal amplification (LAMP):principle,features,and future prospects[J]. Journal of Microbiology,2015,53(1):1-5. doi: 10.1007/s12275-015-4656-9 [11] 匡燕云,李思光,罗玉萍. 环介导等温扩增核酸技术及其应用[J]. 微生物学通报,2007,34(3):557-560. doi: 10.3969/j.issn.0253-2654.2007.03.039 [12] 肖斌,朱永红,邹全明. 简便敏感的环介导等温扩增基因诊断新技术[J]. 中华检验医学杂志,2005,28(7):761-763. doi: 10.3760/j:issn:1009-9158.2005.07.034 [13] Wang H,Li X,Li T,et al. The genetic sequence,origin,and diagnosis of SARS-CoV-2[J]. European Journal of Clinical Microbiology & Infectious Diseases,2020,39(9):1629-1635. [14] Hongwarittorrn I,Chaichanawongsaroj N,Laiwattanapaisal W. Semi-quantitative visual detection of loop mediated isothermal amplification (LAMP)-generated DNA by distance-based measurement on a paper device[J]. Talanta,2017,175(12):135-142. -





 下载:
下载: