The Expression of C/EBPδ in Colorectal Cancer and Its Effect on the Proliferation of Cancer Cells
-
摘要:
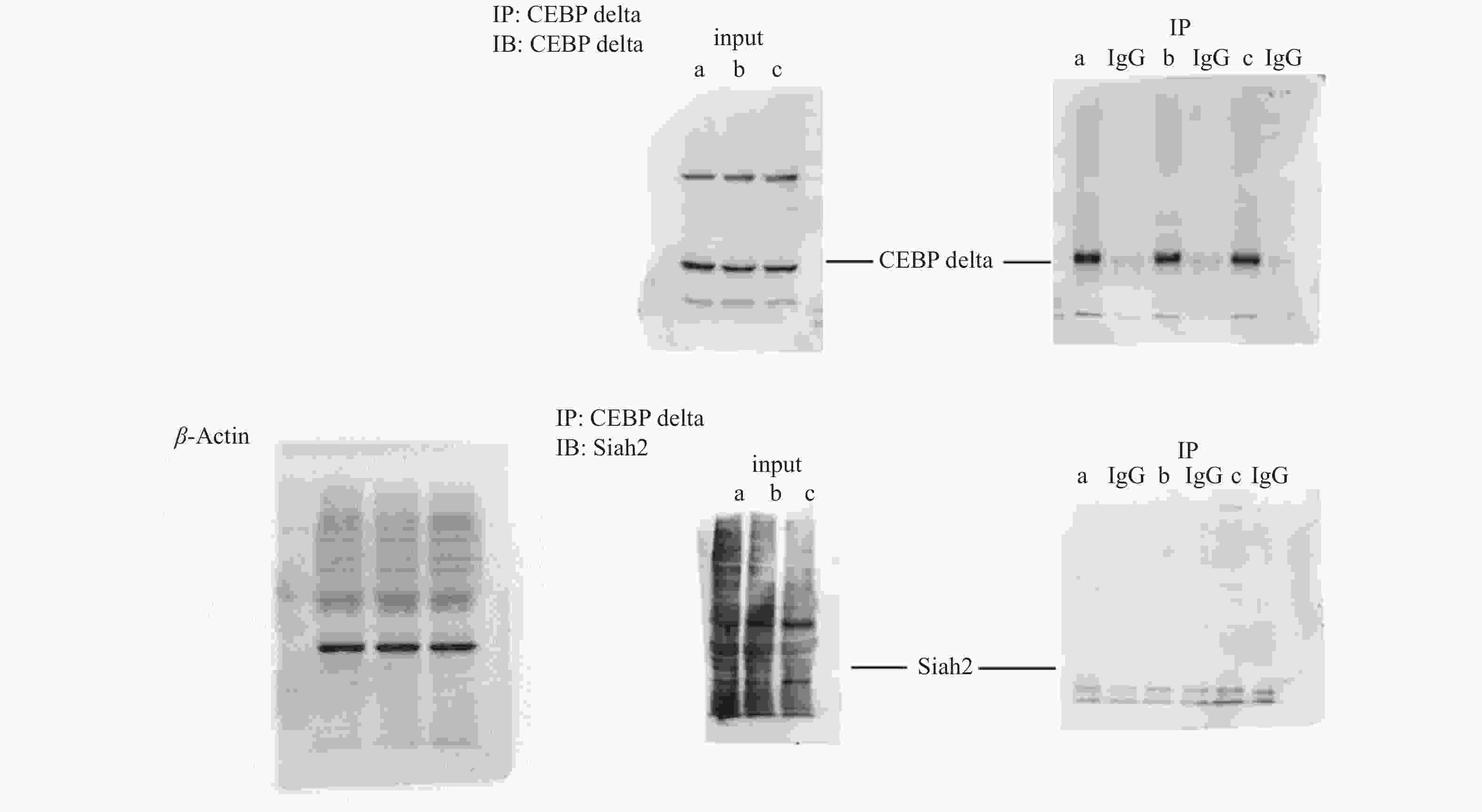
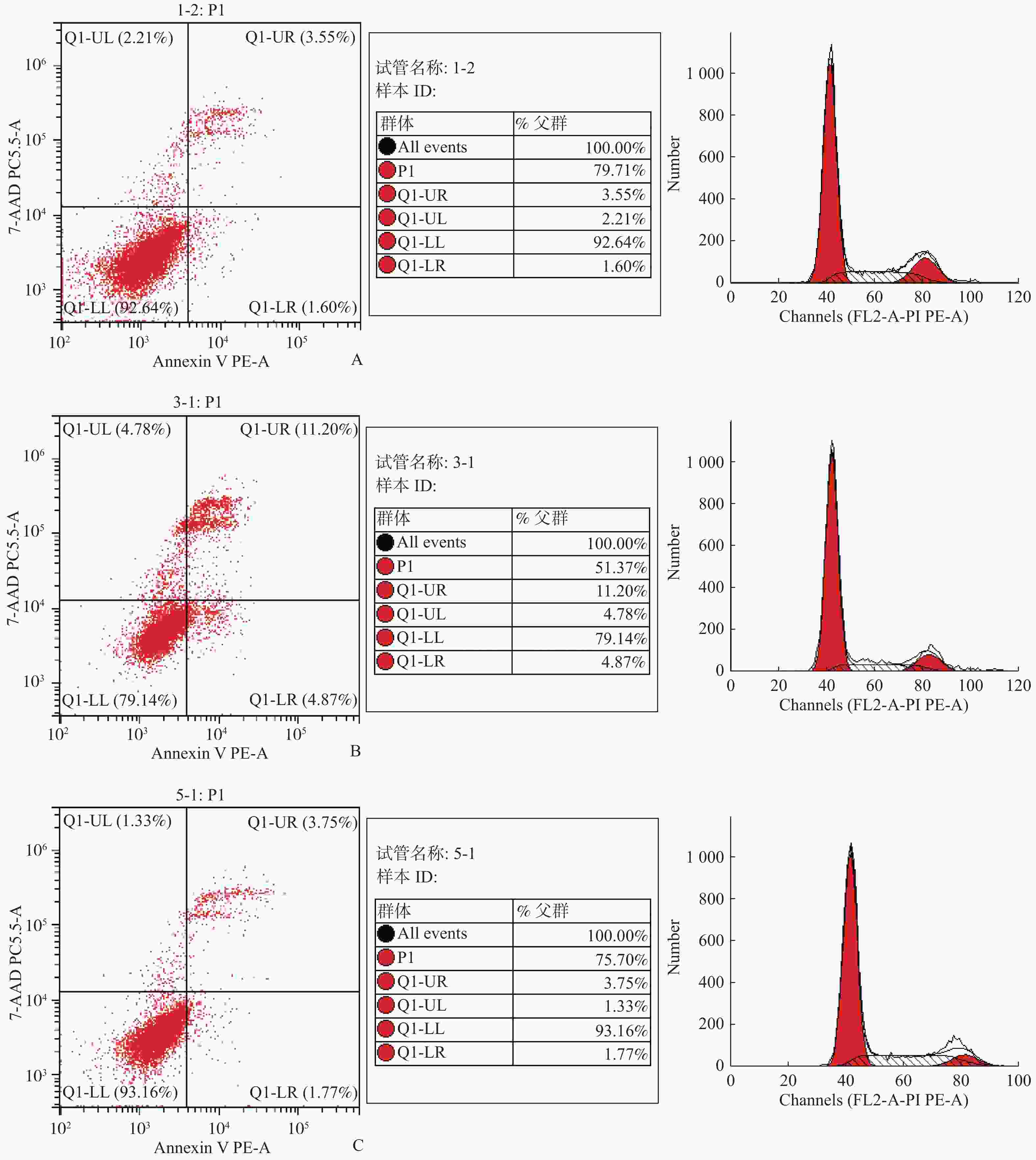
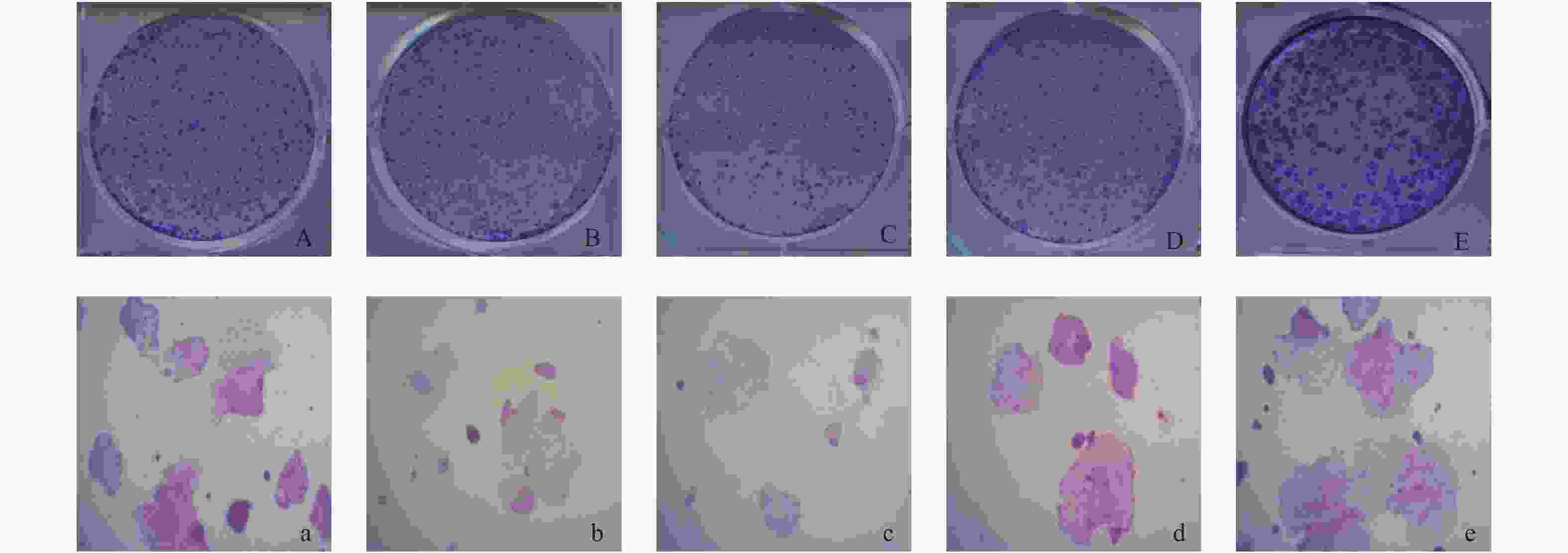
目的 研究C/EBPδ在结直肠癌中的表达情况及其对结直肠癌细胞增殖能力的影响和相关机制。 方法 选取2017年至2018年于云南省第二人民医院行结肠癌根治术的40例患者的肠癌组织以及对应的癌旁组织和正常肠组织,采用免疫组织化学法检测组织中的C/EBPδ蛋白质表达情况。采用免疫共沉淀方法检测结直肠癌组织中C/EBPδ与Siah2的相互作用。构建C/EBPδ过表达及干扰的病毒载体,分别感染结直肠癌Caco-2细胞,通过CCK8、流式细胞仪检测、平板克隆形成实验观察C/EBPδ过表达和干扰对细胞增殖、凋亡及周期的影响。采用卡方检验对阳性表达率相关因素进行统计学分析。 结果 (1)从正常肠组织到癌旁组织再到结直肠癌组织中C/EBPδ的表达依次升高,差异均有统计学意义(P < 0.05),C/EBPδ蛋白表达量在伴有肝转移的结直肠癌患者中更为显著;(2)C/EBPδ升高的结直肠癌组织中伴有Saih2的升高,但二者没有直接的相互作用;(3)C/EBPδ过表达能显著提高Caco-2细胞的增殖,而C/EBPδ的shRNA干扰使结直肠癌细胞增殖明显减少;(4)与对照组相比,C/EBPδ的shRNA干扰显著抑制了结直肠癌细胞Caco-2细胞的体外迁移和侵袭能力(P < 0.05)。 结论 C/EBPδ在结直肠癌组织中存在异常,过表达的C/EBPδ通过与Saih2 相互作用促进结直肠癌细胞的侵袭和转转,其与结直肠癌的不良预后可能相关。 -
关键词:
- CCAAT增强子结合蛋白 /
- Siah2 /
- 结直肠癌 /
- 肝转移
Abstract:Objective To investigate the expression of C/EBPδ in colorectal cancer and its effect on the proliferation of colorectal cancer cells. Methods The expression of C/EBPδ protein in 40 patients undergoing the radical resection of colon cancer in the Second People’ s Hospital of Yunnan province from 2017 to 2018 was detected by immunohistochemistry. The interaction between C/EBPδ and Siah2 in colorectal cancer tissues was detected by immunoprecipitation. Viral vectors with C/EBPδ overexpression and interference were constructed to infect colorectal cancer caco-2 cells, respectively. The effects of C/EBPδ expression and interference on cell proliferation, apoptosis and cycle were observed through CCK8, flow cytometry detection and plate cloning formation experiments. Chi-square test was used to analyze the correlation factors of positive expression rate. Results Ⅰ The expression of C/EBPδ increased successively from the normal intestinal tissues to paracellular tissues and then to colorectal cancer tissues, and the differences were statistically significant (all P < 0.05). The expression of C/EBPδ protein was more significant in colorectal cancer patients with liver metastasis; Ⅱ The C/EBPδ increased colorectal cancer tissues were accompanied by the increase of Saih2, and there was an interaction between the two; Ⅲ C/EBPδ overexpression significantly increased the proliferation of caco-2 cells, while the shRNA interference of C/EBP significantly reduced the proliferation of colorectal cancer cells; Ⅳ Compared with the control group, the shRNA interference of C/EBPδ significantly inhibited the in vitro migration and invasion of colorectal cancer cells caco-2. Conclusion C/EBPδ is abnormal in colorectal cancer tissues, and the overexpressed C/EBPδ promotes the invasion and rotation of colorectal cancer cells by interacting with Saih2, which may be related to the poor prognosis of colorectal cancer. -
Key words:
- CCAAT enhancer binding protein /
- Siah2 /
- Colorectal cancer /
- Liver metastasis
-
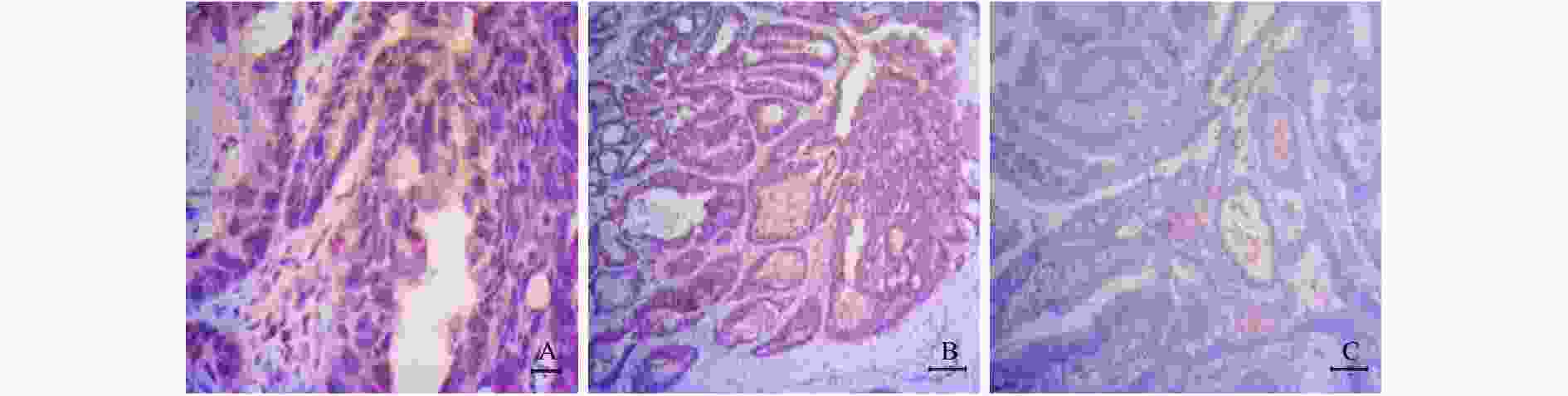
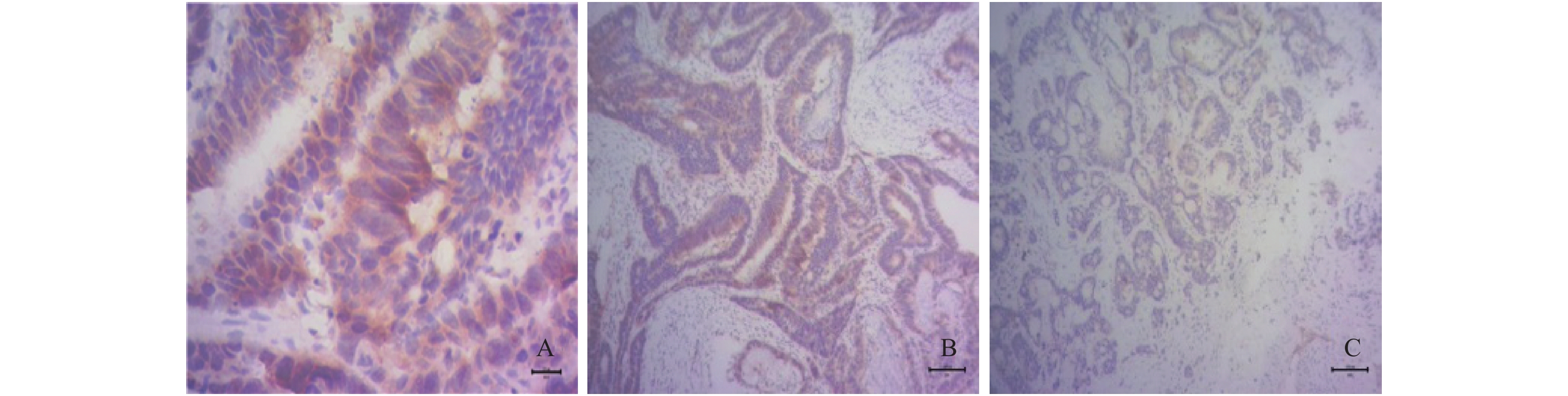
表 1 C/EBPδ与Siah2在不同组织中阳性率比较n(%)
Table 1. Comparison of positive rates of C/EBPδ and Siah2 in different tissues n(%)
组织 C/EBPδ Siah2 χ2 P 癌组织(n = 40) 33(82.5) 30(75.0) - 0.375 癌旁组织(n = 40) 17(42.5) 10(25.0) - 0.065 正常组织(n = 40) 2(5.0) 1(2.5) - 1.000 χ2 99.798 112.670 P < 0.001 < 0.001 表 2 C/EBPδ在CRC患者癌组织中的表达与临床病例特征的关系
Table 2. The relationship between the expression of C/EBPδ in CRC and the characteristics of clinical cases
临床病理参数 例数 阳性n(%) χ2 P 性别 男 19 17(89.5) 女 21 16(76.2) 0.473 0.492 年龄(岁) > 60 20 18(90.0) ≤60 20 15(75.0) 0.693 0.405 TNM分期 1期 20 13(65.0) 2~4期 20 20(100.0) 6.234 0.013 伴肝转移 是 17 17(100.0) 否 23 16(75.0) 4.341 0.037 肿块大小 ≥2 cm 18 16(88.9) < 2 cm 22 17(77.3) 0.296 0.587 表 3 CCK8检测C/EBPδ过表达和干扰对细胞增殖的影响
Table 3. CCK8 detects the effect of C/EBPδ overexpression and interference on cell proliferation
实验分组 平均OD值 绝对OD值 细胞活力(%) 空白孔 0.0416 正常对照组 1.0784 1.0368 100.00 过表达空载转染组 1.0614 1.0198 98.36 C/EBPδ干扰慢病毒转染组 0.9523 0.9107 87.84 干扰空载慢病毒转染组 1.0476 1.0060 97.03 C/EBPδ过表达病毒转染组 1.2518 1.2102 116.72 -
[1] Feng R M,Zong Y N,Cao S M,et al. Current cancer situation in China:Good or bad news from the 2018 Global Cancer Statistics?[J]. Cancer Commun (Lond),2019,39(1):22. [2] Richard J,Preen,Larry Bull,Andrew Adamatzky. Towards an evolvable cancer treatment simulator[J]. Biosystems,2019,8(182):1-7. [3] Qing-Hua Yang,Dong Chen. MiR-567 regulates proliferation and apoptosis of colorecta cancer cells by targeting TRPM8[J]. World Chinese Journal of Digestology,2019,27(14):864-871. doi: 10.11569/wcjd.v27.i14.864 [4] Li,Jing,Zhao Lian-mei,Zhang Cong. The lncRNA FEZF1-AS1 promotes the progression of colorectal cancer through regulating OTX1 and targeting miR-30a-5p[J]. Oncology Research Featuring Preclinical and Clinical Cancer Therapeutics,2020,28(1):51-63. doi: 10.3727/096504019X15619783964700 [5] Xiao-Dong Wang,Jian Lu,Yun-Shou Lin. Functional role of long non-coding RNA CASC19/miR-140-5p/CEMIP axis in colorectal cancer progression in vitro[J]. World Journal of Gastroenterology,2019,25(14):1697-1714. doi: 10.3748/wjg.v25.i14.1697 [6] Wang W,Xia X,Mao L,et al. The CCAAT/Enhancer-Binding protein family:Its roles in MDSC expansion and function[J]. Front Immunol,2019,6(31):1804. [7] Zhou X,Liu H,Zheng Y,et al. Overcoming radioresistance in tumor therapy by alleviating hypoxia and using the HIF-1 inhibitor[J]. ACS Appl Mater Interfaces,2020,12(4):4231-4240. doi: 10.1021/acsami.9b18633 [8] van Reesema L L S,Zheleva V,Winston J S,et al. SIAH and EGFR,two RAS pathway biomarkers,are highly prognostic in locally advanced and metastatic breast cancer[J]. E Bio Medicine,2016,9(11):183-198. [9] Amin M B,Greene F L,Edge S B,et al. The eighth edition AJCC cancer staging manual:Continuing to build a bridge from a population-based to a more "personalized" approach to cancer staging[J]. CA Cancer J Clin,2017,67(2):93-99. [10] Sowamber R,Chehade R,Bitar M,et al. CCAAT/enhancer binding protein delta (C/EBPδ) demonstrates a dichotomous role in tumour initiation and promotion of epithelial carcinoma[J]. EBioMedicine,2019,1(44):261-274. [11] Tapasree Roy,S. Identification of a Src tyrosine kinase/SIAH2 E3 ubiquitin ligase pathway that regulates C/EBPδ expression and contributes to transformation of breast tumor cells[J]. Molecular and Cellular Biology,2012,32(2):320-332. doi: 10.1128/MCB.05790-11 [12] JanWillem D,Lin C,Moog S,et al. CCAAT/enhancer binding protein delta (C/EBPδ) deficiency does not affect bleomycin-induced pulmonary fibrosis[J]. J Clin Transl Res,2018,3(Suppl 2):358-365. [13] Natalya N Pavlova,Craig B Thompson. The emerging hallmarks of cancer metabolism[J]. Cell Metab,2016,23(1):27-47. doi: 10.1016/j.cmet.2015.12.006 [14] Albadari N,Deng S,Li W. The transcriptional factors HIF-1 and HIF-2 and their novel inhibitors in cancer therapy[J]. Expert Opin Drug Discov,2019,14(7):667-682. doi: 10.1080/17460441.2019.1613370 [15] Kachamakova-Trojanowska N,Podkalicka P,Bogacz T,et al. HIF-1 stabilization exerts anticancer effects in breast cancer cells in vitro and in vivo[J]. Biochem Pharmacol,2020,175(20):113922. [16] Sinem Karaman,Veli-Matti Leppänen,Kari Alitalo. Vascular endothelial growth factor signaling in development and disease[J]. Development,2018,145(14):dev151019. doi: 10.1242/dev.151019 [17] Pezzuto A,Carico E. Role of HIF-1 in cancer progression:Novel insights. A review[J]. Curr Mol Med,2018,18(6):343-351. -





 下载:
下载: