Curative Effect of Combined Hemihepatectomy and Perihilar Hepatectomy in Treatment of Hilar Cholangiocarcinoma
-
摘要:
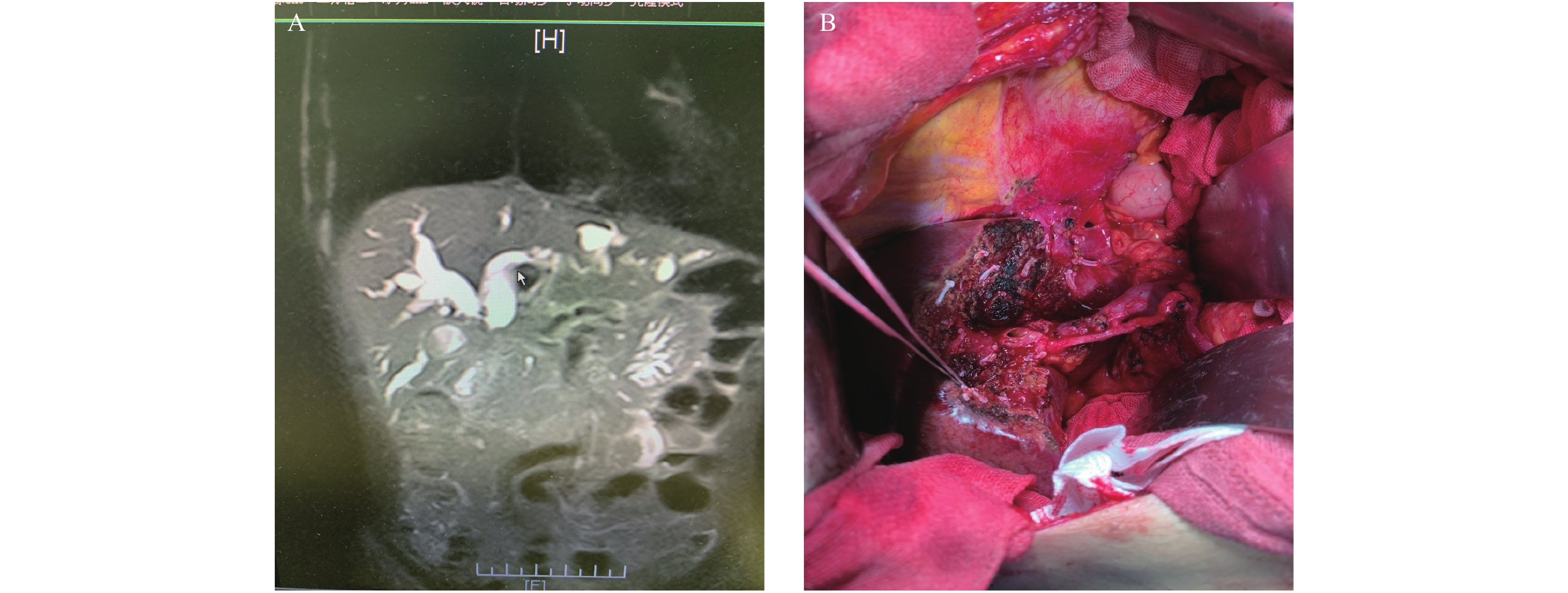
目的 总结不同手术切除方式治疗肝门部胆管癌(HCCA)的疗效。 方法 回顾性分析2015年1月至2020年12月临沧市人民医院施行手术治疗的52例HCCA患者的临床资料。其中采用半肝/扩大半肝 + 全尾叶切除36例(联合半肝切除组),肝门部/围肝门区 + 全尾叶切除16例((围肝门切除组),对比分析2组患者的术前资料,术中出血量、手术时间,肿瘤标本切缘阳性率、术后住院时间、术后3个月CA19-9值,以及术后1、3 a生存率等指标。 结果 联合半肝切除组与围肝门切除组的术中出血量[(705.5±54.3)mL vs (809.9±61.4)mL]、手术时间[(240.4±22.5)min vs (358.1±31.1)min]、肿瘤标本切缘阳性率(8.3% vs 18.8%)、术后3个月CA19-9值阴性率(88.2% vs 73.3%)以及术后1 a生存率(58.8% vs 40.0%),差异均有统计学意义(P < 0.05)。 结论 联合半肝切除与围肝门切除均是HCCA的有效手术方式,但前者具有更高的 R0 切除率及短期生存率等优势。 Abstract:Objective To summarize the curative effect of different surgical resection methods for hilar cholangiocarcinoma (HCCA). Methods The clinical data of 52 patients with HCCA who underwent surgery in Lincang people's Hospital from January 2015 to December 2020 were retrospectively analyzed. Among them, 36 cases were treated with hemihepatectomy/extended hemihepatectomy + total caudate lobectomy (combined hemihepatectomy group), 16 cases of hilar/perihilar region + total caudate lobectomy (perihilar resection group), The preoperative data, intraoperative blood loss, operation time, positive rate of tumor margin, postoperative hospital stay, CA19-9 value at 3 months after operation, and 1, 3-year survival rate of the two groups were compared and analyzed. Results The indexes of the combined hemihepatectomy group and perihepatectomy group were as following: the intraoperative blood loss [(705.5±54.3) mL vs (809.9±61.4) mL], the operation time [(240.4 ± 22.5) min vs (358.1 ± 31.1) min], the positive rate of tumor resection margin (8.3% vs 18.8%), the negative rate of CA19-9 3 months after operation (88.2% vs 73.3%), and the 1-year survival rate (58.8% vs 40.0%). The difference was statistically significant between the two groups (P < 0.05). Conclusion Combined hemihepatectomy and perihilar hepatectomy are effective surgical methods for HCCA, But the former has higher R0 resection rate and short-term survival rate. -
Key words:
- Keywords hilar tumor /
- Hepatectomy/method /
- Prognosis
-
表 1 2组一般情况比较(
$\bar x \pm s $ )Table 1. Comparison of general conditions of two groups (
$\bar x \pm s $ )项目 联合半肝切除组(n = 36) 围肝门切除组(n = 16) t/χ2 P 男/女(n) 23/13 10/6 110.23 0.37 年龄(岁) 58.3 ± 3.7 59.1 ± 2.4 1.47 0.69 术前 TBIL(mmol/L) 371 ± 129 382 ± 137 46.21 0.42 术前CA19-9阳性Bismuth-Corlette分型[n(%)] 30(83.3) 13(81.3) 23.56 0.79 Ⅰ型(n) _ 7 Ⅱ型( n ) 8 2 Ⅲ型( n ) 20 3 Ⅳ型( n ) 8 4 表 2 2组手术相关指标比较(
$\bar x \pm s $ )Table 2. Comparison of operation related indexes between the two groups (
$\bar x \pm s $ )项目 联合半肝切除组(n = 36) 围肝门切除组(n = 16) t/χ2 P 手术时间(min) 240.4 ± 22.5 358.1 ± 31.1 1.78 0.02 术中出血量(mL) 705.5 ± 54.3 809.9 ± 61.4 3.18 0.04 术后住院时间(d) 32.1 ± 3.6 33.5 ± 4.3 9.85 0.76 标本切缘阳性率[n(%)] 3(8.3) 3(18.8) 1.56 0.04 术后并发症[n(%)] 20(69.0) 9(69.2) 6.57 0.06 术后出血[ n (%)] 1(3.5) 0(0.0) 0.50 胆汁漏[ n (%)] 5(17.2) 3(23.1) 0.37 肝周积液[ n (%)] 3(10.3) 1(7.7) 0.17 胸腔积液[ n (%)] 7(24.1) 3(23.1) 0.75 电解质紊乱[ n (%)] 3(10.3) 2(15.4) 0.85 肝衰竭[ n (%)] 1(3.5) 0(0.0) 1.00 术后3个月CA19-9 < 37 KU/ L [n(%)] 30(88.2) 11(73.3) 3.43 0.04 术后存活[n(%)] 1 a[ n (%)] 20(58.8) 6(40.0) 8.57 0.03 3 a[ n (%)] 9(26.5) 3(20.0) 1.43 0.54 获随访例数:联合半肝切除组34例/围肝门切除组15例。 -
[1] Mansour J C,Aloia T A,Crane C H,et al. Hilar cholangiocarcinoma:expert consensus statement[J]. HPB(Oxford),2015,17(8):691-699. [2] Rizvi S,Khan S A,Hallemeier C L,et al. Cholangiocarcinoma- evolvingconcepts and therapeutic strategies[J]. Nat Rev Clin Oncol,2018,15(2):95-111. doi: 10.1038/nrclinonc.2017.157 [3] 中国抗癌协会. 肝门部胆管癌规范化诊治专家共识(2015)[J]. 中华肝胆外科杂志,2015,21(8):505-511. doi: 10.3760/cma.j.issn.1007-8118.2015.08.001 [4] 隋鑫磊,汤恢焕,肖广发,等. 肝门部胆管癌姑息治疗的效果及预后分析:附218例报告[J]. 中国普通外科杂志,2017,26(8):953-959. doi: 10.3978/j.issn.1005-6947.2017.08.001 [5] Groot Koerkamp B,Wiggers J K,Allen P J,et al. Recurrence rate and pattern of perihilar cholangiocarcinoma after curative intent resection[J]. J Am Coll Surg,2015,221(6):1041-1049. doi: 10.1016/j.jamcollsurg.2015.09.005 [6] Hu H J,Mao H,Shrestha A,et al. Prognostic factors and longterm outcomes of hilar cholangiocarcinoma:A single-institution experience in China[J]. World J Gastroenterol,2016,22(8):2601-2610. doi: 10.3748/wjg.v22.i8.2601 [7] 刘超. 日本名古屋大学肝门部胆管癌外科治疗策略[J]. 临床外科杂志,2020,28(8):704-706. doi: 10.3969/j.issn.1005-6483.2020.08.002 [8] Feo C F,Ginesu G C,Barmina M,et al. Curative resection for hilar cholangiocarcinoma:single-center experience with long-term follow-up[J]. Am Surg,2018,84(1):9-10. doi: 10.1177/000313481808400106 [9] Zhang X F,Squires M H,Bagante F,et al. The impact of intraoperative re-resection of a positive bile duct margin on clinical outcomes for hilar cholangiocarcinoma[J]. Ann Surg Oncol,2018,25(5):1140-1149. doi: 10.1245/s10434-018-6382-0 [10] Tsuchikawa T,Hirano S,Okamura K,et al. Advances in thesurgical treatment of hilar cholangiocarcinoma[J]. Expert Rev Gastroenterol Hepatol,2015,9(3):369-374. doi: 10.1586/17474124.2015.960393 [11] 鲁正,王冬冬. Bismuth-CorletteⅢ、Ⅳ型肝门部胆管癌的手术治疗方式[J]. 中华外科杂志,2016,54(7):488-491. doi: 10.3760/cma.j.issn.0529-5815.2016.07.003 [12] 项灿宏,童翾. 肝门部胆管癌外科治疗的进展与争议[J]. 中国普通外科杂志,2018,27(2):137-142. doi: 10.3978/j.issn.1005-6947.2018.02.001 [13] 李炜,王敬晗,姜小清. 肝门部胆管癌外科治疗争议与进展[J]. 中国实用外科杂志,2020,40(4):472-476. [14] 胡杨科,王珂,吴胜东,等. 肝门胆管癌外治疗进展[J]. 肝胆胰外科杂志,2019,(31):632-636. [15] 晏益核,黄玉斌,蔡小勇. 肝门部胆管癌的外科治疗现状[J]. 中国普通外科杂志,2017,26(2):246-251. [16] CSCO 胆道肿瘤专家委员会. CSCO 胆道系统肿瘤诊断治疗专家共识(2019年版)[J]. 临床肿瘤学杂志,2019,24(9):828-838. doi: 10.3969/j.issn.1009-0460.2019.09.014 [17] 汪宏,姚小晓,乔士兴. 肝门部胆管癌手术切除范围的争议及诊疗进展[J]. 临床肝胆病杂志,2020,36(3):704-707. doi: 10.3969/j.issn.1001-5256.2020.03.053 [18] 李留峥,王峻峰,徐雷升,等. 肝门部胆管癌手术治疗:附44例报告[J]. 中国普通外科杂志,2021,30(2):140-150. doi: 10.7659/j.issn.1005-6947.2021.02.003 [19] 曾宁,杨剑,项楠,等. 三维可视化联合3D打印在BismuthCorlette III、IV型肝门部胆管癌个体化精准外科治疗中的应用[J]. 南方医科大学学报,2020,40(8):1172-1177. [20] 叶征辉,黄帆. BismuthⅣ型肝门部胆管癌的手术治疗[J]. 肝胆外科杂志,2017,25(4):243. [21] 崔云甫,徐艺. 肝门部胆管癌的外科治疗体会[J]. 中国普外基础与临床杂志,2016,23(11):1311-1314. doi: 10.7507/1007-9424.20160337 -






 下载:
下载: