Changes and Abnormal Patterns of Coagulation Indicators in Patients with Lung Adenocarcinoma and Tuberculosis Pleural Effusion
-
摘要:
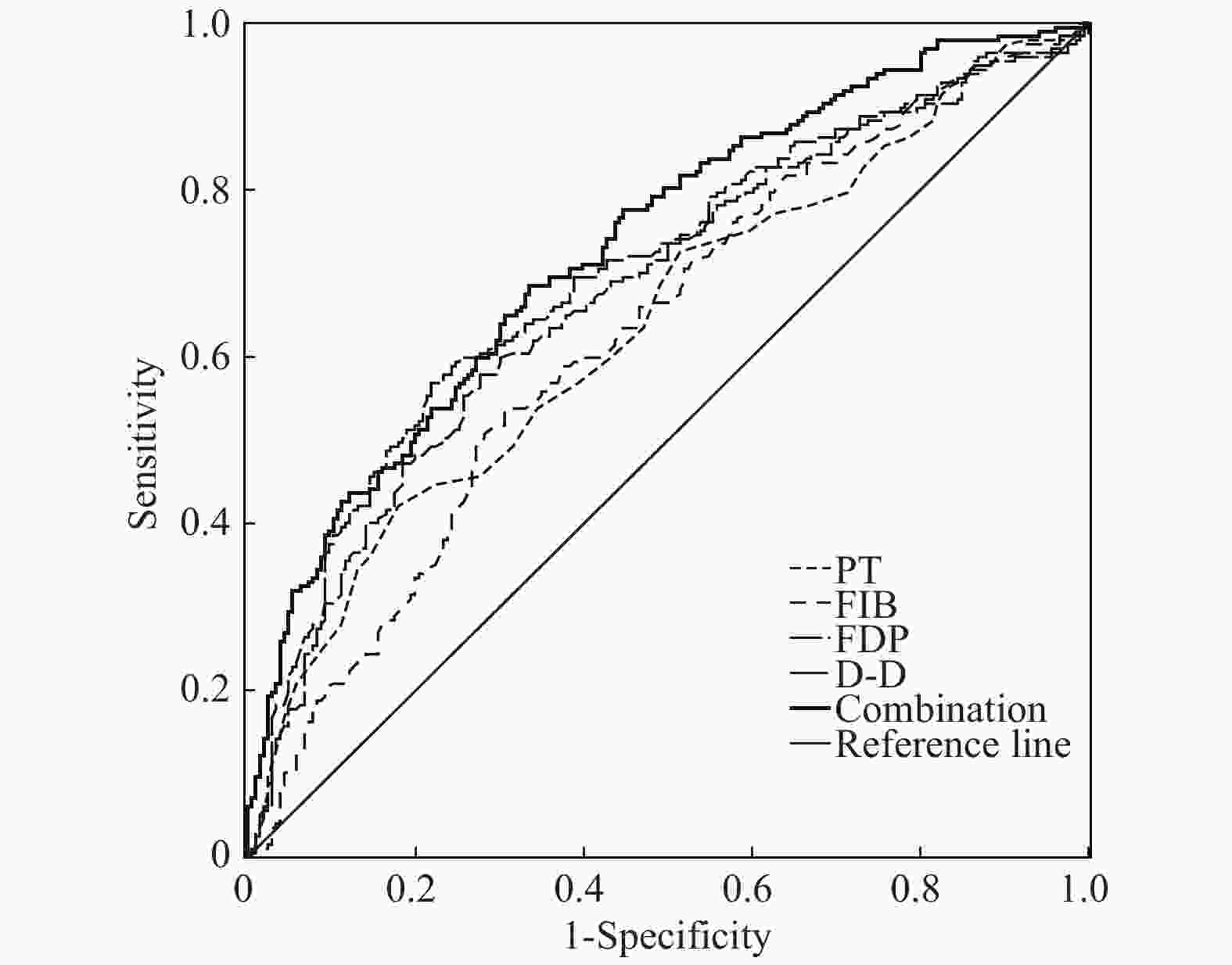
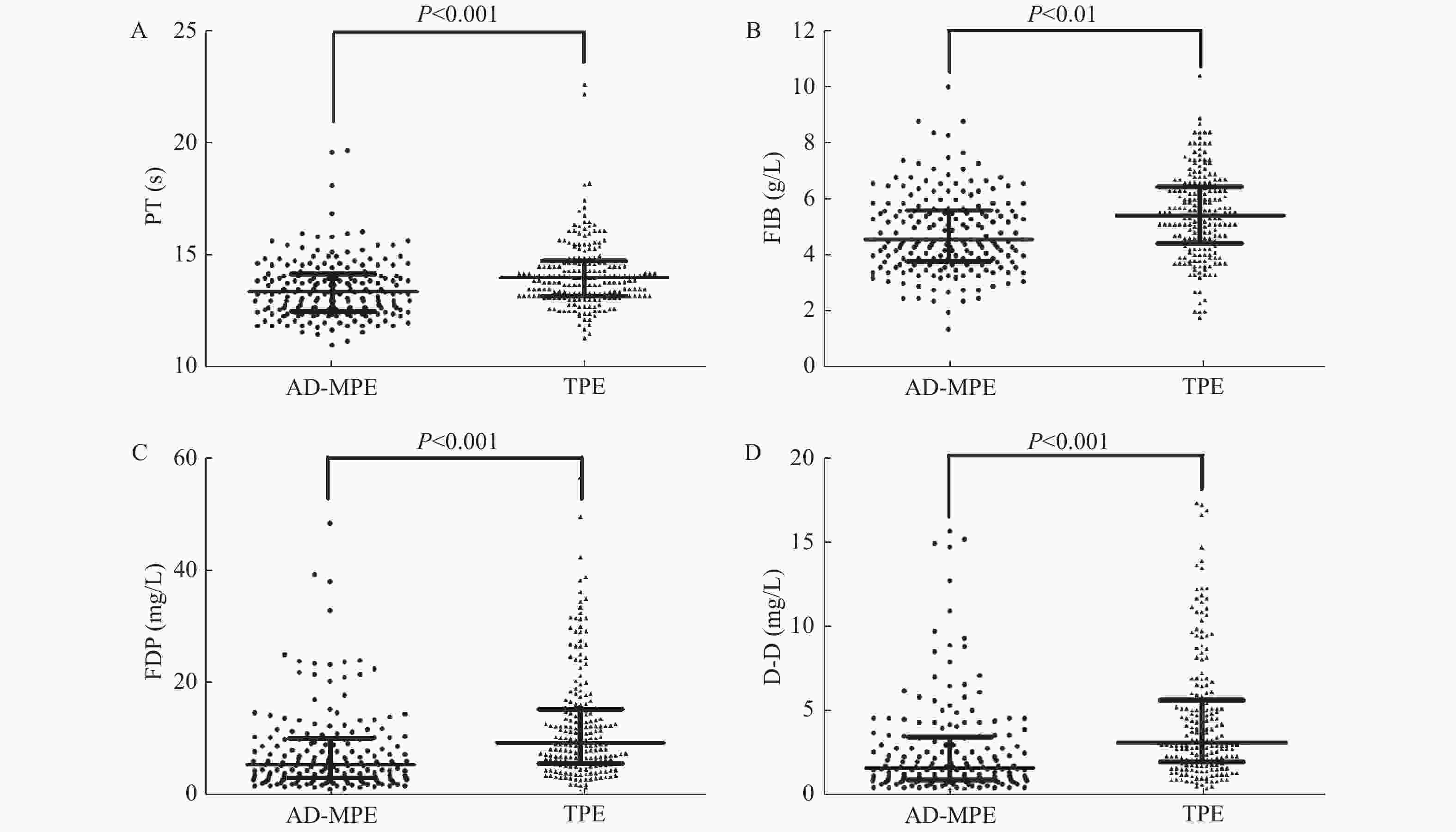
目的 探讨凝血功能指标的变化和不同异常模式在鉴别肺腺癌性胸腔积液(malignant pleural effusion associated with lung adenocarcinoma,AD-MPE)与结核性胸腔积液(tuberculous pleural effusion,TPE)中的应用价值,以期筛选最优的鉴别诊断模型。 方法 选取临床确诊的200例AD-MPE患者和209例TPE患者进行凝血功能指标的检测,包括活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)、纤维蛋白原含量(FIB)、凝血酶时间(TT)、纤维蛋白原降解产物(FDP)和D-二聚体(D-D),对各项指标的异常模式进行分析并用ROC曲线确定单项检测以及联合检测的诊断性能。 结果 TPE患者的PT、FIB、FDP和D-D水平显著高于AD-MPE患者(P < 0.001)。TPE组4项指标同时异常的发生率明显高于AD-MPE(P均 < 0.001)。4项指标联合异常模式后诊断性能优于任一指标(曲线下面积0.732)。 结论 2组患者的PT、FIB、FDP和D-D表达水平和异常模式变化均不相同,4项指标和异常模式的联合有助于AD-MPE和TPE的鉴别诊断。 Abstract:Objective To assesse the changes and abnormal patterns of coagulation indicators in distinguishing malignant pleural effusion of lung adenocarcinoma (AD-MPE) and tuberculous pleural effusion (TPE) and acquire the optimal diagnostic model. Methods Patients with 200 AD-MPEs or 209 TPEs participated in this retrospective study. Coagulation function indicators, including activated partial thromboplastin time (APPT), prothrombin time (PT), fibrinogen (FIB), thrombin time (TT), fibrinogen degradation products (FDP), and D-dimer(D-D), were measured; their levels and abnormal patterns were analyzed separately and in combination, to determine the diagnostic performance of individual and combined values and the optimal diagnostic model. Results PT, FIB, FDP, and D-Dlevels in patients with TPE were significantly higher than those in patients with AD-MPE (all P < 0.01). PT, FIB, FDP, and D-D values, particularly FDP and D-D, could distinguish between AD-MPE and TPE. The diagnostic performance was better for the combination of the four indicators and their abnormal patterns than for any single indicator (area under the curve: 0.732). The proportion of patients with abnormal patterns of all four indicators was significantly higher in those with TPE than in those with AD-MPE (all P < 0.001). Conclusions In the two groups of patients, the levels and abnormal patterns of PT, FIB, FDP and D-D are not the same. The combination of the four indicators and their abnormal patterns is helpful for the differential diagnosis of TPE and AD-MPE. -
Key words:
- Pleural effusion /
- Coagulation indicators /
- Tuberculosis /
- Lung adenocarcinoma
-
表 1 409例胸腔积液患者基本资料及凝血指标水平[(
$ \bar x \pm s $ )/M(P25,P75)]Table 1. Basic characteristics and coagulation indicator levels in 409 patients with pleural effusions[(
$ \bar x \pm s $ )/M(P25,P75)]指标 AD-MPE组 (n = 200) TPE组(n = 209) χ2/t/z P 性别 [n(%)] 2.167 0.141 男 114 (57.00) 134 (66.67) 女 86 (43.00) 75 (33.33) 年龄(岁 ) 31~87(63.81 ± 11.17) 30~86(61.96 ± 13.45) 1.503 0.134 凝血功能指标 APTT (s) 33.20 ± 6.28 33.97 ± 6.56 1.223 0.222 PT (s) 13.51 ± 1.32 14.15 ± 1.48 4.559 0.000 FIB (g/L) 4.81 ± 1.39 5.44 ± 1.48 4.474 0.000 TT (s) 16.18 ± 1.35 16.30 ± 1.68 0.819 0.413 FDP (mg/L) 5.42(3.00,10.20) 9.14(5.46,15.25) 5.896 0.000 D-D (mg/L) 1.57(0.95,3.36) 3.03(1.85,5.62) 6.456 0.000 表 2 AD-MPE和TPE组凝血功能指标异常率的比较[n(%)]
Table 2. Comparison of abnormal rate of coagulation function indicators in AD-MPE and TPE [n (%)]
指标 AD-MPE组 (n = 200) TPE组 (n = 209) χ P APTT 8(4.00) 11(5.26) 0.368 0.554 PT 53(26.50) 101(48.33) 20.738 0.000 FIB 134(62.00) 169(80.86) 10.227 0.001 TT 1(0.50) 4(1.91) 1.692 0.193 FDP 107(53.50) 177(84.69) 48.846 0.000 D-D 107(53.50) 177(84.69) 48.846 0.000 表 3 凝血功能指标不同异常模式在AD-MPE和TPE中的比较[n (%)]
Table 3. Comparison of abnormal patterns of coagulation function indicators in AD-MPE and TPE [n (%)]
模式 指标 AD-MPE组 (n = 200) TPE组 (n = 209) χ P APTT PT FIB TT FDP D-D n % n % A - ↑ ↑ - ↑ ↑ 18 9.00 67 30.14 33.003 0.000 B - - ↑ - ↑ ↑ 54 27.00 66 31.58 1.034 0.309 C - - ↑ - - - 39 19.50 12 5.74 17.725 0.000 D - - - - ↑ ↑ 25 12.50 17 8.13 2.114 0.146 E - ↑ ↑ - - - 18 9.00 14 6.70 0.751 0.386 F - ↑ - - ↑ ↑ 5 2.50 11 5.26 2.076 0.150 G ↑ - ↑ - ↑ ↑ 2 1.00 6 2.87 1.865 0.172 H - ↑ - - - - 5 2.50 4 1.91 0.163 0.686 I - - - - - - 26 13.00 5 2.39 16.417 0.000 其它 7 4.00 7 5.26 2.944 0.086 注:“↑”表示异常升高;“-”表示正常;“其它”表示2组均是3例以下的稀有模式。 表 4 各项指标单项及联合应用于鉴别诊断AD-MPE和TPE的AUC结果
Table 4. The AUC of single and combined indexes detection for differential diagnosis of AD-MPE and TPE
指标 Cut-off 值 灵敏度 (%) 特异度 (%) 约登指数 AUC 标准误 P 95% 置信区间 低值 高值 PT 13.02 42.13 82.039 0.242 0.639 0.027 0.000 0.585 0.693 FIB 4.66 53.81 69.417 0.232 0.628 0.028 0.000 0.574 0.682 FDP 6.23 57.87 72.330 0.302 0.682 0.027 0.000 0.630 0.734 D-D 1.97 59.90 74.757 0.347 0.696 0.026 0.000 0.644 0.748 模式 - 32.49 91.75 0.242 0.686 0.026 0.000 0.635 0.737 五项联合 - 68.53 66.50 0.350 0.732 0.025 0.000 0.683 0.780 -
[1] Hawatmeh A,Thawabi M,Jmeian A,et al. Amiodarone-induced loculated pleural effusion without pulmonary parenchymal involvement:A case report and literature review[J]. J Nat Sci Biol Med,2017,8(1):130-133. doi: 10.4103/0976-9668.198345 [2] Ranucci M. Bank blood shortage,transfusion containment and viscoelastic point-of-care coagulation testing in cardiac surgery[J]. Br J Anaesth,2017,118(6):814-815. doi: 10.1093/bja/aex143 [3] Rocca B,Peter K. Platelets,coagulation,and the vascular wall:the quest to better understand and smarten up our therapeutic targeting of this triad in primary and secondary prevention of cardiovascular events[J]. Cardiovasc Res,2021,117(9):1998-2000. doi: 10.1093/cvr/cvab121 [4] Hardak E,Peled E,Crispel Y,et al. Heparan sulfate chains contribute to the anticoagulant milieu in malignant pleural effusion[J]. Thorax,2020,75(2):143-152. doi: 10.1136/thoraxjnl-2018-212964 [5] Fan M,Bai J,Ding T,et al. Adipose-Derived Stem Cell Transplantation Inhibits Vascular Inflammatory Responses and Endothelial Dysfunction in Rats with Atherosclerosis[J]. Yonsei Med J,2019,60(11):1036-1044. doi: 10.3349/ymj.2019.60.11.1036 [6] Gao G,Zhang Y,Yu J,et al. Long Non-coding RNA MALAT1/microRNA-143/VEGFA Signal Axis Modulates Vascular Endothelial Injury-Induced Intracranial Aneurysm[J]. Nanoscale Res Lett,2020,15(1):139. doi: 10.1186/s11671-020-03357-2 [7] Bayram N,Karakan Y,Uyar M,et al. Vascular endothelial growth factor in pleural effusions and correlation with radiologic and biochemical parameters[J]. Niger J Clin Pract,2018,21(1):59-62. [8] Piccioli A,Lensing A W,Prins M H,et al. Extensive screening for occult malignant disease in idiopathic venous thromboembolism:a prospective randomized clinical trial[J]. J Thromb Haemost,2004,2(6):884-889. doi: 10.1111/j.1538-7836.2004.00720.x [9] Aminian A,Karimian F,Mirsharifi R,et al. Significance of platelet count in esophageal carcinomas[J]. Saudi J Gastroenterol,2011,17(2):134-137. doi: 10.4103/1319-3767.77245 [10] Palumbo J S,Talmage K E,Massari J V,et al. Platelets and fibrin (ogen) increase metastatic potential by impeding natural killer cell-mediated elimination of tumor cells[J]. Blood,2005,105(1):178-185. doi: 10.1182/blood-2004-06-2272 [11] Wang J Y,Hsueh P R,Lee L N,et al. Mycobacterium tuberculosis inducing disseminated intravascular coagulation[J]. Thromb Haemost,2005,93(4):729-734. doi: 10.1160/TH04-09-0562 [12] Kager L M,Blok D C,Lede I O,et al. Pulmonary tuberculosis induces a systemic hypercoagulable state[J]. J Infect,2015,70(4):324-334. doi: 10.1016/j.jinf.2014.10.006 [13] Venkatasubramanian S,Tripathi D,Tucker T,et al. Tissue factor expression by myeloid cells contributes to protective immune response against Mycobacterium tuberculosis infection[J]. Eur J Immunol,2016,46(2):464-479. doi: 10.1002/eji.201545817 [14] Caccamo N,Dieli F. Inflammation and the coagulation system in tuberculosis:Tissue Factor leads the dance[J]. Eur J Immunol,2016,46(2):303-306. doi: 10.1002/eji.201546225 [15] Suzuki S,Morishima Y,Takita A,et al. Responses of prothrombin time and activated partial thromboplastin time to edoxaban in Japanese patients with non-valvular atrial fibrillation:characteristics of representative reagents in Japan (CVI ARO 7)[J]. Heart Vessels,2019,34(12):2011-2020. doi: 10.1007/s00380-019-01438-6 [16] Yang S,Yang L,Wu Y,et al. Anaplastic lymphoma kinase rearrangement may increase the incidence of venous thromboembolism by increasing tissue factor expression in advanced lung adenocarcinoma[J]. Ann Transl Med,2020,8(20):1307. doi: 10.21037/atm-20-6619 [17] Alberti A,Mancin M,Cortinovis D,et al. Disseminated intravascular coagulation in advanced lung adenocarcinoma during first-line pembrolizumab[J]. Immunotherapy,2020,12(9):629-633. doi: 10.2217/imt-2020-0018 -





 下载:
下载: