Rectal Cancer Preoperative Clinical Staging and Postoperative Recurrence and Metastasis Prediction by Carcinoembryonic Antigen
-
摘要:
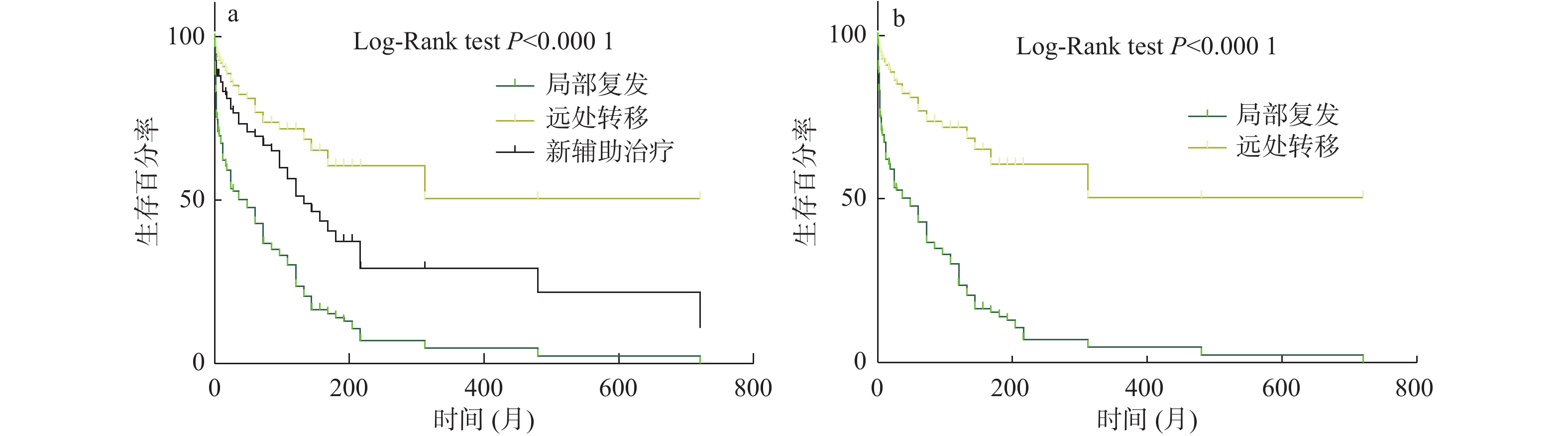
目的 探讨直肠癌患者术前临床分期及癌胚抗原与术后预后相关分析。 方法 收集恩施州中心医院2013年10月至2015年10月直肠癌患者200例;收集患者病理T、N、M分期、术前CEA值、病灶所在肠管位置、累及肠管长度(CT图像测量)、累及肠圈比例、肠周淋巴结是否阳性、环周切缘是否阳性、距离肛门距离、壁外血管是否受浸润,这几个指标为回顾性收集资料;随访观察患者术后是否发生复发和转移2个结果,并记录发生复发、转移、死亡时间。研究方法:用Cox多因素相关分析上述几个指标与患者术后发生复发、转移2个结果相关分析,并找到预测术后发生复发、转移的因素。总生存时间用Kaplan - Meier曲线描述复发和转移患者,并用Log-Rank检验其差异。 结果 与术后发生转移相关因素分别为N分期P = 0.001;HR = 11.22;95%CI(2.55,49.25)、术前CEA值P < 0.001,HR = 1.00;95%CI(1.002,1.006),这2个因素与术后发生远处转移有相关性;与术后发生局部复发相关的因素为T分期P = 0.036;;HR = 1.726;95%CI(1.03,2.87)、术前CEA值P = 0.034;HR = 1.00;95%CI(0.99,1.005)。 结论 T分期与术后局部复发有显著相关,N分期与术后远处转移有相助相关性。 术前T分期能预测直肠癌术后局部复发;术前N分期与CEA能预测直肠癌术后远处转移。 -
关键词:
- 直肠癌 /
- Cox多因素风险回归 /
- 复发转移 /
- 癌胚抗原
Abstract:Objective To explore the correlation between preoperative clinical stage, carcinoembryonic antigen and postoperative prognosis in patients with rectal cancer. Methods 200 patients with rectal cancer from October 2013 to October 2015 were collected from The Central Hospital of Enshi Prefecture. Pathological T, N, AND M staging, preoperative CEA value, lesion location, length of involved bowel (measured by CT image), proportion of involved bowel, positive periintestinal lymph nodes, positive circumferential resection margin, distance from anus, and infiltration of extraneous vessels were collected retrospectively. The patients were followed up to observe whether the patients had recurrence, metastasis and death after surgery, and the time of recurrence, metastasis and death was recorded. Cox multivariate correlation analysis was used to analyze the correlation between the above indicators and postoperative recurrence and metastasis, and to find the factors that predicted postoperative recurrence and metastasis. Recurrence and metastasis were described by Kaplan-Meier curve and their differences were tested by Log-Rank. Results The factors related to postoperative metastasis were N stage, P = 0.001; HR = 11.22; 95%CI (2.55, 49.25), preoperative CEA value P < 0.001, HR = 1.00; 95%CI (1.002, 1.006); and these two factors were associated with distant metastasis after surgery. The factors associated with local recurrence were T stage (P = 0.036); HR = 1.726; 95%CI (1.03, 2.87), preoperative CEA value P = 0.034; HR = 1.00; 95%CI (0.99, 1.005). Conclusion T staging was significantly associated with postoperative local recurrence, and N staging was associated with postoperative distant metastasis. Preoperative T staging can predict postoperative local recurrence of rectal cancer. Preoperative N staging and CEA can predict postoperative distant metastasis of rectal cancer. -
表 1 基础变量统计描述[n(%)]
Table 1. Statistical description of basic variables [n(%)]
变量 计量资料中位数 ± 标准差和计数资料 性别 男性 136(68.00 ) 女性 64(32.00 ) 年龄[($\bar x \pm s $)岁] 57.12 ± 12.06 T分期 T1 3(1.50 ) T2 22(11.00 ) T3 66(33.00 ) T4 109(54.50 ) N分期 N0 35(17.50 ) N1 121(60.50 ) N2 44(22.00 ) 手术方式 Dixon’s手术 132(66.00 ) Miles’s手术 45(22.50 ) Hartman’s手术 13(6.50 ) 经肛门局部切除 10(5.00 ) 表 2 局部复发多因素Cox分析
Table 2. Multivariate Cox analysis of local recurrence
变量 Exp(B) 95.0% CI for Exp(B) P Lower Upper 远处转移 1.458 0.452 4.697 0.528 T分期 1.726 1.035 2.878 0.036* N分期 0.4 0.14 1.143 0.087 CEA 1 0.995 1.005 0.034* 病灶位置 1.147 0.568 2.315 0.702 累及肠管长度 1.011 0.974 1.049 0.564 肠壁厚度 1.049 0.953 1.154 0.328 累及肠圈 0.976 0.799 1.192 0.809 肠周淋巴结 0.992 0.807 1.22 0.938 环周切缘阳性 0.935 0.359 2.436 0.890 距肛门距离 0.995 0.979 1.012 0.586 壁外血管受浸润 1.017 0.416 2.487 0.971 与患者手术后发生局部复发相关因素为T分期、术前CEA值。*P < 0.05。 表 3 远处转移多因素Cox分析
Table 3. Multivariate Cox analysis of distant metastasis
变量 Exp(B) 95.0% CI for Exp(B) P Lower Upper T分期 1.250 0.712 2.194 0.437 N分期 11.226 2.559 49.250 0.001* CEA 1.004 1.002 1.006 0.000* 病灶位置 2.138 0.966 4.731 0.061 累及肠管长度 0.971 0.918 1.026 0.288 肠壁厚度 0.963 0.857 1.083 0.529 累及肠圈 1.136 0.880 1.467 0.329 肠周淋巴结 0.990 0.796 1.231 0.929 环周切缘阳性 0.275 0.058 1.299 0.103 距肛门距离 0.998 0.980 1.015 0.787 壁外血管受浸润 1.964 0.676 5.703 0.215 与患者手术后发生局部复发相关因素为N分期、术前CEA值。*P < 0.05。 -
[1] Wasmuth H H,Faerden A E,Myklebust T Å,et al. Transanal total mesorectal excision for rectal cancer has been suspended in Norway[J]. Br J Surg,2020,107(1):121-130. [2] Akce M,El-Rayes B F. Nonsurgical management of rectal cancer[J]. Oncol Pract,2019,15(3):123-131. doi: 10.1200/JOP.18.00769 [3] Van Gijn W,Marijnen C A,Nagtegaal I D,et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer:12-year follow-up of the multicentre,randomised controlled TME trial[J]. Lancet Oncol,2011,12(6):575-582. doi: 10.1016/S1470-2045(11)70097-3 [4] Fernandez L M,São Julião G P,Figueiredo N L,et al. Conditional recurrence-free survival of clinical complete responders managed by watch and wait after neoadjuvant chemoradiotherapy for rectal cancer in the International Watch & Wait Database:A retrospective,international,multicentre registry study[J]. Lancet Oncol,2021,22(1):43-50. doi: 10.1016/S1470-2045(20)30557-X [5] Alonso S,Pascual M,Salvans S,et al. Postoperative intra-abdominal infection and colorectal cancer recurrence:A prospective matched cohort study of inflammatory and angiogenic responses as mechanisms involved in this association[J]. Eur Surg Oncol,2015,41(2):208-214. doi: 10.1016/j.ejso.2014.10.052 [6] Van Oostendorp S E,Belgers H J E,Hol J C,et al. The learning curve of transanal total mesorectal excision for rectal cancer is associated with local recurrence:Results from a multicentre external audit[J]. Colorectal Dis,2021,23(8):2020-2029. doi: 10.1111/codi.15722 [7] 刘启志, 郝立强, 楼征, 等 结直肠癌术后早期和晚期复发转移与临床病理特征的关系[J]. 中华普通外科杂志, 2019, 34(8): 675-678. [8] Lacy A M,Nogueira S T,Lacy F. Comment on:Norwegian moratorium on transanal total mesorectal excision[J]. British Journal Surgery,2019,106(13):1855-1855. [9] 蒲竞,陈晓红,王慧春,等. 血清CEA、CA19-9及PET-CT SUV值对结直肠癌患者术后复发/转移的诊断价值[J]. 中国肛肠病杂志,2019,39(8):1-4. doi: 10.3969/j.issn.1000-1174.2019.08.001 [10] Achilli P,Radtke TS,Lovely J K,et al. Preoperative predictive risk to cancer quality in robotic rectal cancer surgery[J]. Eur Surg Onco,2021,47(2):317-322. doi: 10.1016/j.ejso.2020.08.019 [11] São Julião G P,Habr-Gama A,Vailati B B,et al. New strategies in rectal Cancer[J]. Surg Clin North Am,2017,97(3):587-604. doi: 10.1016/j.suc.2017.01.008 [12] Walters S,Benitez Majano S,Muller P,et al. Is England closing theinternational gap in cancer survival?[J]. Br Cancer,2015,113(5):848-860. doi: 10.1038/bjc.2015.265 [13] Benitez Majano S,Di Girolamo C,Rachet B,et al. Surgical treatment andsurvival from colorectal cancer in Denmark,England,Norway,and Sweden:A population-based study[J]. Lancet Onco ,2019,20(1):74-87. doi: 10.1016/S1470-2045(18)30646-6 -





 下载:
下载: