Two-dimensional Speckle Tracking Technology in the Study of Acute Myocardial Injury Caused by Anthracyclines
-
摘要:
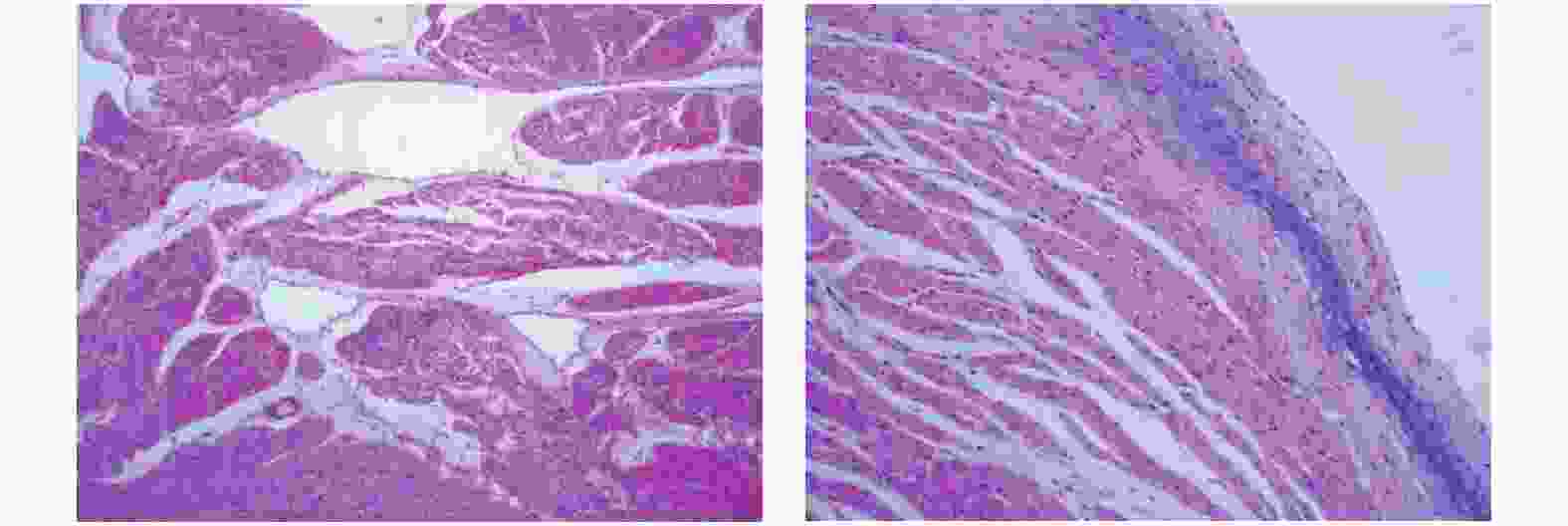
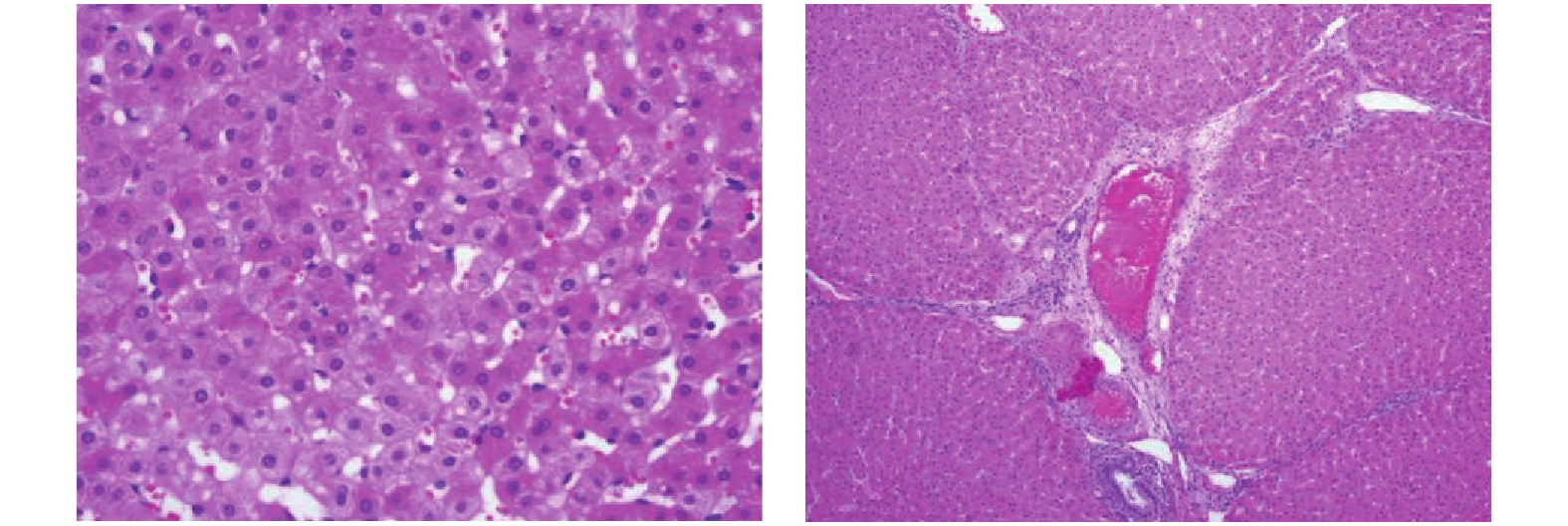
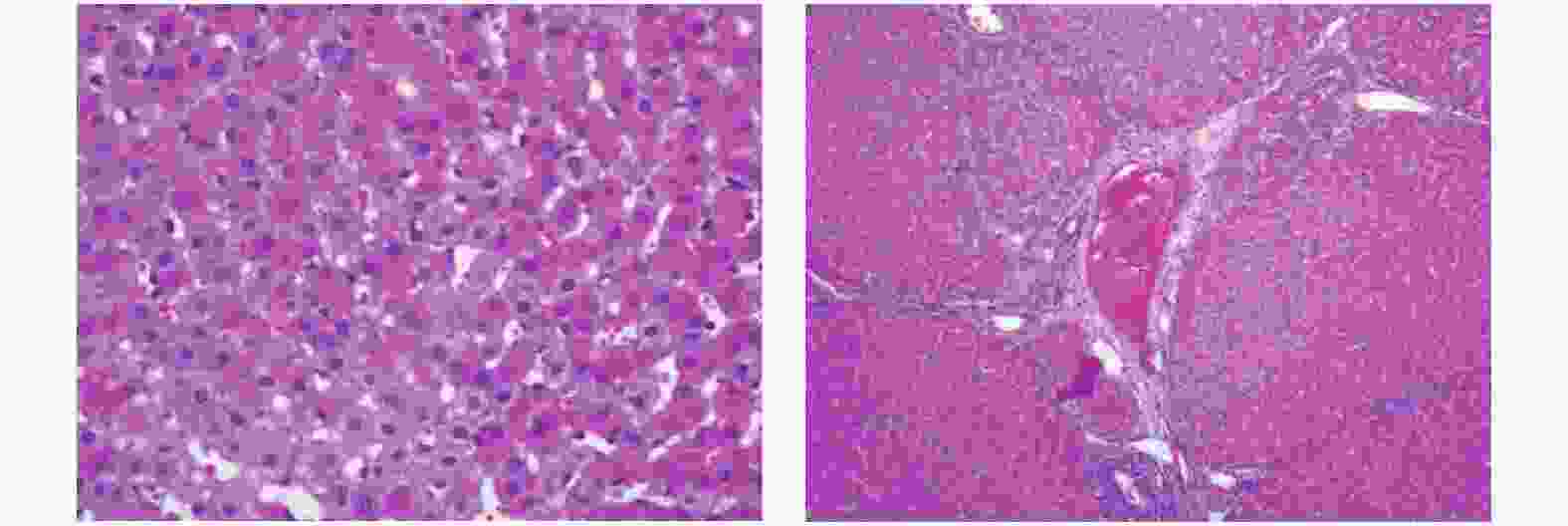
目的 应用二维斑点追踪技术(STI)研究柔红霉素致滇南小耳猪急性期心肌损伤的左心室应变特点及心肌病理改变。 方法 选取滇南小耳猪6只,常规给予麻醉后连接心电图电极,予柔红霉素进行静脉推注,制成心脏毒性急性期动物模型,并于给药前和给药后3 d进行心脏超声数据获取、抽血进行cTnT测定,处死后进行心脏、肝脏的病理检测。超声参数获取二维超声心动图测量左心室舒张末期内径(left ventricular end-diastolic diameter,LVDd)、二尖瓣舒张期血流E峰速度、A峰速度及E/A比值、自动计算左心室整体纵向应变GLS、左心室分层纵向应变参数并进行对比分析。 结果 急性期心肌损伤给药前后左室舒张末内径(LVDd)、左室收缩末内径 (LVDs)、室间隔舒张末厚度 (IVSd) 左室后壁舒张末厚度 (PWd),M型测量左心室EF均无统计学差异(P > 0.05)。给药后血清cTnT浓度虽然逐步升高,但一直保持在正常范围内,较给药前所测值无明显统计学差异(P > 0.05)。肝脏和心肌细胞不同程度出现水肿、充血表现,心内膜出现玻璃样变和粘液样变。给药前后左心室整体和心内膜层的GLS有统计学差异(P < 0.05),中间层及心外膜层的GLS无统计学差异(P > 0.05)。 结论 大剂量蒽环类药物对心肌会产生急性期的心肌损伤,病理结果支持心肌细胞的损伤。同时常规测量心腔大小以及EF不能及时反应出心肌的功能损伤,应用2D-STI技术测量左心室纵向应变以及心内膜层中心应变相较于传统心脏超声数据如EF等能够更敏感地发现应用蒽环类药物后的心脏毒性反应。 Abstract:Objective To study the characteristics of left ventricular strain and myocardial pathological changes in acute myocardial injury induced by anthracyclines in Diannan small-ear pigs. Methods Six small-eared pigs from southern Yunnan were selected. After routine anesthesia, electrocardiogram electrodes were connected, daunorubicin was injected intravenously, and an animal model of acute cardiotoxicity was made. The echocardiography was performed before and three days after the administration. Data acquisition, blood draw for cTnT determination, and pathological examination of heart and liver after execution. Obtain two-dimensional echocardiography of ultrasound parameters to measure the left ventricular end-diastolic diameter (LVDd), peak E velocity, peak A velocity and E/A ratio of blood flow during diastole of the mitral valve, and automatically calculate the overall left ventricle longitudinal strain GLS and left ventricular stratified longitudinal strain parameters were compared and analyzed. Results There was no statistical difference in left ventricular end diastolic diameter (LVDd), left ventricular end systolic diameter (LVDs), ventricular septal end diastolic thickness (IVSd) and left ventricular posterior wall end diastolic thickness (PWd) and EF between before and after administration of acute myocardial injury (P > 0.05). Although the serum cTnT concentration gradually increased after administration, it remained within the normal range, and there was no significant statistical difference from the value measured before administration. The liver and myocardial cells showed edema and congestion to varying degrees, and hyaloid and mucus-like changes appeared in the endocardium (P > 0.05). There were statistical differences in the overall GLS of the left ventricle and the endocardial layer before and after the administration, but there was no statistical difference in the GLS of the middle layer and the epicardial layer (P < 0.05). Conclusions Large doses of anthracyclines can cause acute myocardial damage to the myocardium, and the pathological results support myocardial cell damage. At the same time, the conventional measurement of the size of the heart cavity and EF cannot reflect the functional damage of the myocardium in time. The use of 2D-STI technology to measure the longitudinal strain of the left ventricle and the strain of the center of the endocardium layer can be more sensitive to find applications than traditional cardiac ultrasound data such as EF. Cardiotoxicity after anthracyclines. -
Key words:
- Spot tracking /
- Anthracyclines /
- Daunorubicin /
- Animals /
- Myocardial injury
-
表 1 给药前后心脏斑点追踪指标(
$\bar x \pm s $ )Table 1. Heart spot tracking index before and after administration (
$\bar x \pm s $ )时间 GLS整体 GLS心内膜层 GLS中间层 GLS心外膜层 PSD(ms) 给药前 −19.91 ± 0.59 −17.96 ± 0.73 −17.91 ± 0.02 −22.15 ± 0.85 37.87 ± 7.38 给药后 −17.16 ± 0.51 −14.86 ± 0.45 −18.30 ± 0.03 −22.32 ± 1.47 41.12 ± 5.59 t −4.03 −6.12 0.214 0.08 −0.924 P 0.005 0.001* 0.836 0.94 0.386 *P < 0.05。 表 2 给药前后心脏相关其他指标(
$\bar x \pm s $ )Table 2. Other indicators related to the heart before and after administration (
$\bar x \pm s $ )时间 LVDd EF% E(m/s) A(m/s) E/A cTnT(pg/mL) 给药前 33.68 ± 0.97 63.62 ± 1.74 0.96 ± 0.04 0.44 ± 0.03 2.27 ± 0.18 1.15 ± 0.77 给药后 39.05 ± 2.04 61.37 ± 1.91 0.99 ± 0.05 0.43 ± 0.04 2.42 ± 0.21 1.78 ± 0.93 t −1.95 0.901 −0.31 0.313 −0.869 0.421 P 0.093 0.398 0.765 0.763 0.414 0.665 -
[1] Rubnitz J E. Current management of childhood acute myeloid leukemia[J]. Paediatr Drugs,2017,19(1):1-10. doi: 10.1007/s40272-016-0200-6 [2] Aplenc R,Meshinchi S,Sung L,et al. The addition of bortezomib to standard chemotherapy for pediatric acute myeloid leukemia has increased toxicity without the rapeutic benefit:A report from the Children’s Oncology Group[J]. Blood,2016,128:899. doi: 10.1182/blood.V128.22.899.899 [3] Curigliano G, Cardinale D, Dent S, et al: Cardiotoxicity of anticancer treatments: Epidemiology[J], detection, and management[J]. CA Cancer J Clin, 2016 07 , 66(4): 309-325. [4] Tamer Yoldaş et al. Evaluation of long-term cardiac side effects of anthracycline chemotherapy by conventional and non-conventional echocardiographic methods in childhood cancer survivors[J]. Cardiol Young,2019,29(7):904-909. doi: 10.1017/S1047951119001094 [5] 智光. 超声心动图对肿瘤化疗中心脏功能的监测[J]. 中华医学超声杂志(电子版),2018,15(6):404-408. doi: 10.3877/cma.j.issn.1672-6448.2018.06.002 [6] Curigliano G,Cardinale D,Suter T,et al. Cardiovascular toxicity induced by chemotherapy,targeted agents and radiotherapy:ESMO Clinical Practice Guidelines[J]. Ann Oncol,2012,23(Suppl 7):155-166. [7] Zamorano J L,Lancellotti P,Rodriguez Muñoz D,et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines:The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC)[J]. Eur J Heart Fail,2017,19(1):9-42. doi: 10.1002/ejhf.654 [8] 中华医学会超声医学分会超声心动图学组,中国医师协会心血管分会超声心动图专业委员会,中国抗癌协会整合肿瘤心脏病学分会,等. 抗肿瘤治疗心血管损害超声心动图检查专家共识[J]. 中华超声影像学杂志,2020,29(4):277-288. [9] 陈静. 二维斑点追踪技术在评估合并高血压的蒽环类乳腺癌化疗患者左室心肌收缩功能中的应用价值[D]. 贵阳: 贵州医科大学硕士论文, 2020. [10] Zhang S,Liu X,Bawa-Khalfe T,et al. Identification of the molecular basis of doxorubicin-induced cardiotoxicity[J]. Nat Med,2012,18(11):1639-1642. [11] Gorini S,De Angelis A,Berrino L,et al. Chemotherapeutic Drugs and Mitochondrial Dysfunction:Focus on Doxorubicin,Trastuzumab,and Sunitinib[J]. Oxid Med Cell Longev,2018,75:82730. [12] Lyu Y L,Kerrigan J E,Lin C P,et al. Topoisomerase IIbeta mediated DNA double-strand breaks:implications in doxorubicin cardiotoxicity and prevention by dexrazoxane[J]. Cancer Res,2007,67(18):8839-8846. [13] Vejpongsa P,Yeh E T. Topoisomerase 2beta:a promising molecular target for primary prevention of anthracycline-induced cardiotoxicity[J]. Clin Pharmacol Ther,2014,95(1):45-52. [14] 吴芳芳,王玲,陈剑琼,等. 三维斑点追踪技术联合血清肌钙蛋白评价蒽环类药物化疗后乳腺癌患者左心室收缩功能的改变[J]. 安徽医科大学学报,2018,53(01):114-118. [15] 姜金龙,计成阜,何广胜. 高敏感性心肌肌钙蛋白Ⅰ用于监测蒽环类药物治疗患者心脏毒性的临床价值[J]. 心血管康复医学杂志,2018,27(05):537-541. doi: 10.3969/j.issn.1008-0074.2018.05.12 [16] 许芳芳,郑慧,胡莉莉. 运用心肌综合指数预测蒽环类药物早期心脏毒性的可行性研究[J]. 医学影像学杂志,2021,31(04):561-565. [17] 梁梦婕,金怡,郑哲岚. 超声二维斑点追踪技术在蒽环类化疗药物心脏毒性监测中的应用价值[J]. 中华医学超声杂志(电子版),2019,16(10):749-755. doi: 10.3877/cma.j.issn.1672-6448.2019.10.007 [18] Huang J,Yan Z N,Rui Y F,et al. Left ventricular systolic function changes in primary hypertension patients detected by the strain of different myocardium layers[J]. Medicine(Baltimore),2016,95(2):e2440. -





 下载:
下载: