Orthogonal Experiment for Optimization of Ultrasonic Extraction Process of Six Components from Geranium wilfordii Maxim
-
摘要:
目的 采用L9(34)正交实验优化老鹳草中老鹳草素、没食子酸、柯里拉京、金丝桃苷、鞣花酸、原儿茶酸6种成分的超声提取方法。 方法 在单因素实验基础上,选取甲醇体积分数、超声提取时间、料液比3个主要因素进行L9(34)正交实验,研究各因素相互作用对老鹳草中6种成分提取率的影响。 结果 老鹳草中6种成分的超声法最佳提取工艺为:甲醇溶液体积分数:60%,料液比:1.0 g/10 mL,超声波提取时间:40 min。 结论 此方法操作简便,重复性高,准确度好,可用于老鹳草中老鹳草素、没食子酸、柯里拉京、金丝桃苷、鞣花酸、原儿茶酸6种成分的同时提取。 Abstract:Objective T o optimize the ultrasonic extraction method for Geraniin, Gallic acid, Corilagin, Hyperoside, Ellagic acid, Protocatechuic acid from Geranium wilfordii Maxim by L9(34) orthogonal experiment. Methods On the basis of single factor experiments, using L9(34) orthogonal experiment, three main factors, methanol volume fraction, extraction time, solid-liquid ratio are chosen for three main component to study the effect of the interaction of various factors on the extraction rate of six components fromGeranium wilfordiiMaxim. Results The results show that the optimum extraction process are as follow: the methanol volume fraction was 60%, the solid-liquid ratio was 1∶10(g∶ml), the extraction time was 40 min. Conclusion This method is simple, repeatability and accuracy. It can be to extract Geraniin, Gallic acid, Corilagin, Hyperoside, Ellagic acid, Protocatechuic acidfrom Geranium wilfordii Maxim. -
Key words:
- Geranium wilfordii Maxim /
- Ultrasonic Extraction /
- Orthogonal Experiment /
- HPLC
-
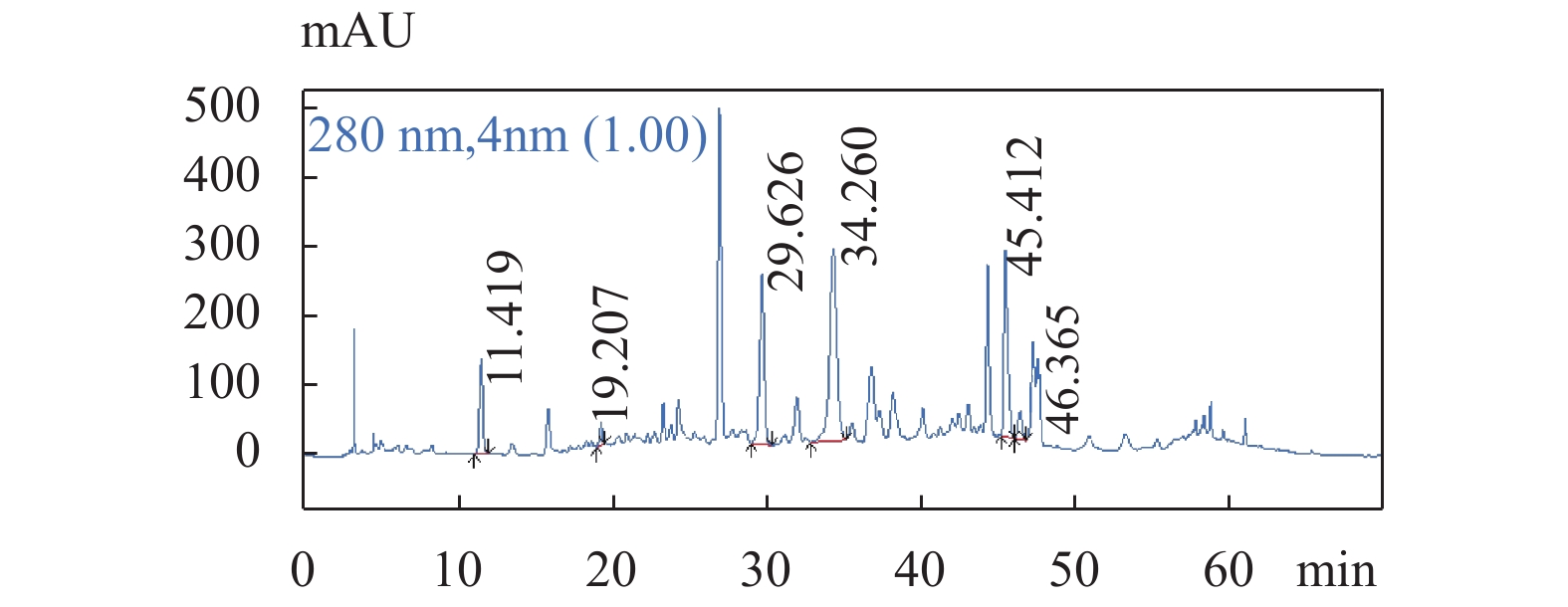
图 1 供试品溶液色谱图
色谱条件:流速:1.0 mL/min;柱温:25 ℃;检测波长:280 nm;梯度洗脱程序见表1。
Figure 1. The chromatogram of Geranium wilfordii Maxim
图 2 鞣花酸对照品溶液色谱图
色谱条件:流速:1.0 mL/min;柱温:25 ℃;检测波长:280 nm;梯度洗脱程序见表1。
Figure 2. The chromatogram of Ellagic acid
图 3 原儿茶酸对照品溶液色谱图
色谱条件:流速:1.0 mL/min;柱温:25 ℃;检测波长:280 nm;梯度洗脱程序见表1。
Figure 3. The chromatogram of Protocatechuic acid
图 4 柯里拉京对照品溶液色谱图
色谱条件:流速:1.0 mL/min;柱温:25 ℃;检测波长:280 nm;梯度洗脱程序见表1。
Figure 4. The chromatogram of Corilagin
图 5 老鹳草素对照品溶液色谱图
色谱条件:流速:1.0 mL/min;柱温:25 ℃;检测波长:280 nm;梯度洗脱程序见表1。
Figure 5. The chromatogram of Geraniin
图 6 没食子酸对照品溶液色谱图
色谱条件:流速:1.0 mL/min;柱温:25 ℃;检测波长:280 nm;梯度洗脱程序见表1。
Figure 6. The chromatogram of Gallic acid
图 7 金丝桃苷对照品溶液色谱图
色谱条件:流速:1.0 mL/min;柱温:25 ℃;检测波长:280 nm;梯度洗脱程序见表1。
Figure 7. The chromatogram of Hyperoside
表 1 HPLC梯度洗脱程序表、
Table 1. The HPLC gradient elution procedures
时间(min) 0.1%磷酸(Phosphoric) 乙腈(Acetonitrile) 0 96 4 10 95 5 15 88 12 20 86 14 30 85 15 40 79 21 50 79 21 60 55 45 70 55 45 表 2 因素水平表
Table 2. Factors and Levels
表 3 L9(34)正交试验表(老鹳草素)
Table 3. The results of orthogonal experiment (Geraniin)
试验 因素 老鹳草素
峰面积A B C 1 1 1 1 1103857 2 1 2 2 4837849 3 1 3 3 3661222 4 2 1 2 2185068 5 2 2 3 3675299 6 2 3 1 6156247 7 3 1 3 1361929 8 3 2 1 6736777 9 3 3 2 4823928 M1 9602928 4650854 13996881 T = 34542176 M2 12016614 15249925 11846845 y = 3838020 M3 12922634 14641397 8698450 m1 3200976 1550285 4665627 m2 4005538 5083308 3948948 m3 4307545 4880466 2899483 Rj R1 = 9346027 R2 = 3403080 R3 = 5942947 Sj S1 = 1963022889647 S2 = 23613509157143 S3 = 4734267721180 A:提取时间;B:料液比;C:溶剂体积分数; m1:实验因素一水平实验结果平均值;m2:实验因素二水平实验结果平均值;
m3:实验因素三水平实验结果平均值;Rj :M 值极差;Sj :反映了正交表上第 j 列所排因素的不同水平之间的差异程度,称 Sj 为第 j 列变差平方和;T:9 次实验结果之和;y:9 次实验结果平均值。在一定范围内,R值极差的大小与提取量的影响大小正比,m值大小与最佳提取条件因素成正比。表 4 L9(34)正交试验表(没食子酸)
Table 4. The results of orthogonal experiment (Gallic acid)
试验 因素 没食子酸
峰面积A B C 1 1 1 1 7314190 2 1 2 2 16280524 3 1 3 3 12562631 4 2 1 2 13938578 5 2 2 3 13910940 6 2 3 1 19201446 7 3 1 3 7694251 8 3 2 1 24710211 9 3 3 2 18204393 M1 36157345 28947018 51225846 T = 133817162 M2 47050964 54901675 48423495 y = 14868574 M3 50608854 49968469 34167822 m1 12052448 9649006 17075282 m2 15683655 18300558 16141165 m3 16869618 16656156 11389274 Rj R1 = 22278828 R2 = 7850711 R3 = 5480344 Sj S1 = 37797292060705 S2 = 126653568075958 S3 = 55783729621634 表 5 L9(34)正交试验表(柯里拉京)
Table 5. The results of orthogonal experiment (Corilagin)
试验 因素 柯里拉京
峰面积A B C 1 1 1 1 1904530 2 1 2 2 3202766 3 1 3 3 1869245 4 2 1 2 3343529 5 2 2 3 2315514 6 2 3 1 3106967 7 3 1 3 2468583 8 3 2 1 4962727 9 3 3 2 2490196 M1 6976540 7716642 9974224 T = 25664055 M2 8766010 10481006 9036490 y = 2851562 M3 9921506 7466408 6653342 m1 2325513 2572214 3324741 m2 2922003 3493669 3012163 m3 3307169 2488803 2217781 Rj R1 = 2997684 R2 = 1714997 R3 = 3268164 Sj S1 = 14677993215 S2 = 18657924733 S3 = 1954110905333 表 6 L9(34)正交试验表(金丝桃苷)
Table 6. The results of orthogonal experiment (Hyperoside)
试验 因素 金丝桃苷
峰面积A B C 1 1 1 1 477208 2 1 2 2 482219 3 1 3 3 332298 4 2 1 2 553354 5 2 2 3 325225 6 2 3 1 640846 7 3 1 3 402090 8 3 2 1 716723 9 3 3 2 450258 M1 901338 364870 1480455 T = 3378937 M2 1107751 1535964 1187781 y = 375437 M3 1369849 1478104 710701 m1 300446 121623 493485 m2 369250 511988 395927 m3 456616 492701 236900 Rj R1 = 1115586 R2 = 428214 R3 = 767403 Sj S1 = 36756108434 S2 = 290455567127 S3 = 100642735244 表 7 L9(34)正交试验表(鞣花酸)
Table 7. The results of orthogonal experiment (Ellagic acid)
试验 因素 鞣花酸
峰面积A B C 1 1 1 1 2275146 2 1 2 2 1022426 3 1 3 3 716270 4 2 1 2 1485928 5 2 2 3 704427 6 2 3 1 1477116 7 3 1 3 868155 8 3 2 1 1545919 9 3 3 2 1044160 M1 4013842 4629228 5298180 T = 11139544 M2 3667471 3272771 3552514 y = 1237727.1 M3 3458233 3237545 2288851 m1 1337947 1543076 1766060 m2 1222490 1090924 1184171 m3 1152744 1079182 762950 Rj R1 = 428113 R2 = 131567 R3 = 389794 Sj S1 = 52494689151 S2 = 419777559602 S3 = 1522250079819 表 8 L9(34)正交试验表(原儿茶酸)
Table 8. The results of orthogonal experiment (Protocatechuic acid)
试验 因素 原儿茶酸
峰面积A B C 1 1 1 1 477208 2 1 2 2 482219 3 1 3 3 332298 4 2 1 2 553354 5 2 2 3 325225 6 2 3 1 640846 7 3 1 3 402090 8 3 2 1 716723 9 3 3 2 450258 M1 1291724 1432652 1834777 T = 4380219 M2 1519425 1524167 1485830 y = 486691 M3 1569071 1423401 1059613 m1 430575 477551 611592 m2 506475 508056 495277 m3 523024 474467 353204 Rj R1 = 543053 R2 = 38337 R3 = 509458 Sj S1 = 14581556354 S2 = 2068250330 S3 = 100478249341 -
[1] 国家药典委员会. 中华人民共和国药典[S]. 北京: 中国医药出版社, 2020: 126. [2] 罗宏,尹海波. 中药老鹳草的研究[J]. 长春中医药大学学报,2010,26(2):285-286. [3] 车环宇,刘畅,孙仁爽. 老鹳草鞣质体外抗氧化作用研究[J]. 通化师范学院学报,2013,34(10):37-38. doi: 10.3969/j.issn.1008-7974.2013.10.012 [4] 李倩,买吾拉江·阿不都热衣木,徐芳,等. 老鹳草素药理研究进展[J]. 中国中医药信息杂志,2016,23(8):125-128. doi: 10.3969/j.issn.1005-5304.2016.08.034 [5] 王如意,刘纲勇,梁晓欣,等. HPLC法同时测定野老鹳草中5种活性成分的含量[J]. 中国药房,2016,27(21):2972-2975. doi: 10.6039/j.issn.1001-0408.2016.21.29 [6] 谷静逸,尹海波,赵容,等. 辽宁省5种老鹳草中5种活性成分的含量测定[J]. 中国实验方剂学杂志,2016,22(6):26-29. [7] 曹波,尹海波,贾晓晴,等. HPLC 法同时测定3种老鹳草中7种成分[J]. 中成药,2016,38(6):1338-1342. [8] 罗燕平,戚微岩,吴小东,等. 老鹳草素的研究进展[J]. 药物生物技术,2016,23(3):279-282. [9] 江尚飞,潘伦,杨宗发,等. 中药有效成分常用提取新工艺研究进展[J]. 中国药业,2014,23(17):1-3. [10] 王吉华,尹海波. 正交试验法优选老鹳草酚酸类成分的提取工艺[J]. 中药材杂志,2012,35(6):986-989. [11] 刘娟,罗仓学,魏丽娜,等. 地椒总黄酮超声提取工艺优化及抗氧化活性研究[J]. 食品科技,2020,45(1):268-273. [12] 翟豫州,王玉梅,王世杰,等. 正交实验法优化盐地碱蓬中多糖的超声提取工艺[J]. 广东化工,2021,48(15):29-31. [13] 邓莹,刘杰,李香,等. 正交试验法优选玄参中肉桂酸的超声提取工艺[J]. 广东化工,2021,30(20):32-35. [14] 潘娅,郑德俊. 正交试验法优选藤黄酸超声提取工艺[J]. 广东化工,2021,48(2):1-2. [15] 彭华,宋霞,张春. 正交法优化‘胭脂萝卜’红色素超声提取工艺[J]. 中国农学通报,2021,37(27):132-138. -






 下载:
下载: