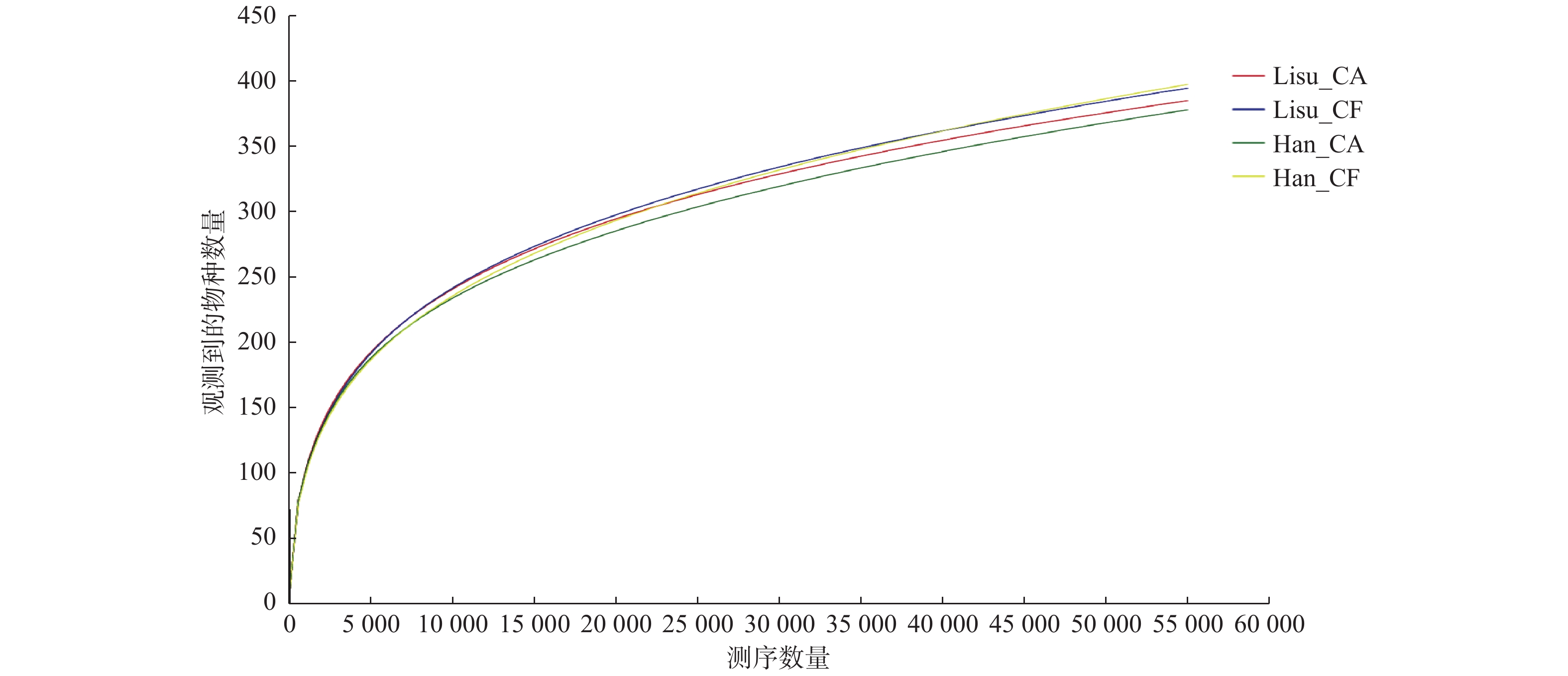
|
[1]
|
Chenicheri S,R U,Ramachandran R,et al. Insight into oral biofilm:Primary,secondary and residual caries and phyto-challenged solutions[J]. Open Dentistry Journal,2017,11(1):312-333. doi: 10.2174/1874210601711010312
|
|
[2]
|
Grigalauskienė R,Slabšinskienė E,Vasiliauskienė I. Biological approach of dental caries management[J]. Stomatologija,2015,17(4):107-112.
|
|
[3]
|
王玉霞,周学东,李明云. 韦荣球菌与龋病和链球菌间的关系[J]. 国际口腔医学杂志,2017,44(2):195-199. doi: 10.7518/gjkq.2017.02.016
|
|
[4]
|
Alazmah A. Early Childhood Caries: A Review[J]. J Contemp Dent Pract,2017,18(8):732-737.
|
|
[5]
|
卢敏,房少华,刘锦桃. 云南16个地区12个民族3~6岁儿童乳牙患龋情况调查分析[J]. 中国妇幼保健,2009,24(1):2.
|
|
[6]
|
唐红萍,杨发斌,杨燕槐,等. 云南省15个特有少数民族1~6岁儿童乳牙龋病调查分析[J]. 牙体牙髓牙周病学杂志,2014,24(7):4.
|
|
[7]
|
Zhang S,Li Y,Liu J,et al. Dental caries status of Lisu preschool children in Yunnan Province,China:a cross-sectional study[J]. BMC Oral Health,2019,19(1):17. doi: 10.1186/s12903-018-0708-y
|
|
[8]
|
Becker M R,Paster B J,Leys E J,et al. Molecular analysis of bacterial species associated with childhood caries.[J]. Journal of Clinical Microbiology,2002,40(3):1001-1009. doi: 10.1128/JCM.40.3.1001-1009.2002
|
|
[9]
|
Zhou X,Li H,Zhu C,et al. Analysis of salivary proteomic biomarkers for the surveillance of changes in high-risk status of early childhood caries[J]. BMC Oral Health,2021,21(1):572. doi: 10.1186/s12903-021-01930-4
|
|
[10]
|
Al-Hebshi N N,Baraniya D,Chen T,et al. Metagenome sequencing-based strain-level and functional characterization of supragingival microbiome associated with dental caries in children[J]. J Oral Microbiol,2018,11(1):1557986.
|
|
[11]
|
Johansson I,Witkowska E,Kaveh B,et al. The microbiome in populations with a low and high prevalence of caries[J]. J Dent Res,2016,95(1):80-86.
|
|
[12]
|
Magana M,Sereti C,Ioannidis A,et al. Options and limitations in clinical investigation of bacterial biofilms[J]. Clin Microbiol Rev,2018,31(3):e00084-16.
|
|
[13]
|
Soriano-Lerma A,Pérez-Carrasco V,Sánchez-Marañón M,et al. Influence of 16S rRNA target region on the outcome of microbiome studies in soil and saliva samples[J]. Sci Rep,2020,10(1):13637. doi: 10.1038/s41598-020-70141-8
|
|
[14]
|
Leake SL,Pagni M,Falquet L,et al. The salivary microbiome for differentiating individuals: proof of principle[J]. Microbes Infect,2016,18(6):399-405.
|
|
[15]
|
Kaczor-Urbanowicz K E,Martin Carreras-Presas C,Aro K,et al. Saliva diagnostics - Current views and directions[J]. Exp Biol Med (Maywood),2017,242(5):459-472. doi: 10.1177/1535370216681550
|
|
[16]
|
Borkent D,Reardon RJM,McLACHLAN G,et al. A microbiome analysis of equine peripheral dental caries using next generation sequencing[J]. Equine Vet J,2020,52(1):67-75.
|
|
[17]
|
Choe R,Sim Y F,Hong C H L,et al. Internalizing problems are associated with oral health-related quality of life in early childhood:Outcomes from an Asian multi-ethnic prospective birth cohort[J]. PLoS One,2021,16(8):e0256163. doi: 10.1371/journal.pone.0256163
|
|
[18]
|
Pang L,Wang K,Tao Y,et al. A new model for caries risk prediction in teenagers using a machine learning algorithm based on environmental and genetic factors[J]. Front Genet,2021,12:636867. doi: 10.3389/fgene.2021.636867
|
|
[19]
|
Du Q,Ren B,He J,et al. Candida albicans promotes tooth decay by inducing oral microbial dysbiosis[J]. ISME J,2021,15(3):894-908. doi: 10.1038/s41396-020-00823-8
|
|
[20]
|
Jiang S,Gao X,Jin L,Lo EC. Salivary microbiome diversity in caries-free and caries-affected children[J]. Int J Mol Sci,2016,17(12):1978. doi: 10.3390/ijms17121978
|
|
[21]
|
Xu H,Tian J,Hao W,et al. Oral microbiome shifts from caries-free to caries-affected status in 3-year-old Chinese children:A longitudinal study[J]. Front Microbiol,2018,9:2009. doi: 10.3389/fmicb.2018.02009
|
|
[22]
|
Xiao C,Ran S,Huang Z,et al. Bacterial diversity and community structure of supragingival plaques in adults with dental health or caries revealed by 16S pyrosequencing[J]. Front Microbiol,2016,7:1145.
|
|
[23]
|
Zhang Y,Huang S,Jia S,et al. The predictive power of saliva electrolytes exceeds that of saliva microbiomes in diagnosing early childhood caries[J]. J Oral Microbiol,2021,13(1):1921486. doi: 10.1080/20002297.2021.1921486
|
|
[24]
|
Conrads G,About I. Pathophysiology of dental caries[J]. Monogr Oral Sci,2018,27:1-10.
|
|
[25]
|
Boisen G,Davies J R,Neilands J. Acid tolerance in early colonizers of oral biofilms[J]. BMC Microbiol,2021,21(1):45. doi: 10.1186/s12866-021-02089-2
|
|
[26]
|
Chen W,Jiang Q,Yan G,Yang D. The oral microbiome and salivary proteins influence caries in children aged 6 to 8 years[J]. BMC Oral Health,2020,20(1):295. doi: 10.1186/s12903-020-01262-9
|
|
[27]
|
Li Y,Zou C G,Fu Y,et al. Oral microbial community typing of caries and pigment in primary dentition[J]. Bmc Genomics,2016,17(1):558. doi: 10.1186/s12864-016-2891-z
|
|
[28]
|
Zhang Y,Zhu C,Feng X,Chen X. Microbiome variations in preschool children with halitosis[J]. Oral Dis,2021,27(4):1059-1068. doi: 10.1111/odi.13603
|
|
[29]
|
Belotserkovsky I,Sansonetti P J. Shigella and Enteroinvasive Escherichia Coli[J]. Curr Top Microbiol Immunol,2018,416:1-26.
|





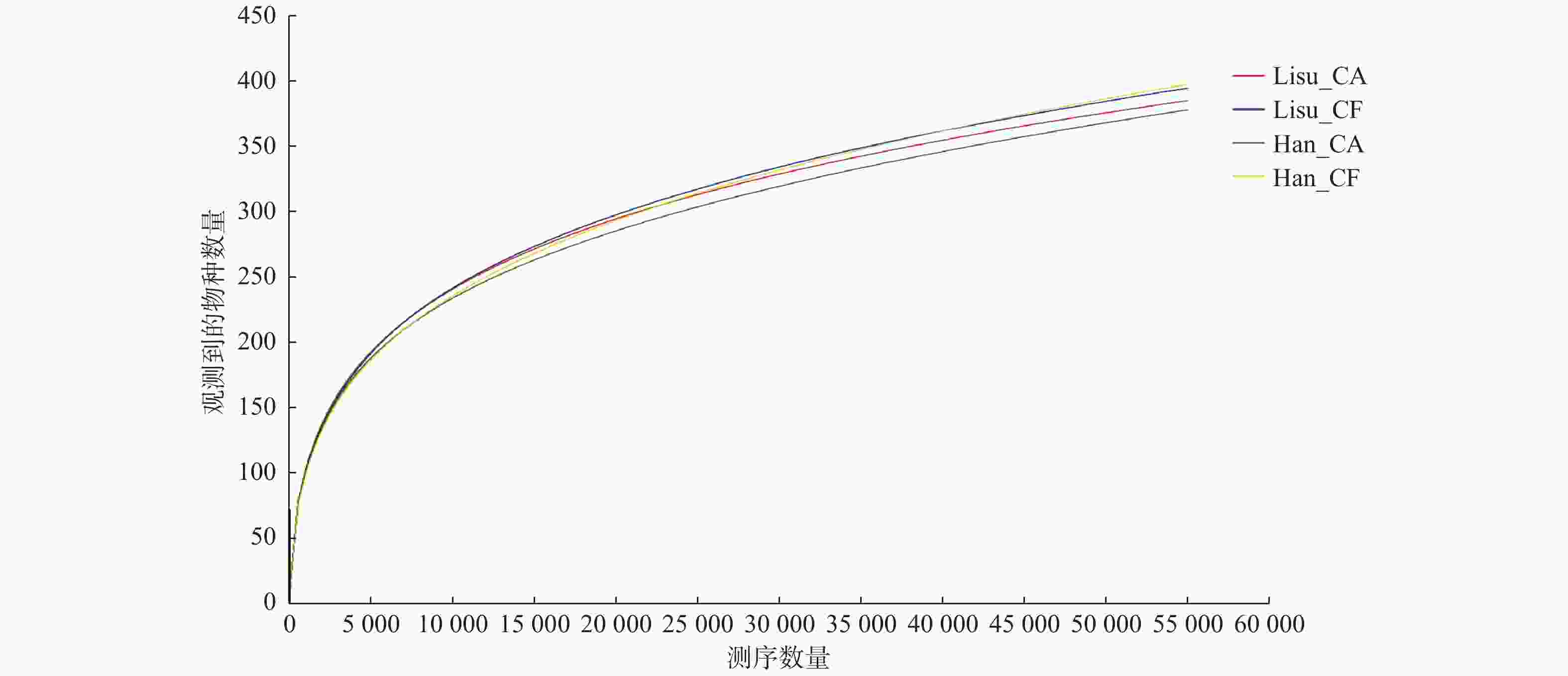
 下载:
下载: