The Relationship Between T950C Polymorphism in the Promoter Region of Osteoprotegerin Gene and Type 2 Diabetes with Osteoporosis
-
摘要:
目的 探讨护骨素(OPG)基因启动子区T950C的多态性与2型糖尿病(T2DM)合并骨质疏松症的关系,了解T2DM合并骨质疏松症与遗传相关的易感基因。 方法 (1)使用聚合酶链反应技术,检测T2DM不合并骨质疏松组(A组),T2DM合并骨量减少组(B组),T2DM合并骨质疏松组(C组),OPG基因T950C的基因型,分别分析3组的OPG基因T950C多态性;(2)比较3组人群性别、体重指数、年龄、血压、体重、糖化血红蛋白、身高、血脂、空腹血糖、睾酮、雌激素、维生素D等临床指标;(3)比较OPG基因T950C的基因型间不同部位的骨密度差异;(4)通过Logistic回归分析了解T2DM合并骨质疏松患者的独立危险因素。 结果 (1)TC型是T2DM和T2DM合并骨质疏松症人群OPG基因T950C的主要基因型;(2)3组OPG基因T950C基因型的频率及等位基因频率的差异均无统计学意义(P > 0.05);(3)3组患者体重、年龄、身高、BMI、比较,差异有统计学意义( P < 0.05),且各组间相互比较,差异有统计学意义( P < 0.05);(4)OPG基因T950C的3种基因型比较,各部位的骨密度均无差异( P > 0.05);(5)回归分析显示:年龄、吸烟可进入回归方程,而OPGOPG基因T950C的基因型未进入回归方程。 结论 (1)TC型是T2DM和T2DM合并骨质疏松症患者OPG基因T950C的主要基因型;(2)OPG基因T950C的基因型可能不是T2DM及T2DM合并骨质疏松症的易感基因;(3)吸烟和年龄是T2DM合并骨质疏松患者的独立危险因素。 -
关键词:
- 护骨素(OPG) /
- 基因启动子区T950C /
- 多态性 /
- 2型糖尿病 /
- 骨质疏松症
Abstract:Objective To investigate the relationship between T950C polymorphism in the promoter region of osteoprotegerin (OPG) gene and type 2 diabetes mellitus (T2DM) complicated with osteoporosis, and to understand the genetically related susceptibility genes of T2DM complicated with osteoporosis. Methods (1) Using polymerase chain reaction technology, the T2DM without osteoporosis group (group A), the T2DM with osteopenia group (B group), the T2DM with osteoporosis group (C group), the OPG gene T950C group were detected. Genotype, the OPG gene T950C polymorphism in the three groups was analyzed respectively; (2) Gender, body mass index, age, blood pressure, weight, glycated hemoglobin, height, blood lipids, fasting blood glucose, testosterone, estrogen, vitamin D were compared among the three groups. (3) The differences in bone mineral density was compared between different parts of the OPG gene T950C genotype; (4) The independent risk factors of T2DM patients with osteoporosis was learned through logistic regression analysis. Results (1) TC type was the main genotype of OPG gene T950C in T2DM and T2DM patients with osteoporosis; (2) There was no significant difference in the genotype frequency and allele frequency of OPG gene T950C among the three groups (P > 0.05); (3) The weight, age, height, BMI, and BMI of the three groups of patients were compared, the difference was statistically significant ( P < 0.05), and the differences among the groups were statistically significant ( P < 0.05); ( 4) Comparison of the three genotypes of the OPG gene T950C, there was no difference in the bone mineral density of each part ( P > 0.05); (5) Regression analysis showed that age and smoking entered the regression equation, but the genotype of the OPGOPG gene T950C did not enter regression equation. Conclusions (1) TC type is the main genotype of OPG gene T950C in T2DM and T2DM patients with osteoporosis; (2) The genotype of OPG gene T950C may not be a susceptibility gene for T2DM and T2DM combined with osteoporosis; (3) Smoking and age are independent risk factors of T2DM combined with osteoporosis. -
Key words:
- Osteoprotegerin (OPG) /
- Gene promoter region T950C /
- Polymorphism /
- Type 2 diabetic /
- Osteoporosis
-
表 1 DNA提取所需试剂及仪器
Table 1. DNA extraction reagent and instrument
试剂及仪器 来源 DNA提取试剂盒 AXYGEN公司 TaqDNA聚合酶(5 U/UL) 大连生物工程公司 引物 由昆明硕擎公司提供 PCR仪 由美国应用生物系统公司提供(型号为 ABI2720) 其他:Eppendorf管、电泳仪、恒温水浴箱、
琼脂糖由NSET公司提供 表 2 3组人群的一般资料比较[( $ \bar x \pm s $)/M(P25,P75)]
Table 2. Comparison of general data of three groups[( $ \bar x \pm s $)/M(P25,P75)]
指标 A组(n=61) B组(n=111) C组(n=65) x2/F/Z P 年龄(岁) 61.65 ± 8.16 64.79 ± 10.15# 66.33 ± 6.77# & 4.573 0.011* 性别(男/女)) 46/15 61/50 # 15/50# & 18.286 < 0.001 * 舒张压(mmHg) 80.77 ± 11.51 78.64 ± 10.27 74.97 ± 12.30# 4.364 0.014* 吸烟(是/否) 24/37 32/79 11/54# 7.833 0.020* 饮酒(是/否) 17/44 29/82 6/59# & 8.518 0.014* 身高(m) 167.64 ± 7.32 164.12 ± 8.04# 158.13 ± 7.21#& 24.880 < 0.001 * 体重(kg) 71.02 ± 11.16 65.85 ± 9.94# 59.07 ± 10.45#& 20.955 < 0.001 * 体重指数(kg/m2) 25.26 ± 2.77 24.29 ± 2.75# 23.40 ± 3.21# 6.369 0.002* HDLC(mmol/L) 1.09 ± 0.34 1.15 ± 0.28 1.23 ± 0.31# 3.410 0.035* 雌激素
(pmol/L)116.90(80.73,152.44) 90.42(60.97,140.19) 81.12(58.63,98.22 )# −1.949 0.041* 睾酮(nmol/L) 9.13(1.94,14.85 ) 5.17(1.32,12.09 ) 1.57(1.17,2.38 )#& −2.281 0.023* P* < 0.05;两两比较:与A组比较, #P < 0.05;与B组比较, &P < 0.05。 表 3 OPG基因T950C基因型的分布频率比较[n(%)]
Table 3. OPG gene T950C genotypes distribution frequency comparison [n(%)]
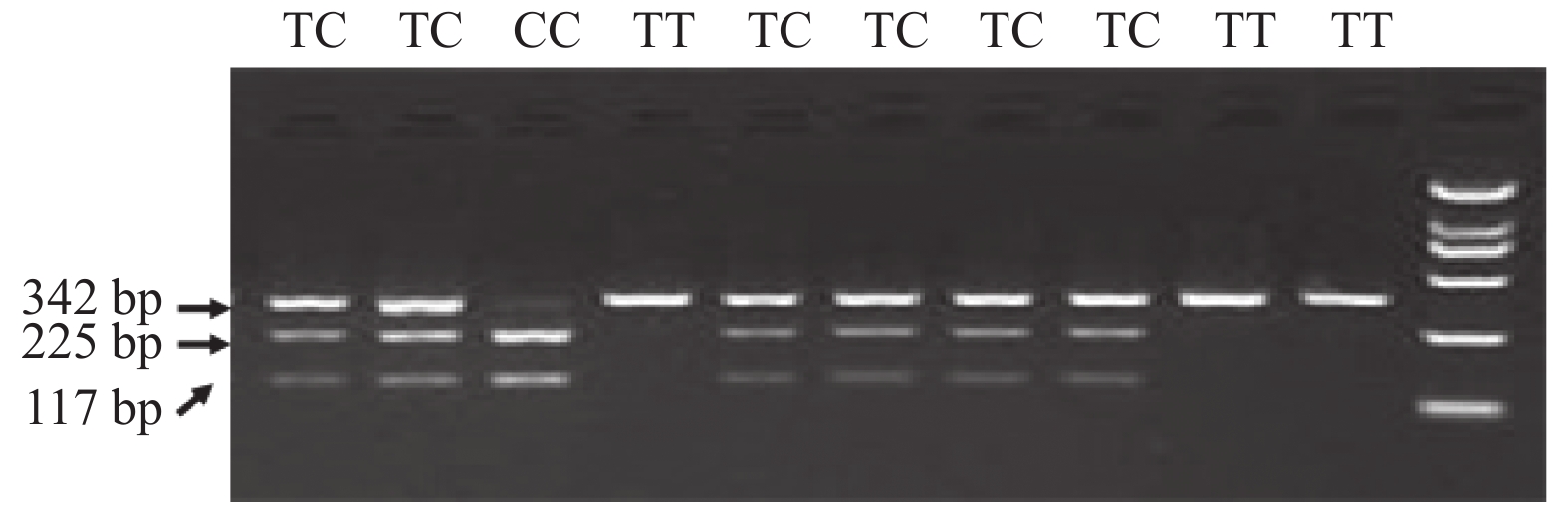
组别 TT TC CC 合计(n) A组 21(34.4 ) 32(52.5) 8(13.1) 61 B组 37(33.3 ) 57(51.7) 17(15.3) 111 C组 13(19.6) 36(55.4) 16(24.6) 65 合计(n) 71 125 41 237 注:χ2 = 5.989,P = 0.200。 表 4 OPG基因T950C等位基因分布频率
Table 4. OPG gene T950C allele frequency distribution
组别 频数 T C A组 122 74 48 B组 222 131 91 C组 130 62 68 注:χ2 = 5.519,P = 0.063。 表 5 OPG基因T950C基因多态性和T2DM患者骨密度的关系(g/cm2)
Table 5. The relationship between the OPGgeneT950C gene polymorphism and BMD of T2DM patients (g/cm2)
指标 TT 组(n=71) TC组(n=125) CC组(n=41) F/Z P 腰1 0.952 ± 0.161 0.944 ± 0.166 0.887 ± 0.155 1.521 0.222 腰2 1.034 ± 0.187 1.021 ± 0.188 0.937 ± 0.171 2.371 0.097 腰3 1.081 ± 0.206 1.066 ± 0.197 0.977 ± 0.171 2.639 0.075 腰4 1.113 ± 0.215 1.082 ± 0.181 1.022 ± 0.226 1.763 0.175 左股骨颈 0.885 ± 0.194 0.873 ± 0.193 0.805 ± 0.158 1.582 0.209 左大粗隆 0.774 ± 0.154 0.759 ± 0.167 0.684 ± 0.142 2.779 0.065 左全髋 0.965 ± 0.150 0.912 ± 0.268 0.870 ± 0.135 1.514 0.224 右股骨颈 0.884 ± 0.156 0.835 ± 0.353 0.773 ± 0.206 1.273 0.283 右大粗隆 0.775 ± 0.149 0.726 ± 0.294 0.659 ± 0.184 1.909 0.152 右全髋 0.959(0.863,1.085) 0.912(0.801,1.043) 0.859(0.721,0.951) 1.096 0.295 表 6 Logistic多因素分析结果
Table 6. Logistic analysis results
因素 B P OR值 95%CI OPG-T950C 0.285 0.435 1.330 0.650~2.820 年龄 0.103 0.004 1.108 1.033~1.188 性别 0.364 0.696 1.439 0.231~8.947 舒张压 0.005 0.831 1.005 0.963~1.049 吸烟 2.1.03 0.021 8.190 1.368~49.053 饮酒 −0.990 0.239 0.372 0.071~1.933 身高 −0.084 0.251 0.919 0.797~1.061 体重 −0.017 0.814 0.983 0.854~1.132 体重指数 −0.106 0.607 0.900 0.602~1.345 HDL-C 0.500 0.570 1.648 0.293~9.265 雌激素 0.001 0.819 0.999 0.993~1.005 睾酮 −0.117 0.081 0.889 0.7779~1.015 -
[1] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J]. 中华糖尿病杂志,2021,13(4):315-409. [2] 中华医学会骨质疏松和骨矿盐疾病分会. 中国骨质疏松症流行病学调查及"健康骨骼" 专项行动结果发布[J]. 中华骨质疏松和骨矿盐疾病杂志,2019,12(4):317-318. doi: 10.3969/j.issn.1674-2591.2019.04.001 [3] Rakel A,Sheehy O,Rahme E,LeLorier J. Osteoporosis among patients with type 1 and type 2 daibetes[J]. Diabetes Metabolism,2008,34(2):193-205. doi: 10.1016/j.diabet.2007.10.008 [4] Franke S,Siggelkow H,Wolf G,et al. Advanced glycation endproducts influence the Mrna expression of RAGE,RANKL and various osteoblastic genes in humanosteoblasts[J]. Arch Physiol Biochen,2007,113(3):154-161. doi: 10.1080/13813450701602523 [5] Botolin S,McCabe L R. Chronic hyperglycemia modulates osteoblast gene expression through osmotic and non-osmotic pathways[J]. J Cell Biochem,2006,99(2):411-417. doi: 10.1002/jcb.20842 [6] GordonGong,Gleb Haynatzki,Vera Haynatzka,et al. Bone miberal density-affecting denes in Africans[J]. J The National Medical Association,2006,98(7):1102-1108. [7] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南[J]. 中国糖尿病杂志,2018,10(1):4-67. [8] 中华医学会骨质疏松和骨矿盐分会. 原发性骨质疏松症诊治指南[J]. 中华骨质疏松和骨矿盐疾病杂志,2017,10(5):413-433. [9] 中华中医药学会糖尿病分会. 糖尿病合并骨质疏松中医诊疗标准[J]. 世界中西医结合杂志,2011,6(3):265-269. doi: 10.3969/j.issn.1673-6613.2011.03.033 [10] Vestergard P. Discrepancies in bone mineral density and fracture risk in patients with type 1 and type 2 diabetes -a meta-analysis[J]. Osteoporosis Int,2007,18(2):427-444. [11] Botolin S, McCabe L R. Chronic hyperglycemia modulates osteoblast gene expression through osmotic and non-osmotic pathways[J]. J Cell Biochem, 2006, 99(10): 411-417. [12] 曹国磊, 王思瑶, 李思源, 等. 老年男性2型糖尿病患者骨密度情况及相关影响因素, 中国老年学杂志, 2017, 2(37): 612-613. [13] Zhu G Y,Wang H F,Shi Y X,et al. Environmengt eadmium exposure and forearm bone density[J]. Biometals,2007,17(5):499-503. [14] Akesson A,Bjiellerup P,Lundh T,et al. Cadmium-induced effects on bone in a population-based study of women[J]. Environ Health Per-spect,2006,114(6):830-834. doi: 10.1289/ehp.8763 [15] 赵金秀,周学瀛,刘国仰,等. 北京地区汉族人维生素D受体基因多态性分布[J]. 中国医学科学院学报,1997,19(1):18. [16] Arko B,Prezelj J,Komel R,et al. Sequence variations in theosteoprotegrin gene promoter in patients with postmenopausalosteoporosis[J]. J Clin Endocrinol Metab,2002,87(9):4080. [17] Zajícková K,Zemanová A,Hill M,et al. Is A163G polymorphism in theosteoprotegerin gene associated with heel velocity of sound inpostmenopausal women?[J]. Physiol Res,2008,57(Suppl 1):S153-S157. [18] Knudsen S T,Jeppesen P,Poulsen P L,et al. Plasma concentrations ofosteoprotegerin during normo-and hyperglycaemicclamping[J]. Seand J Clin Lab Invest,2007,67(2):135-142. [19] Suzuki K,Kurose T,Takizawa M,et al. Osteoclastic function is accelerated in male patients with type 2 diabetes mellitus:the preventive role of osteoclastogenesis inhibitory factor/osteoprotegerin (OCIF/OPG) on the decrease of bone mineral density[J]. Diabetes Res Clin Pract,2005,68(2):117-125. [20] 郑蓉, 苗懿德, 纪立农等, 中国组织工程研究与临床康复[J]. 2011, 15(28): 5292-5294. [21] 刘杰,苗懿德,张育军,等. 绝经后妇女护骨素基因启动子区T950C基因多态性与骨密度的关系研究[J]. 中国骨质疏松杂志,2021,16(3):184-187. [22] 武兆忠,刘敏,冯鉴强. 护骨素基因启动子区T950-C多态性与骨密度及骨代谢的关系[J]. 中国老年学杂志,2005,25(3):247-250. doi: 10.3969/j.issn.1005-9202.2005.03.007 [23] 刘宇鹏. 骨保护素基因多态性及骨质疏松型骨折的研究[D]. 大连: 大连理工大学博士学位论文, 2016. [24] Garciaunzueta M T,Riancho J A,Zarrabeitia M T,et al. Association of the 163A/G and 118G/C osteoprotegerin polymorphism with bone mineral density[J]. Hormone & Metabolic Research,2008,40(3):219-224. [25] Moffett S P,Oakley J I,Cauley J A,eta1. Osteoprotegerin Lys3Asn polymorphism and the riskof fracture in older women.[J]. Journal of Clinical Endocrinology & Metabolism,2008,93(5):2002-2008. [26] Tothill P,Laskey M C,Van W M. Anomalies in dual energy X-ray absorptiometry measurements of total—body bone mineral during weight change using Lunar. Hologic and Norland instruments.[J]. British Journal of Radiology,1999,72(859):661-669. doi: 10.1259/bjr.72.859.10624323 [27] Woo J,Kim Y,Lee C. Heterogeneous genetic associations of nucleotide sequence variants with bone mineral density by gender[J]. Molecular Biology Reports,2012,39(3):2259-2265. doi: 10.1007/s11033-011-0975-z [28] Zhao H Y,Liu J M,Ning G,et a1. The influence of Lys3Asn Polymorphism in the osteoprotegerin gene on bone mineral density in Chinese postmenopausal women[J]. Osteoporosis International,2005,16(12):1519-1524. doi: 10.1007/s00198-005-1865-9 -






 下载:
下载: