Effect of Hematopoietic Function Recovery and MRD Status after Induction Chemotherapy on the Prognosis of Patients with Newly Diagnosed Acute Myeloid Leukemia
-
摘要:
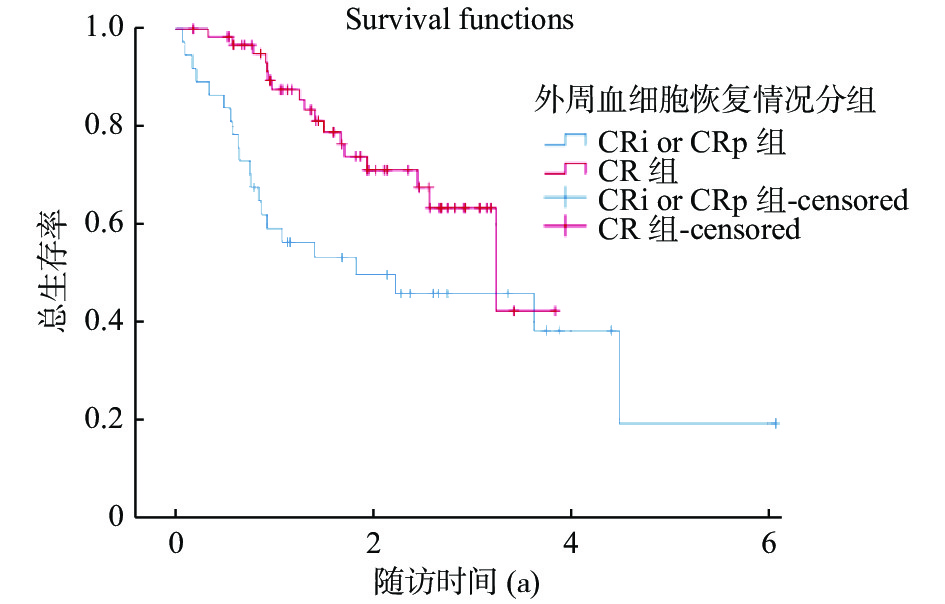
目的 探讨诱导化疗后造血功能的恢复情况和MRD状态在对AML预后的影响。 方法 回顾性分析2017年1月至2020年12月昆明医科大学第二附属医院血液内科初诊的100例急性髓系白血病患者的临床资料。对比分析了形态学完全缓解时外周血血细胞计数完全恢复组(CR)与未完全恢复组(CRi or CRp)患者临床特征的差异性及2组患者OS和EFS的差异;及其对比分析了诱导治疗后第28天血小板完全恢复组(PLT≥300×109/L)与未完全恢复组(PLT < 300×109/L)2组患者OS和EFS的差异。采用Cox回归分析影响预后的危险因素。采用独立样本t检验和Pearson卡方检验或Mann-Whitney检验评估各种参数的差异性,Kaplan-Meier法及Cox回归进行生存分析。 结果 中位随访时间为1.6(0.9,2.6)a,CR组与CRp or CRi组组间比较显示:2组患者在形态学缓解时MRD状态、预后基因(NPM1、FLT3-ITD、C-KIT、CEBPA)、预后存在统计学差异(P < 0.05);形态学缓解时外周血细胞计数恢复不完全的AML患者预示着更差的结局,其中未完全恢复组(CRi or CRp)组与完全恢复组(CR)比较,总体生存时间(OS)明显缩短(3.2 a VS 1.8 a,P = 0.016);和无进展生存期(EFS)也明显缩短(未达到 VS 1.2 a,P = 0.041)。诱导治疗第28天血小板未完全恢复组(PLT < 300×109/L)与血小板计数完全恢复组(PLT≥300×109/L)相比,总体生存时间(OS)明显缩短(5.2 a VS 2.5 a,P = 0.001);EFS也缩短(3.2 a VS 2.7 a,P = 0.237)。Cox回归分析显示:第28天血小板恢复情况、形态学缓解时MRD状态是影响AML患者预后的独立危险因素。 结论 对于初诊的AML患者,诱导化疗后的造血功能再生,特别是血小板的恢复,是AML患者预后的重要预测因子。尽管造血功能恢复情况与MRD状态是相关的,但2者都是AML患者复发、OS和EFS的独立预后因素。 Abstract:Objective To investigate the recovery of hematopoietic function after the induction chemotherapy and the effect of MRD status on the prognosis of AML by analyzing retrospectively the clinical data of 100 newly diagnosed AML patients. Methods The clinical data of 100 patients with acute myeloid leukemia initially diagnosed in the Department of Hematology of the Second Affiliated Hospital of Kunming Medical University from January 2017 to March 2021 were retrospectively analyzed. The differences of clinical characteristics between complete recovery group (CR) and incomplete recovery group (CRi or CRp) and the differences of OS and EFS between the two groups were compared and analyzed. Cox regression was used to analyze the risk factors affecting the prognosis. The difference of OS and EFS between the platelet complete recovery group (PLT ≥ 300×109 / L) and the incomplete recovery group (PLT < 300×109 / L) on the 28th day after the induction treatment was compared and analyzed. The differences of various parameters were evaluated by independent sample t-test, Pearson chi-square test or Mann-Whitney test. Kaplan-Meier method and Cox regression were used for survival analysis. Results The median follow-up time was 1.6 (0.9, 2.6) a. The comparison between CR group and CRp or CRi group showed that there were significant differences in MRD status, prognostic genes (NPM1, FLT3-ITD, C-KIT, CEBPA) and prognosis between the two groups (P < 0.05); AML patients with incomplete recovery of peripheral blood cell count during the morphological remission predicted worse outcomes. The overall survival time (OS) in the incomplete recovery group (CRi or CRp) was significantly shorter than that in the complete recovery group (CR) (3.2 a VS 1.8 a, P = 0.016); And the progression free survival (EFS) was also significantly shortened (less than 1.2 a, P = 0.041). On the 28th day of the induction treatment, the overall survival (OS) of incomplete platelet recovery group (PLT < 300×109 / L) was significantly shorter than that of complete platelet recovery group (PLT ≥ 300 ×109 / L) (5.2 a vs 2.5 a, P = 0.001); EFS was also shortened (3.2 a VS 2.7 a, P = 0.237). Cox regression analysis showed that platelet recovery on day 28 and MRD status in morphological remission were independent risk factors affecting the prognosis of AML patients. Conclusion For newly diagnosed AML patients, hematopoietic regeneration after the induction chemotherapy, especially the recovery of platelets, is an important predictor of the prognosis of AML patients. Although hematopoietic recovery and MRD status are related, both are independent prognostic factors for recurrence, OS and EFS in patients with AML. -
Key words:
- Acute myeloid leukemia /
- Hematopoietic function recovery /
- Platelets on day 28 /
- MRD status /
- Prognosis
-
表 1 CR与CRp or CRi 2组相关临床特征之间的差异n(%)
Table 1. Differences in relevant clinical features between CR and CRp or CRi groups n(%)
因素 CR组(n = 63) CRi or CRp组(n = 37) χ2 P 年龄(岁) 48(36,60) 49(35,60) 0.100 0.920 性别 0.131 0.718 男 33(52.4) 18(48.6) 女 30(47.6) 19(51.4) 体能评分 9.843 0.002* PS(0~1分) 31(49.2) 6(16.2) PS(2~4分) 32(50.8) 31(83.8) 细胞遗传学风险 5.517 0.019* 预后良好或中等 44(69.8) 17(45.9) 预后不良 19(30.2) 20(54.1) 形态学缓解时MRD 34.602 < 0.001* MRD阳性 15(23.8) 23(62.2) MRD阴性 48(76.2) 14(37.8) 融合基因突变 NPM1+ 33(52.4) 9(24.3) 8.060 0.005* FLT3-ITD+ 25(39.7) 25(67.6) 7.511 0.006* C-KIT+ 17(27) 27(73) 20.443 < 0.001* CEBPA+ 36(57.1) 8(21.6) 10.691 0.001* *P < 0.05。 表 2 单因素Cox回归分析
Table 2. Univariate Cox regression analysis
因素 HR 95%CI P 男性 2.333 1.173~4.639 0.056 年龄≥60岁 2.104 1.050~4.217 0.036* WBC≥30×109/L 0.142 0.018~1.090 0.061 LYM< 0.8×109/L 2.066 0.974~4.383 0.059 PLT< 100×109/L 1.601 0.621~4.127 0.330 PS≥2分 3.892 1.515~9.996 0.005* 预后不良核型 40.588 9.739~169.152 < 0.001* 治疗反应(CRp or CRi) 2.206 1.134~4.291 0.020* 第28天PLT< 300×109/L 3.913 1.627~9.415 0.002* 形态学缓解时MRD+ 4.488 2.200~9.159 < 0.001* *P < 0.05。 表 3 多因素Cox回归分析
Table 3. Multivariate Cox regression analysis
因素 HR 95%CI P 年龄≥60岁 1.690 0.784~3.641 0.180 PS≥2分 3.167 0.944~10.627 0.062 治疗反应(CRp or CRi) 1.060 0.512~2.192 0.876 第28天PLT< 300×109/L 3.436 1.394~8.470 0.007* 形态学缓解时MRD+ 3.384 1.547~7.400 0.002* *P < 0.05。 -
[1] Walter R B,Kantarjian H M,Huang X,et al. Effect of complete remission and responses less than complete re- mission on survival in acute myeloid leukemia[J]. J Clin Oncol,2010,28(10):1766-1771. [2] Keating M J,Smith T L,Gehan E A,et al. Factors related to length of complete remission in adult acute leukemia[J]. Cancer,1980,45(8):2017-2029. doi: 10.1002/1097-0142(19800415)45:8<2017::AID-CNCR2820450806>3.0.CO;2-C [3] Othus M W B S D. Effect of measurable minimal residual disease (MRD) information on prediction of relapse and survival in adult acute myeloid leukemia[J]. Leukemia,2016,10(30):2080-2093. [4] Walter R B,Ofran Y,Wierzbowska A,et al. Measurable residual disease as a biomarker in acute myeloid leukemia:Theoretical and practical considerations[J]. Leukemia,2021,35(6):1529-1538. doi: 10.1038/s41375-021-01230-4 [5] K P. Incorporating measurable minimal residual disease directed treatment strategies to optimize outcomes in adults with acute myeloid leukemia[J]. Leukemia & Lymphoma,2016,57(7):1527-1533. [6] 金洁. 急性髓系白血病(复发难治性)中国诊疗指南(2011年版)[J]. 中华血液学杂志,2011,32(12):887-888. doi: 10.3760/cma.j.issn.0253-2727.2011.12.023 [7] Dohner H E E A S. Diagnosis and management of acute myeloid leukemia in adults:Recommendations from an international expert panel,on behalf of the European LeukemiaNet[J]. Blood,2017,129(4):424-447. doi: 10.1182/blood-2016-08-733196 [8] Grimwade D W H O F. The importance of diagnostic cytogenetics on outcome in AML:Analysis of 1,612 patients entered into the MRC AML 10 trial–The Medical Research Council Adult and Children’s Leukaemia Working Parties[J]. Blood,1998,92(7):2322-2333. doi: 10.1182/blood.V92.7.2322 [9] Grimwade D,Hills R K. Independent prognostic factors for AML outcome[J]. Hematology Am Soc Hematol Educ Program,2009,10(1):385-395. [10] Creutzig U,Kaspers G J. Revised recommendations of the International Working Group for diagnosis,standardization of response criteria,treatment outcomes,and reporting standards for therapeutic trials in acute myeloid leukemia[J]. J Clin Oncol,2004,22(16):3432-3433. doi: 10.1200/JCO.2004.99.116 [11] Etsuko Yamazaki H K. Hyper-recovery of platelets after induction therapy is a predictor of relapse-free survival in acute myeloid leukemia[J]. Leukemia & Lymphoma,2016,58(1):104-109. [12] Chen,X,Xie,H,Wood,B L,et al. Relation of clinical response and minimal residual disease and their prognostic impact on outcome in acute myeloid leukemia[J]. J Clin Oncol,2015,11(33):1258-1264. [13] Nishimura C D,Brenner D A,Mukherjee M,et al. c-MPL provides tumor-targeted T-cell receptor-transgenic T cells with costimulation and cytokine signals[J]. Blood,2017,130(25):2739-2749. [14] Miraki-Moud F A F. Acute myeloid leukemia does not deplete normal hematopoietic stem cells but induces cytopenias by impeding their differentiation[J]. Proc Natl Acad Sci USA,2013,110(33):13576-13581. doi: 10.1073/pnas.1301891110 [15] Kern W H T. Early blast clearance by remission induction therapy is a major independent prognostic factor for both achievement of complete remission and long-term outcome in acute myeloid leukemia:Data from the German AML Cooperative Group (AMLCG) 1992 Trial[J]. Blood,2003,101(1):64-70. doi: 10.1182/blood-2002-02-0532 [16] Malkan U Y,Gunes G,Isik A,et al. Rebound thrombocytosis following induction chemotherapy is an independent predictor of a good prognosis in acute myeloid leukemia patients attaining first complete remission[J]. Acta Haematol,2015,134(1):32-37. [17] Elliott M A,Litzow M R,Letendre L L,et al. Early peripheral blood blast clearance during induction chemotherapy for acute myeloid leukemia predicts superior relapse-free survival[J]. Blood,2007,110(13):4172-4174. [18] Creutzig U,Zimmermann M,Dworzak M N,et al. The prognostic significance of early treatment response in pediatric relapsed acute myeloid leukemia[J]. Haematologica,2014,99(9):1472-1478. -






 下载:
下载: