Luteolin Inhibits HASMCs Migration by Endoplasmic Reticulum Stress
-
摘要:
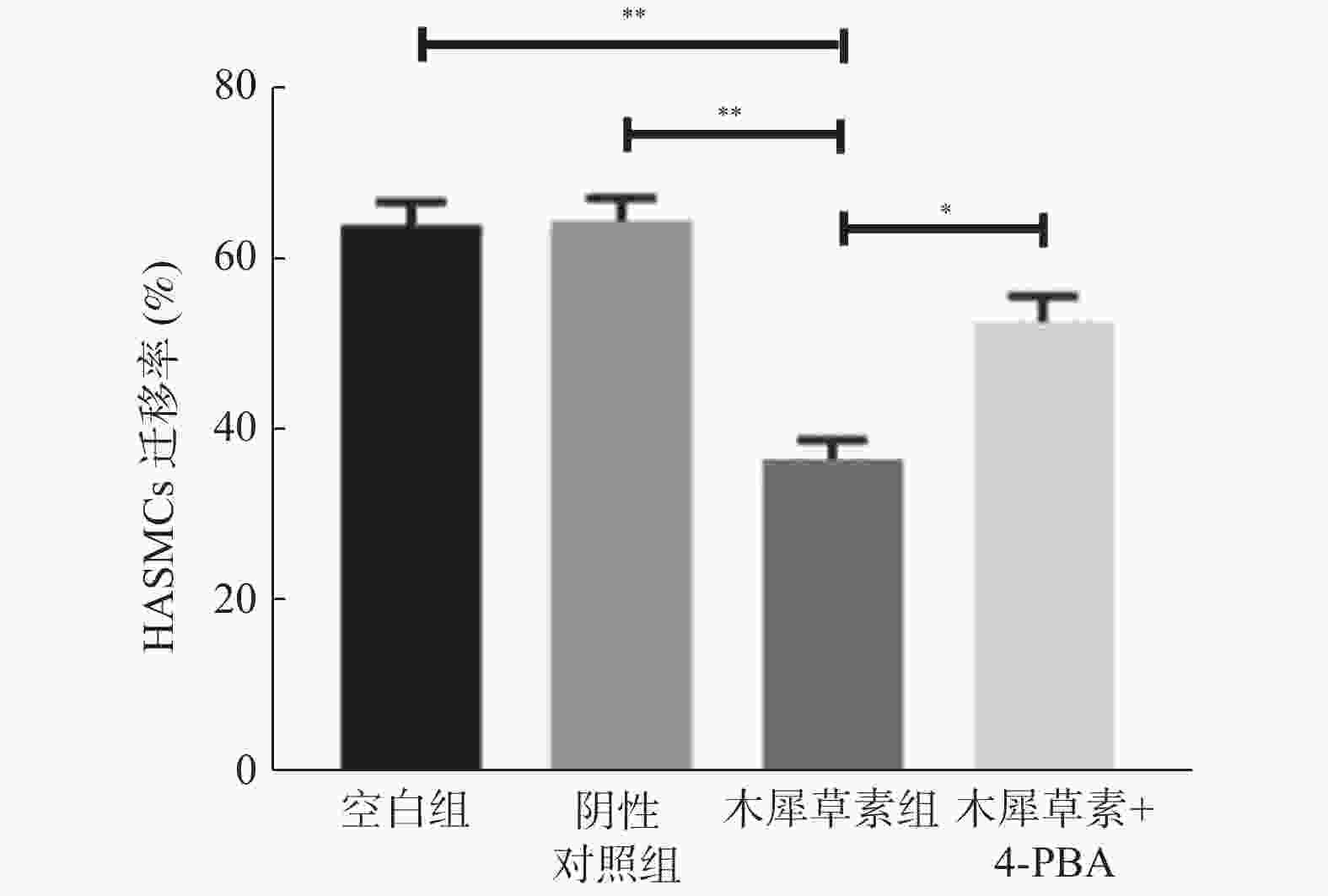
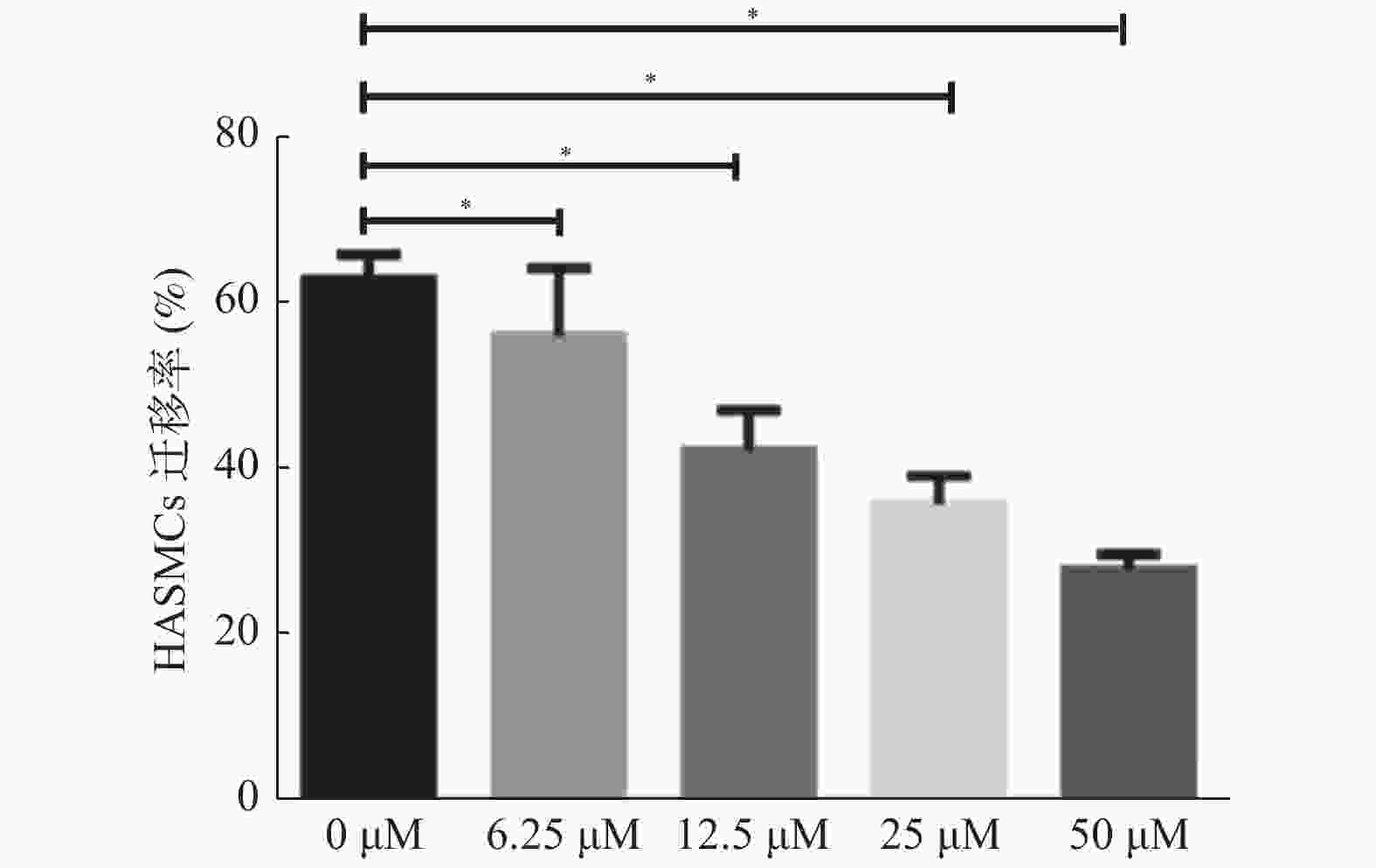
目的 研究木犀草素对人主动脉平滑肌细胞迁移的调控作用,并探讨其调控作用是否通过激活内质网应激途径实现。 方法 体外培养人主动脉平滑肌细胞,分为空白对照组(不做任何处理,BC)、阴性对照组(加等量无关试剂,NC)、木犀草素组(25 μmol/L处理)、木犀草素+4-苯基丁酸钠共处理组(4-苯基丁酸钠预处理后加入等量木犀草素),于12h小时后细胞划痕实验法检测人主动脉平滑肌细胞迁移情况,Western blot和RT-qPCR检测BIP、CHOP蛋白及RNA表达水平。 结果 (1)与空白对照组和阴性对照组相比,木犀草素组细胞迁移水平明显降低,BIP、CHOP表达水平明显增高;(2)与木犀草素组相比,木犀草素+4-苯基丁酸钠共处理组细胞迁移水平增强,同时BIP、CHOP表达水平降低。 结论 木犀草素通过上调内质网应激抑制人主动脉平滑肌细胞的迁移。 Abstract:Objective To investigate the regulatory effect and mechanism of luteolin on the migration of human aortic smooth muscle cells (HASMCs). Methods HASMCs were cultured in vitro and divided into the blank control group (without any treatment, BC), the negative control group (with the same amount of irrelevant reagent, NC), the luteolin group (25 μmol/L treatment, LUT) and the luteolin+4-PBA treatment group (with the same amout of luteolin added after 4-PBA pretreatment, 4-PBA). Cell scratch test was used to detect the HASMCs migration after 12hs. The expression level of BIP and CHOP about endoplasmic reticulum stress were detected by RT-qPCR and Western blot. Results (1) Compared to the BC and NC groups, the cell migration level in the LUT group was significantly reduced, and the expression levels of BIP and CHOP were significantly increased. (2) Compared with the LUT group, the cell migration level of the luteolin+4-PBA co-teatment group increased, while the expression levels of BIP and CHOP decreased. Conclusion Luteolin inhibits HASMCs migration by promoting the endoplasmic reticulum stress. -
Key words:
- Luteolin /
- Endoplasmic Reticulum stress /
- Human aortic smooth muscle cells /
- Migration
-
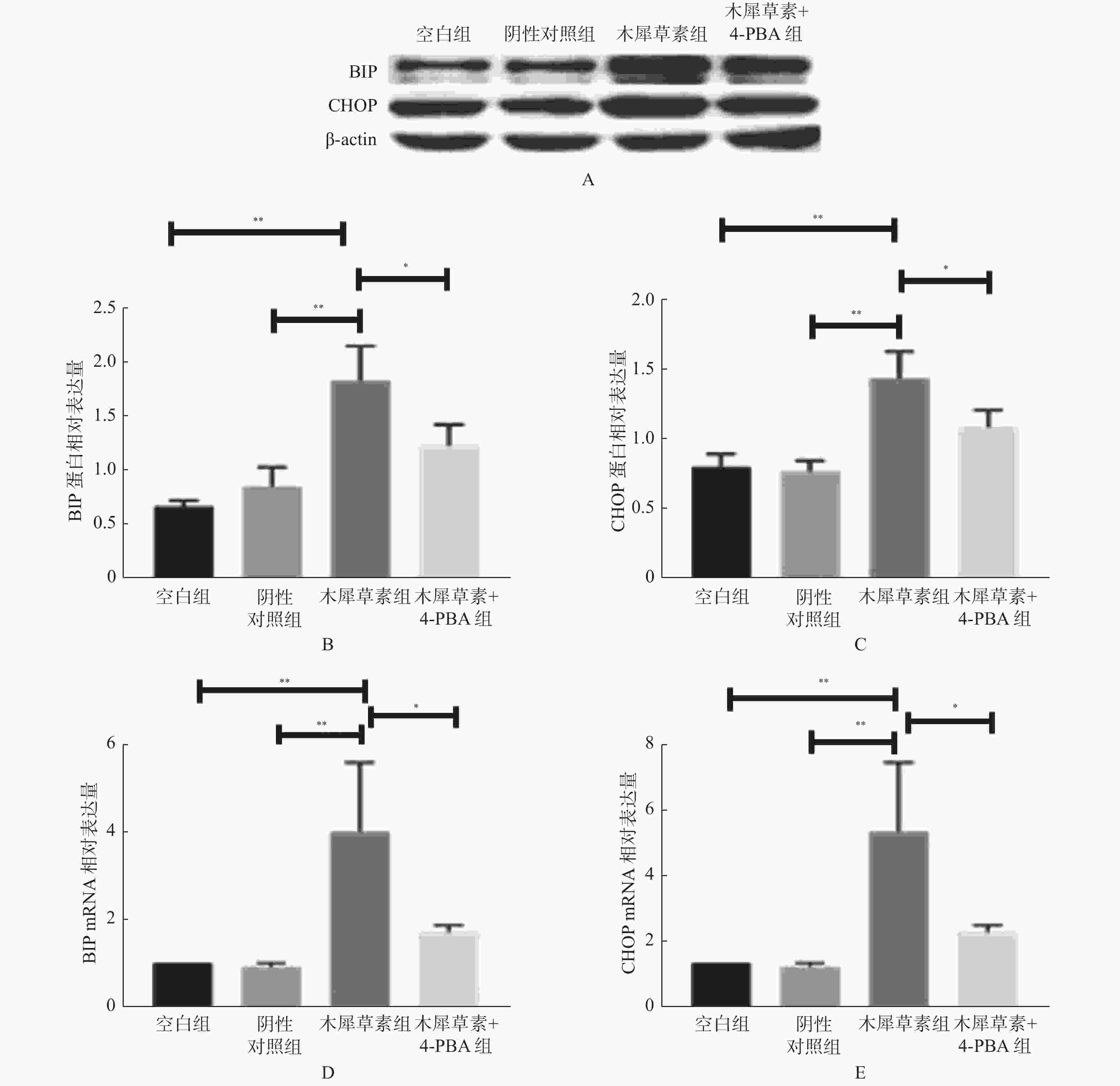
图 2 木犀草素对HASMCs内质网应激的影响
A:空白对照组、阴性对照组、木犀草素组和木犀草素+4-PBA共处理组处理12 h进行Western Blot实验后BIP、CHOP、β-actin蛋白显影情况;B:Western Blot检测木犀草素组内质网应激相关蛋白BIP表达水平;C:Western Blot检测木犀草素组内质网应激相关蛋白CHOP表达水平;D: RT-qPCR检测木犀草素组内质网应激相关基因BIP表达水平;E:RT-qPCR检测木犀草素组内质网应激相关基因CHOP表达水平 与空白对照组及阴性对照组比较,**P < 0.01;与木犀草+4-PBA处理组比较,*P < 0.05。
Figure 2. Effects of luteolin on endoplasmic reticulum stress in HASMCs
表 1 BIP、CHOP、GAPDH引物序列
Table 1. BIP、CHOP、GAPDH primer sequence
名称 正向引物序列 反向引物序列 BIP -TCTACTATGAAGCCCGTCCAGA - -GCTTCATCTGGGTTTATGCCAC - CHOP -ATCTTCACCACTCTTGACCCTG- -ACTCTGTTTCCGTTTCCTGGTT- GAPDH -GAAGGTCGGAGTCAACGGATTT- -GCCATGGGTGGAATCATATTGG- -
[1] Ye J,Wang Y,Wang Z,et al. Roles and mechanisms of interleukin-12 family members in cardiovascular diseases:Opportunities and challenges[J]. Front Pharmacol,2020,11(3):129. [2] Papoutsis K,Kapelouzou A,Georgiopoulos G,et al. Tissue-specific relaxin-2 is differentially associated with the presence/size of an arterial aneurysm and the severity of atherosclerotic disease in humans[J]. Acta Pharmacol Sin,2020,41(6):745-752. doi: 10.1038/s41401-019-0350-5 [3] Luo Z,Deng H,Fang Z,et al. Ligustilide inhibited rat vascular smooth muscle cells migration via c-Myc/MMP2 and ROCK/JNK signaling pathway[J]. J Food Sci,2019,84(12):3573-3583. doi: 10.1111/1750-3841.14936 [4] Da C F,Waczuk E P,Duarte A E,et al. Cytotoxic and antioxidative potentials of ethanolic extract of Eugenia uniflora L. (Myrtaceae) leaves on human blood cells[J]. Biomed Pharmacother,2016,84(12):614-621. [5] Yao Y,Rao C,Zheng G,et al. Luteolin suppresses colorectal cancer cell metastasis via regulation of the miR384/pleiotrophin axis[J]. Oncol Rep,2019,42(1):131-141. [6] Huang L,Jin K,Lan H. Luteolin inhibits cell cycle progression and induces apoptosis of breast cancer cells through downregulation of human telomerase reverse transcriptase[J]. Oncol Lett,2019,17(4):3842-3850. [7] Hetz C,Chevet E,Harding H P. Targeting the unfolded protein response in disease[J]. Nat Rev Drug Discov,2013,12(9):703-719. [8] Brooks R L,Dixon A M. Revealing the mechanism of protein-lipid interactions for a putative membrane curvature sensor in plant endoplasmic reticulum[J]. Biochim Biophys Acta Biomembr,2020,1862(3):183160. doi: 10.1016/j.bbamem.2019.183160 [9] Balsa E,Soustek M S,Thomas A,et al. ER and nutrient stress promote assembly of respiratory chain supercomplexes through the PERK-eIF2alpha axis[J]. Mol Cell,2019,74(5):877-890. doi: 10.1016/j.molcel.2019.03.031 [10] Redza-Dutordoir M,Averill-Bates D A. Activation of apoptosis signalling pathways by reactive oxygen species[J]. Biochim Biophys Acta,2016,1863(12):2977-2992. doi: 10.1016/j.bbamcr.2016.09.012 [11] Hsuan C F,Hsu H F,Tseng W K,et al. Glossogyne tenuifolia extract inhibits TNF-alpha-induced expression of adhesion molecules in human umbilical vein endothelial cells via blocking the NF-kB signaling pathway[J]. Molecules,2015,20(9):16908-16923. doi: 10.3390/molecules200916908 [12] Zhang B C,Li Z,Xu W,et al. Luteolin alleviates NLRP3 inflammasome activation and directs macrophage polarization in lipopolysaccharide-stimulated RAW264.7 cells[J]. Am J Transl Res,2018,10(1):265-273. [13] Hattori S,Kamiya T,Hara H,et al. CoCl2 decreases EC-SOD expression through histone deacetylation in COS7 cells[J]. Biol Pharm Bull,2016,39(12):2036-2041. doi: 10.1248/bpb.b16-00551 [14] Nekohashi M,Ogawa M,Ogihara T,et al. Luteolin and quercetin affect the cholesterol absorption mediated by epithelial cholesterol transporter niemann-pick c1-like 1 in caco-2 cells and rats[J]. PLoS One,2014,9(5):e97901. doi: 10.1371/journal.pone.0097901 [15] Huang C,He C,Ruan P,et al. TSPYL5 activates endoplasmic reticulum stress to inhibit cell proliferation,migration and invasion in colorectal cancer[J]. Oncol Rep,2020,44(2):449-456. doi: 10.3892/or.2020.7639 [16] Fu Y F,Liu X,Gao M,et al. Endoplasmic reticulum stress induces autophagy and apoptosis while inhibiting proliferation and drug resistance in multiple myeloma through the PI3K/Akt/mTOR signaling pathway[J]. Oncotarget,2017,8(37):61093-61106. doi: 10.18632/oncotarget.17862 [17] Zhang S R,Zhang X C,Liang J F,et al. Chalcomoracin inhibits cell proliferation and increases sensitivity to radiotherapy in human non-small cell lung cancer cells via inducing endoplasmic reticulum stress-mediated paraptosis[J]. Acta Pharmacol Sin,2020,41(6):825-834. doi: 10.1038/s41401-019-0351-4 [18] Pu H,Qian Q,Wang F,et al. Schizandrin A induces the apoptosis and suppresses the proliferation,invasion and migration of gastric cancer cells by activating endoplasmic reticulum stress[J]. Mol Med Rep,2021,24(5):787. doi: 10.3892/mmr.2021.12427 [19] Park S H,Park H S,Lee J H,et al. Induction of endoplasmic reticulum stress-mediated apoptosis and non-canonical autophagy by luteolin in NCI-H460 lung carcinoma cells[J]. Food Chem Toxicol,2013,56(6):100-109. -





 下载:
下载: