Influence of Different Ventilation Strategies During Spontaneous Breathing Trials on Lung Aeration Among Patients Receiving Mechanical Ventilation
-
摘要:
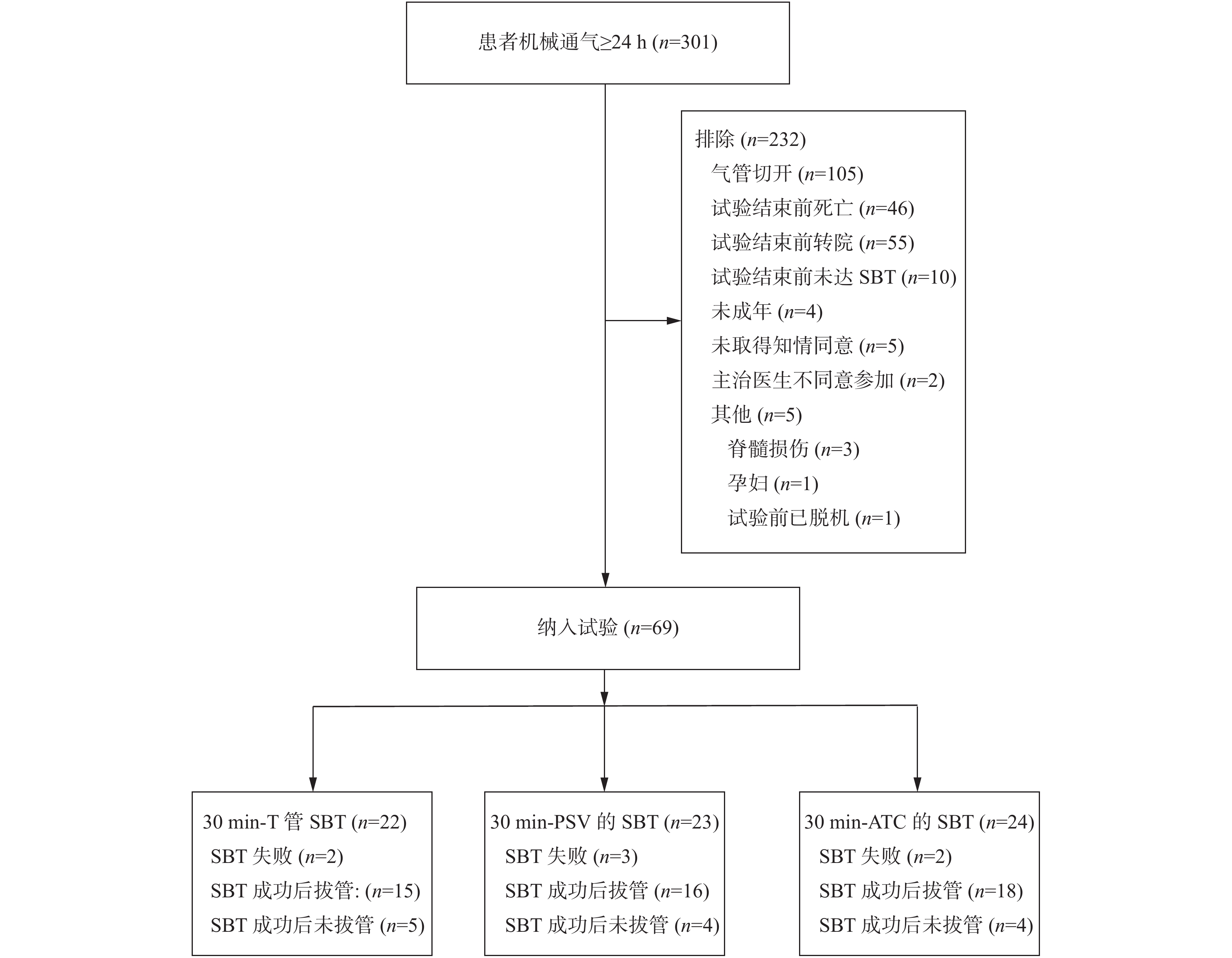
目的 观察对比不同SBT策略对机械通气患者肺通气影响。 方法 纳入2020年6月至2021年1月收住某医科大学附属医院EICU的符合纳入、排除标准,进行首次SBT的机械通气患者69例。随机分入T管组、PSV组及ATC组后进行30 min的SBT。SBT成功后24 h内拔除气管插管。所有患者SBT开始前(T0)、结束时(T1)及拔管后30 min(T2)用超声观察患者肺通气状态。 结果 3组患者首次SBT通过率差异无统计学意义(P > 0.05),成功拔管的患者中:T1时3组患者LUS评分差异无统计学意义(P > 0.05),从T1到T2,T管组患者LUS变化未见明显统计学差异(P > 0.05),PSV组及ATC组患者LUS增加(P < 0.05)。 结论 有压力支持的SBT策略有利于患者通过SBT,同时在SBT过程中保证肺部通气量;然而,T管法SBT似乎更能预测患者拔管后的肺通气量变化。 Abstract:Objective To evaluate the difference of Pressure Support vs T-Piece vs Automatic Tube Compensation Ventilation Strategies during Spontaneous Breathing Trials on lung aeration. Methods Sixty-nine cases of mechanically ventilated patients who were prepared to undergo the first spontaneous breathing trial (SBT) in EICU of an affiliated Hospital of Medical University from June 2020 to January 2021 were included. They were randomly divided into T-Piece group, Pressure Support Ventilation (PSV) group and Automatic Tube Compensation (ATC) group for 30 minutes of SBT. After successful SBT, the tracheal intubation was removed within 24 hours. We observed the patients’ Lung Ultrasound Scores (LUS) with ultrasound before the beginning of SBT (T0), at the end of SBT (T1) and 30 minutes after extubation (T2) in all patients. Results At the end of SBT, the LUS of the three groups were not significantly different (P > 0.05). The LUS of patients in T-Piece , there was no significant difference in the changes from T1 to T2 (P > 0.05). The LUS of patients in the PSV group and ATC group increased from T1 to T2 (P < 0.05). Conclusion SBT strategy with pressure support is helpful for patients to pass SBT and ensure lung ventilation during SBT, however, T-tube SBT seems to be a better predictor of lung ventilation after extubation. -
表 1 成功拔管患者一般资料[(
$\bar x \pm s $ )/M(P25,P75)]Table 1. Baseline characteristics of patints with successful extubation [
$\bar x \pm s $ /M(P25,P75)]项目 T管组(n = 13) PSV组(n = 14) ATC组(n = 16) F/Z P 年龄(岁) 51.62 ± 11.72 50.07 ± 20.67 46.88 ± 17.89 0.287 0.752 BMI(kg/m2) 22.48 ± 2.63 22.23 ± 2.32 22.59 ± 1.78 0.096 0.908 纳入APACHE II(分) 6.77 ± 3.24 8 ± 4.38 6.13 ± 2.58 1.123 0.335 纳入时SOFA(分) 4.46 ± 1.39 4.64 ± 1.69 4.47 ± 1.65 0.143 0.867 T0-PaO2(mmHg) 112.23 ± 35.18 97.07 ± 22.25 115.69 ± 17.59 2.188 0.125 T0-OI 278.62 ± 71.43 249.07 ± 58.33 289.94 ± 49.29 1.834 0.173 T0-PaCO2(mmHg) 34.62 ± 5.72 34.93 ± 4.32 39.31 ± 8.80 2.306 0.113 T0-LUS 10(9-15) 16(10.5- 18) 12(9.75- 15) 5.287 0.071 MAP(mmHg) 81.92 ± 15.87 95.07 ± 13.44 92.63 ± 17.22 2.682 0.081 表 2 成功拔管患者不同策略SBT后血气结果比较[(
$\bar x \pm s $ )]Table 2. Comparison of blood gas analysis for successful extubation after different SBT [(
$\bar x \pm s $ )]血气分析 T管组 PSV组 ATC组 F P PaO2(mmHg) 123.31 ± 37.73 92.57 ± 21.08 Δ 87.44 ± 22.17Δ 6.853 0.003* PaCO2(mmHg) 34.69 ± 4.57 34.36 ± 4.92 40.13 ± 5.57Δ& 6.136 0.005* OI (mmHg) 302.46 ± 105.31 234.93 ± 55.22Δ 225.5 ± 63.58Δ 4.150 0.023* *P < 0.05;与T管组比较,ΔP < 0.05;与PSV组比较,&P < 0.05。 表 3 T管组血气比较[(
$\bar x \pm s $ )]Table 3. Blood gas analysis for group T-Piece [(
$\bar x \pm s $ )]血气分析 T1 T2 t P PaO2(mmHg) 123.31 ± 37.73 119.92 ± 41.72 0.361 0.724 PaCO2(mmHg) 34.69 ± 4.57 34.38 ± 3.53 0.298 0.771 OI (mmHg) 302.46 ± 105.31 306.46 ± 129.35 −0.138 0.893 表 4 PSV管组血气比较[(
$\bar x \pm s $ )]Table 4. Blood gas analysis for group PSV [(
$\bar x \pm s $ )]血气分析 T1 T2 t P PaO2(mmHg) 92.57 ± 21.08 123.5 ± 47.38 −3.180 0.007* PaCO2(mmHg) 34.36 ± 4.92 34.57 ± 5.16 −0.434 0.671 OI (mmHg) 234.93 ± 55.22 298.5 ± 116.85 −3.187 0.007* *P < 0.05。 表 5 ATC组血气比较[(
$\bar x \pm s $ )]Table 5. Blood gas analysis for group ATC [(
$\bar x \pm s $ )]血气分析 T1 T2 t P PaO2(mmHg) 87.44 ± 22.17 125.06 ± 41.28 −4.8 < 0.001* PaCO2(mmHg) 40.13 ± 5.57 39.31 ± 6.87 1.338 0.201 OI (mmHg) 225.5 ± 63.58 318.81 ± 109.81 −4.530 < 0.001* *P < 0.05。 -
[1] Girard T D,Alhazzani W,Kress J P,et al. An Official American Thoracic Society/American College of Chest Physicians Clinical Practice Guideline:Liberation from mechanical ventilation in critically ill adults. Rehabilitation protocols,ventilator liberation protocols,and cuff leak tests[J]. Am J Respir Crit Care Med,2017,195(1):120-133. doi: 10.1164/rccm.201610-2075ST [2] Baptistella A R,Sarmento F J,da Silva K R,et al. Predictive factors of weaning from mechanical ventilation and extubation outcome:a systematic review[J]. J Crit Care,2018,48:56-62. doi: 10.1016/j.jcrc.2018.08.023 [3] Perkins G D,Mistry D,Gates S,et al. Effect of protocolized weaning with early extubation to noninvasive ventilation vs invasive weaning on time to liberation from mechanical ventilation among patients with respiratory failure:The breathe randomized clinical trial[J]. JAMA,2018,320(18):1881-1888. doi: 10.1001/jama.2018.13763 [4] Li Y,Li H,Zhang D. Comparison of T-piece and pressure support ventilation as spontaneous breathing trials in critically ill patients:A systematic review and meta-analysis[J]. Crit Care,2020,24(1):67. doi: 10.1186/s13054-020-2764-3 [5] Subira C,Hernandez G,Vazquez A,et al. Effect of pressure support vs T-piece ventilation strategies during spontaneous breathing trials on successful extubation among patients receiving mechanical ventilation:a randomized clinical trial[J]. JAMA,2019,321(22):2175-2182. doi: 10.1001/jama.2019.7234 [6] Sklar M C,Burns K,Rittayamai N,et al. Effort to breathe with various spontaneous breathing trial techniques. a physiologic Meta-analysis[J]. Am J Respir Crit Care Med,2017,195(11):1477-1485. doi: 10.1164/rccm.201607-1338OC [7] Soummer A,Perbet S,Brisson H,et al. Ultrasound assessment of lung aeration loss during a successful weaning trial predicts postextubation distress*[J]. Crit Care Med,2012,40(7):2064-2072. doi: 10.1097/CCM.0b013e31824e68ae [8] Bickenbach J,Czaplik M,Polier M,et al. Electrical impedance tomography for predicting failure of spontaneous breathing trials in patients with prolonged weaning[J]. Crit Care,2017,21(1):177. doi: 10.1186/s13054-017-1758-2 [9] Boles J M,Bion J,Connors A,et al. Weaning from mechanical ventilation[J]. Eur Respir J,2007,29(5):1033-1056. doi: 10.1183/09031936.00010206 [10] Soldati G,Demi M,Smargiassi A,et al. The role of ultrasound lung artifacts in the diagnosis of respiratory diseases[J]. Expert Rev Respir Med,2019,13(2):163-172. doi: 10.1080/17476348.2019.1565997 [11] Mongodi S,De Luca D,Colombo A,et al. Quantitative lung ultrasound:technical aspects and clinical applications[J]. Anesthesiology,2021,134(6):949-965. doi: 10.1097/ALN.0000000000003757 [12] Mojoli F,Bouhemad B,Mongodi S,et al. Lung ultrasound for critically ill patients[J]. Am J Respir Crit Care Med,2019,199(6):701-714. doi: 10.1164/rccm.201802-0236CI [13] Bouhemad B,Brisson H,Le-Guen M,et al. Bedside ultrasound assessment of positive end-expiratory pressure-induced lung recruitment[J]. Am J Respir Crit Care Med,2011,183(3):341-347. doi: 10.1164/rccm.201003-0369OC [14] Bouhemad B,Liu Z H,Arbelot C,et al. Ultrasound assessment of antibiotic-induced pulmonary reaeration in ventilator-associated pneumonia[J]. Crit Care Med,2010,38(1):84-92. doi: 10.1097/CCM.0b013e3181b08cdb [15] Lichtenstein D. Should lung ultrasonography be more widely used in the assessment of acute respiratory disease?[J]. Expert Rev Respir Med,2010,4(5):533-538. doi: 10.1586/ers.10.51 -






 下载:
下载: