Application of Electroencephalogram, Short Latency Somatosensory Evoked Potential and Transcranial Doppler Ultrasound in the Determination of Brain Death
-
摘要:
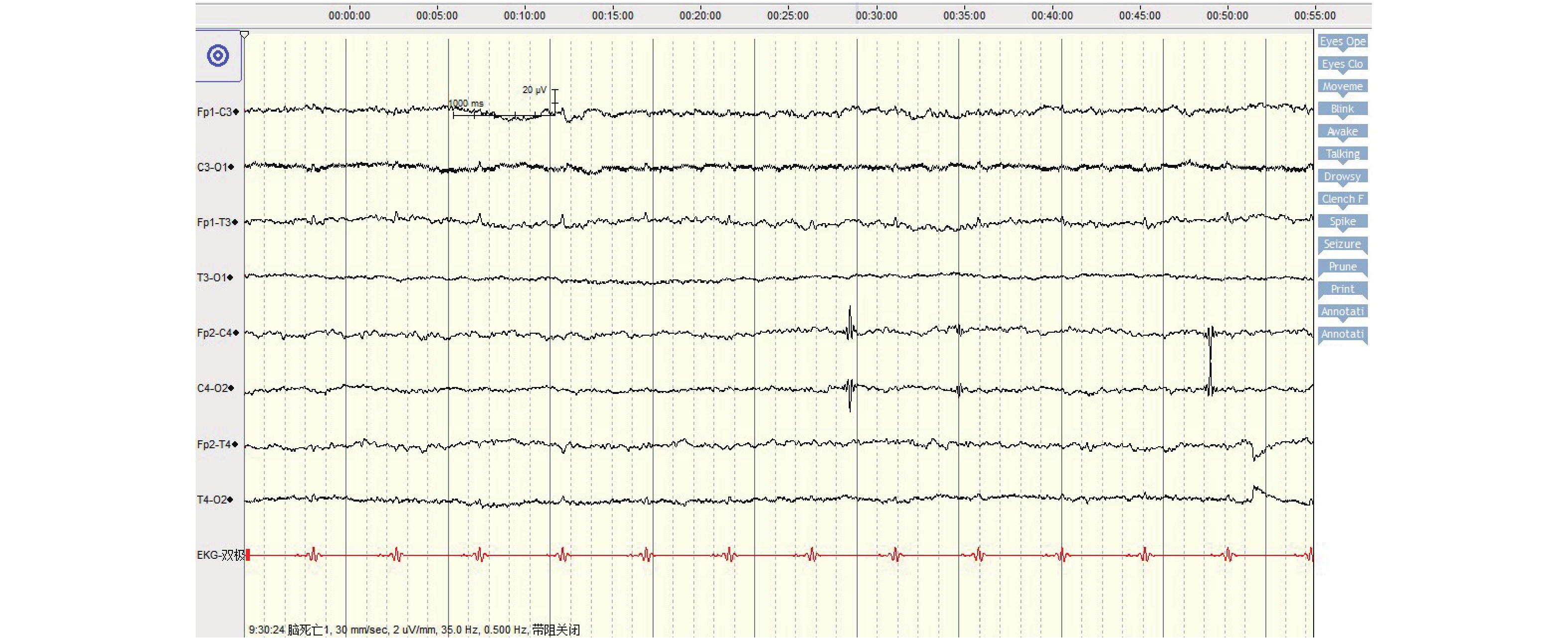
目的 探究脑电图、短潜伏期体感诱发电位和经颅多普勒超声在脑死亡判定中的价值和应用。 方法 收集昆明市第一人民医院经临床判定为脑死亡的患者31例,对每位患者均进行2次脑电图、短潜伏期体感诱发电位和经颅多普勒超声检测,根据脑死亡确认实验标准将其分为脑死亡阳性组和脑死亡阴性组,比较3种检查方式的敏感性、特异性和准确性。 结果 脑电图的敏感性、特异性和准确性均高于短潜伏期体感诱发电位和经颅多普勒超声检测,其敏感性为100%、特异性为75%和准确性为93.55%。脑死亡组脑电图和短潜伏期体感诱发电位阳性人数显著高于非脑死亡组,差异有统计学意义(P < 0.05)。 结论 ROC曲线分析显示脑电图对诊断脑死亡效果佳。 -
关键词:
- 脑死亡 /
- 脑电图 /
- 短潜伏期体感诱发电位 /
- 经颅多普勒超声
Abstract:Objective To explore the value and application of electroencephalogram, short latency somatosensory evoked potential and transcranial Doppler ultrasound in the determination of brain death. Methods 31 patients with brain death in our hospital were enrolled. Each patient was tested twice by electroencephalogram, short latency somatosensory evoked potential and transcranial Doppler ultrasound. According to the experimental standard of brain death confirmation, they were divided into brain death positive group and brain death negative group. The sensitivity, specificity and accuracy of the three tests were compared. Results The sensitivity, specificity and accuracy of EEG were higher than those of short latency somatosensory evoked potentials and transcranial Doppler, with sensitivity of 100%, specificity of 75% and accuracy of 93.55%. The number of positive EEG and short latency somatosensory evoked potential in brain death group was significantly higher than that in non-brain death group, the difference was statistically significant (P < 0.05). Conclusion ROC curve analysis showed that electroencephalogram was effective in diagnosing brain death. -
表 1 3种检测方法对脑死亡的诊断价值比较(%)
Table 1. Comparison of the diagnostic value of three testing methods for brain death (%)
项目 敏感性 特异性 准确性 EEG 100.00 75.00 93.55 SLSEP 95.65 50.00 83.87 TCD 86.96 12.50 67.74 表 2 3种检测结果的比较[n(%)]
Table 2. Comparison of the results of the three tests [n(%)]
检查方式 脑死亡阳性组(n = 23) 脑死亡阴性组(n = 8) 合计 χ2 P EEG 21.390 < 0.001* 阳性 23(100) 2(25) 25 阴性 0(0) 6(75) 6 SLSPE 9.144 0.002* 阳性 22(95.65) 4(50) 26 阴性 1(4.35) 4(50) 5 TCD 0.002 0.968 阳性 20(86.96) 7(87.5) 27 阴性 3(13.04) 1(12.5) 4 *P < 0.05。 -
[1] 宿英英,张艳,叶红,等. 脑死亡判定标准与技术规范(成人质控版)[J]. 中国现代神经疾病杂志,2015,15(12):935-939. doi: 10.3969/j.issn.1672-6731.2015.12.002 [2] Greer D M,Shemie S D,Lewis A,et al. Determination of brain death/death by neurologic criteria:The World Brain Death Project[J]. JAMA,2020,324(11):1078-1097. doi: 10.1001/jama.2020.11586 [3] 刘春峰,陆国平,钱素云,等. 脑死亡判定标准与技术规范(儿童质控版)[J]. 中华移植杂志(电子版),2015,9(2):54-57. [4] 国家卫生健康委员会脑损伤质控评价中心. 中国儿童脑死亡判定标准与操作规范[J]. 中华儿科杂志,2019(5):331-335. doi: 10.3760/cma.j.issn.0578-1310.2019.05.003 [5] 中国抗癫痫协会脑电图和神经电生理分会. 临床脑电图基本技术标准[J]. 癫痫杂志,2022,8(1):3-11. doi: 10.7507/2096-0247.20220002 [6] 赵红,宿英英. 体感诱发电位的分级标准[J]. 中华老年心脑血管病杂志,2004,5(4):283-284. doi: 10.3969/j.issn.1009-0126.2004.04.029 [7] 杜宏生,李牧,马景鋻. 临床脑死亡病例判定12例报告[J]. 实用器官移植电子杂志,2016,4(5):286-290. doi: 10.3969/j.issn.2095-5332.2016.05.006 [8] Scarpino M,Lolli F,Lanzo G,et al. Neurophysiology and neuroimaging accurately predict poor neurological outcome within 24 hours after cardiac arrest:the ProNeCA prospective multicentre prognostication study[J]. Resuscitation,2019,143(5):115-123. [9] Nevalainen P,Marchi V,Metsäranta M,et al. Evoked potentials recorded during routine EEG predict outcome after perinatal asphyxia[J]. Clinical Neurophysiology,2017,128(7):1337-1343. doi: 10.1016/j.clinph.2017.04.025 [10] 陈奥,练巧燕,徐鑫,等. 肺移植术后早期急性肾损伤的研究进展[J]. 器官移植,2020,11(6):743-748. doi: 10.3969/j.issn.1674-7445.2020.06.015 [11] 国家卫生健康委员会脑损伤质控评价中心,中华医学会神经病学分会神经重症协作组,中国医师协会神经内科医师分会神经重症专业委员会. 中国成人脑死亡判定标准与操作规范(第二版)[J]. 中华医学杂志,2019,1(17):1288-1292. doi: 10.3760/cma.j.issn.0376-2491.2019.17.003 [12] 蒋光伟,骆建军,郭丽叶,等. 脑死亡患者内源性皮质醇水平及补充甲泼尼龙琥珀酸钠对血流动力学的影响[J]. 创伤外科杂志,2021,23(12):900-904. doi: 10.3969/j.issn.1009-4237.2021.12.005 [13] Buchner H,Ferbert A. Irreversibilitätsnachweis der klinischen Ausfallssymptome des Gehirns[J]. Der Nervenarzt,2016,87(2):128-143. doi: 10.1007/s00115-015-0049-x [14] Gobert F,Dailler F,Fischer C,et al. Proving cortical death after vascular coma:Evoked potentials,EEG and neuroimaging[J]. Clinical Neurophysiology,2018,129(6):1105-1116. doi: 10.1016/j.clinph.2018.02.133 [15] Robba C,Iaquaniello C,Citerio G. Death by neurologic criteria:Pathophysiology,definition,diagnostic criteria and tests[J]. Minerva Anestesiologica,2019,85(7):774-781. [16] Chang J,Tsivgoulis G,Katsanos A,et al. Diagnostic accuracy of transcranial doppler for brain death confirmation:Systematic review and meta-analysis[J]. American Journal of Neuroradiology,2016,37(3):408-414. doi: 10.3174/ajnr.A4548 -






 下载:
下载: