Clinical Effect of Reoperation for Recurrent Glioma
-
摘要:
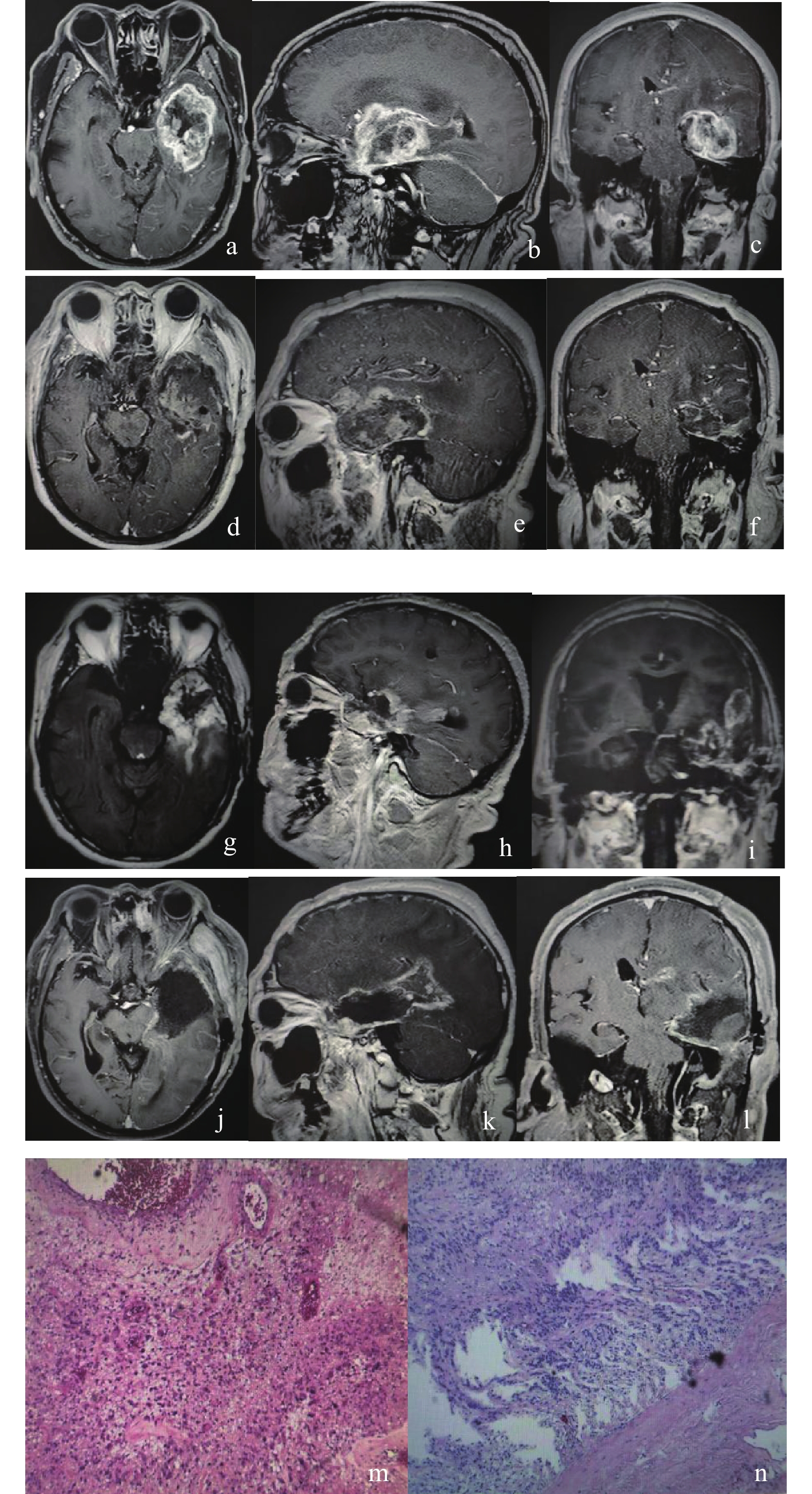
目的 通过多模态显微外科手术在脑胶质瘤复发患者的临床疗效分析,探索脑胶质瘤复发后的诊疗模式。 方法 收集昆明某三甲医院神经外科2017年9月至2020年12月收治的术后脑胶质瘤复发后再手术的患者资料28例,进行回顾性分析,用KPS( Karnofsky 神经功能评分)进行临床疗效评估,用影像学资料评价肿瘤切除程度、复发脑胶质瘤的病理变化对比、术后的辅助治疗、随访患者的生存期等总体疗效。通过 Graphpad Prism软件进行作图、数据分析。采用配对样本t检验,分析术前及术后KPS评分的差异。 结果 28例研究对象的术后影像学观察结果:肿瘤全切的21例,次全切的5例,肿瘤活检的2 例。并发症患者22例。出院前的临床症状较术前有所改善24例(改善率 85.7%)。术前KPS平均评分(66.07±7.37)分;术后1月KPS平均评分(72.14±11.00)分,对比术前的 KPS 评分,差异有统计学意义(P < 0.05)。患者术后病理显示肿瘤恶性程度进展8例。经术后随访证实28例患者的平均生存时间(7.98±6.42)月,最长生存时间24月。 结论 多模态、多技术联合应用的显微外科手术是复发脑胶质瘤的相对微创且有效的治疗方式,效果良好,可用作复发脑胶质瘤手术切除的选择术式。 Abstract:Objective To analyze the clinical effect of multimodality microsurgery on recurrent gliomas, and to explore the diagnosis and treatment of recurrent gliomas. Methods Data of 28 patients with recurrent GLIOMAS who underwent reoperation from September 2017 to December 2020 in the Department of Neurosurgery of a tertiary grade A hospital in Kunming were collected and analyzed retrospectively, After the reoperation, the Karnofsky neurological function score (KPS) was used to evaluate the clinical efficacy, and the imaging data was used to evaluate the degree of tumor resection, the postoperative comparison of pathological changes of recurrent glioma, postoperative adjuvant treatment, follow-up patient survival time and other overall effects. Graphpad Prism (V8.4.2.679) software was used to analyze the data and graph. The difference in KPS scores before and after the operation was tested in pairs. Results 28 patients were treated with reoperations to varying degrees. Postoperative imaging confirmed that 21 cases of tumors were totally resected, 5 cases were subtotal resected, and 2 cases had tumor biopsy. Postoperative complications occurred in 22 patients. The clinical symptoms before discharge were improved in 24 cases compared with that before the operation, with an improvement rate of 85.7%. The mean KPS score was 66.07 ± 7.37 before the operation and 72.14 ± 11.00 one month after the operation.The differences were statistically significant. Postoperative pathology showed the progression of Malignancy in 8 cases. The mean survival time of 28 patients were (7.98 ± 6.42) months and the longest survival time were 24 months. Conclusion The combined application of multi-modality and multi-technique microsurgery is a relatively minimally invasive and effective treatment for recurrent glioma. The surgical effect is good, and it can be used as an option for surgical resection of recurrent glioma. -
Key words:
- Glioma /
- Recurrence /
- Reoperation /
- Therapeutic effect
-
表 1 临床资料分析结果
Table 1. Clinical data analysis results
病理分型 n 构成比(%) 胶质母细胞瘤 12 42.86 星形细胞瘤 15 53.57 少突胶质细胞瘤 1 3.57 表 2 再入院临床症状分析
Table 2. Analysis of clinical symptoms of readmission
分类 n 占比(%) 头晕头痛 21 75.00 恶心呕吐 6 21.43 言语功能障碍 7 25.00 肢体功能障碍 15 53.57 癫痫发作 4 14.29 视力下降 3 10.71 面神经功能障碍 1 3.57 平衡功能障碍 1 3.57 精神症状 1 3.57 表 3 复发情况分析
Table 3. Analysis of clinical symptoms of readmission
属性 n 构成比(%) 累计部位 单个脑区 12 42.86 多个脑区 16 57.14 复发种类 原位复发 13 46.43 周边复发 11 39.29 浸润复发 4 14.29 肿瘤表现 实性占位 18 64.29 囊性占位 9 32.14 囊性占位 1 3.57 表 4 术前术后KPS评分[(
$\bar x \pm s $ ),分]Table 4. KPS score before and after surgery [(
$\bar x \pm s $ ),points]组别 n KPS 评分 手术前 28 66.07 ± 7.37 手术后 28 72.14 ± 11.00 P 0.0016 -
[1] Mohannat Alireza,Aymeric Amelot,Dorian Chauvet,et al. Poor prognosis and challenging treatment of optic nerve malignant gliomas:Literature review and case report series[J]. World neurosurgery,2017,97(1):751.e1-751.e6. [2] Sturm Dominik,Pfister Stefan M,Jones David T W. Pediatric gliomas:Current concepts on diagnosis,biology,and clinical management[J]. Journal of Clinical Oncology:Official Journal of the American Society of Clinical Oncology,2017,35(21):2370-2377. doi: 10.1200/JCO.2017.73.0242 [3] Jiaoming Li,Xiaodong Niu,Youjun Gan,et al. Clinical and pathologic features and prognostic factors for recurrent gliomas[J]. World Neurosurgery,2019,128(8):e21-e30. [4] Ferguson Sherise D,Momin Eric N,Weinberg Jeffrey S. Surgical management of recurrent intracranial gliomas[J]. Progress in Neurological Surgery,2018,30(1):218-231. [5] Caroline Kane Laub,Jennifer Stefanik,Lisa Doherty. Approved treatments for patients with recurrent high-grade gliomas[J]. Seminars in Oncology Nursing,2018,34(5):486-493. doi: 10.1016/j.soncn.2018.10.005 [6] Quinn T.Ostrom,Luc Bauchet,Faith G.Davis,et al. The epidemiology of glioma in adults:A "state of the science" review[J]. Neuro Oncol,2014,16(7):896-913. doi: 10.1093/neuonc/nou087 [7] Mark R.Gilbert,Meihua Wang,Kenneth D,et al. Dose-dense temozolomide for newly diagnosed glioblastoma:A randomized phase III clinical trial[J]. Journal of Clinical Oncology:Official Journal of the American Society of Clinical Oncology,2013,31(32):4085-4091. doi: 10.1200/JCO.2013.49.6968 [8] Christian Henker ,Thomas Kriesen ,Moritz Scherer,et al. Association between tumor compartment volumes,the incidence of pretreatment seizures,and statin-mediated protective effects in glioblastoma[J]. Neurosurgery,2019,85(4):E722-E729. doi: 10.1093/neuros/nyz079 [9] 库格鲁克·亚力坤,周庆九. 复发性胶质瘤的治疗进展[J]. 临床神经外科杂志,2020,17(5):588-591. doi: 10.3969/j.issn.1672-7770.2020.05.023 [10] Morshed Ramin A,Young Jacob S,Han Seunggu J,et al. Perioperative outcomes following reoperation for recurrent insular gliomas[J]. Journal of Neurosurgery,2018,131(2):467-473. [11] R Helseth,E Helseth,T B Johannesen,et al. Overall survival,prognostic factors,and repeated surgery in a consecutive series of 516 patients with glioblastoma multiforme[J]. Acta Neurologica Scandinavica,2010,122(3):159-167. [12] H B W Larsson,M Stubgaard,J L Frederiksen,et al. Quantitation of blood-brain barrier defect by magnetic resonance imaging and gadolinium-DTPA in patients with multiple sclerosis and brain tumors[J]. Magnetic Resonance in Medicine,1990,16(1):117-31. [13] Doris D Wang,Hansen Deng 1,Shawn L Hervey-Jumper,et al. Seizure outcome after surgical resection of insular glioma[J]. Neurosurgery,2018,83(4):709-718. doi: 10.1093/neuros/nyx486 [14] Massimiliano Del Bene,Alessandro Perin,Cecilia Casali,et al. Advanced ultrasound imaging in glioma surgery:Beyond gray-scale B-mode[J]. Frontiers in Oncology,2018,8(12):576. [15] 刘公洪,宋志富,黄小林,等. 多模态MRI联合超声显微手术治疗脑胶质瘤临床疗效及预后分析[J]. 解放军医药杂志,2020,32(7):43-46. doi: 10.3969/j.issn.2095-140X.2020.07.010 [16] Moiyadi A V,Shetty P M. Surgery for recurrent malignant gliomas:Feasibility and perioperative outcomes[J]. Neurology India,2012,60(2):185-190. doi: 10.4103/0028-3886.96398 [17] Pierina Navarria,Giuseppe Minniti,Elena Clerici,et al. Re-irradiation for recurrent glioma:Outcome evaluation,toxicity and prognostic factors assessment[J]. A multicenter Study of the Radiation Oncology Italian Association (AIRO),2019,142(1):59-67. [18] Stephanie E Combs,Maximilian Niyazi,Sebastian Adeberg,et al. Re‐irradiation of recurrent gliomas:Pooled analysis and validation of an established prognostic score-report of the Radiation Oncology Group ( ROG ) of the German Cancer Consortium ( DKTK )[J]. Cancer Medicine,2018,7(5):1742-1749. doi: 10.1002/cam4.1425 [19] Stuart J Smith,Betty M Tyler,Toby Gould,et al. Overall survival in malignant glioma is significantly prolonged by neurosurgical delivery of etoposide and temozolomide from a thermo-responsive biodegradable paste[J]. Clinical Cancer Research:An Official Journal of the American Association for Cancer Research,2019,25(16):5094-5106. doi: 10.1158/1078-0432.CCR-18-3850 [20] Yong Liu,Fuqiang Feng,Peigang Ji,et al. Improvement of health related quality of life in patients with recurrent glioma treated with bevacizumab plus daily temozolomide as the salvage therapy[J]. Clinical Neurology and Neurosurgery,2018,169(6):64-70. [21] Kesari S,Ram Z. Tumor-treating fields plus chemotherapy versus chemotherapy alone for glioblastoma at first recurrence:A post hoc analysis of the EF-14 trial[J]. Cns Oncology,2017,6(3):185-193. doi: 10.2217/cns-2016-0049 [22] Timothy F Cloughesy,Aaron Y Mochizuki,Joey R Orpilla,et al. Neoadjuvant anti-PD-1 immunotherapy promotes a survival benefit with intratumoral and systemic immune responses in recurrent glioblastoma[J]. Nature Medicine,2019,25(3):477-486. -






 下载:
下载: