Effect of Panax Noto-ginseng Saponins on the Proliferation of Human Stem Cells from Apical Papilla
-
摘要:
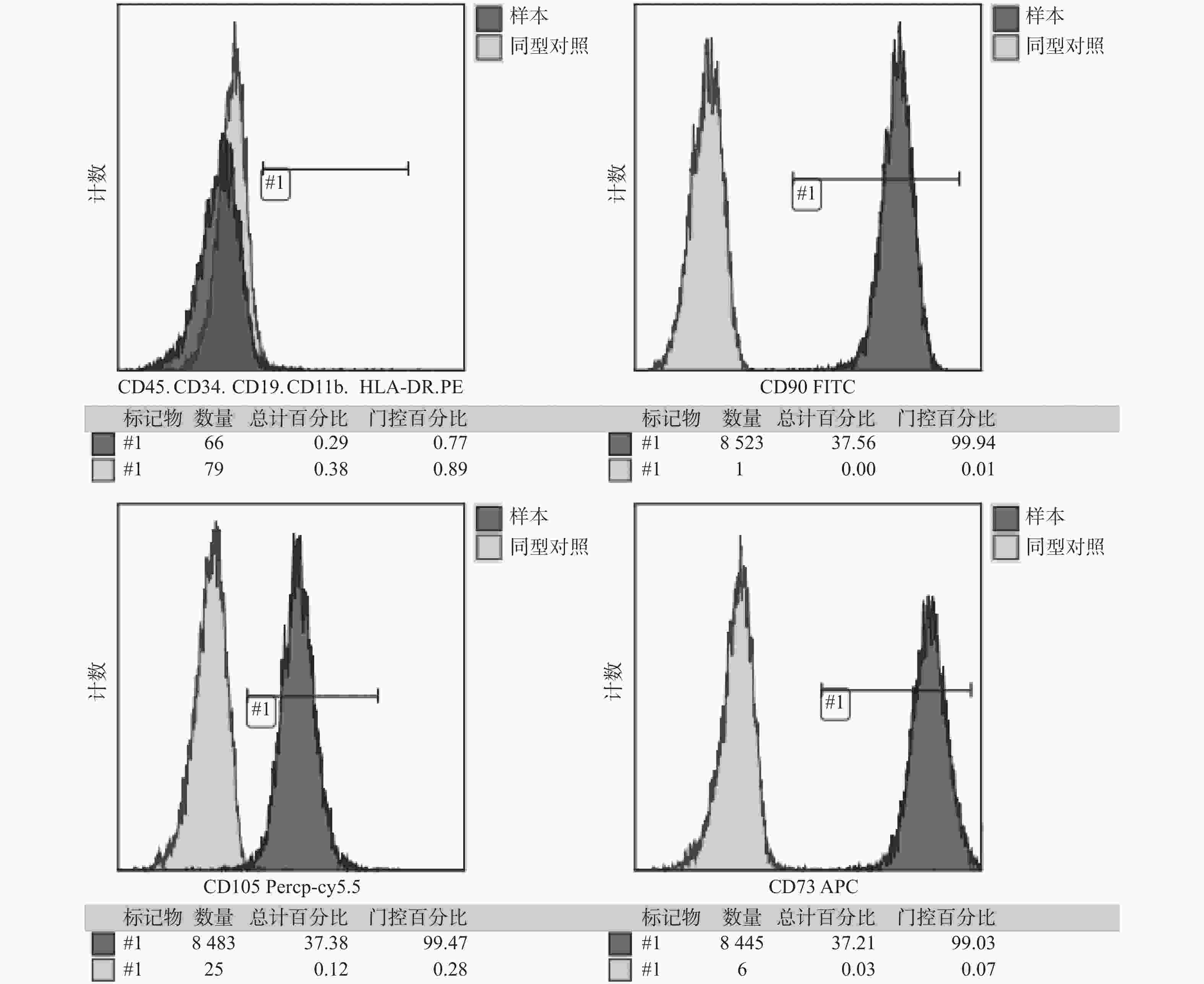
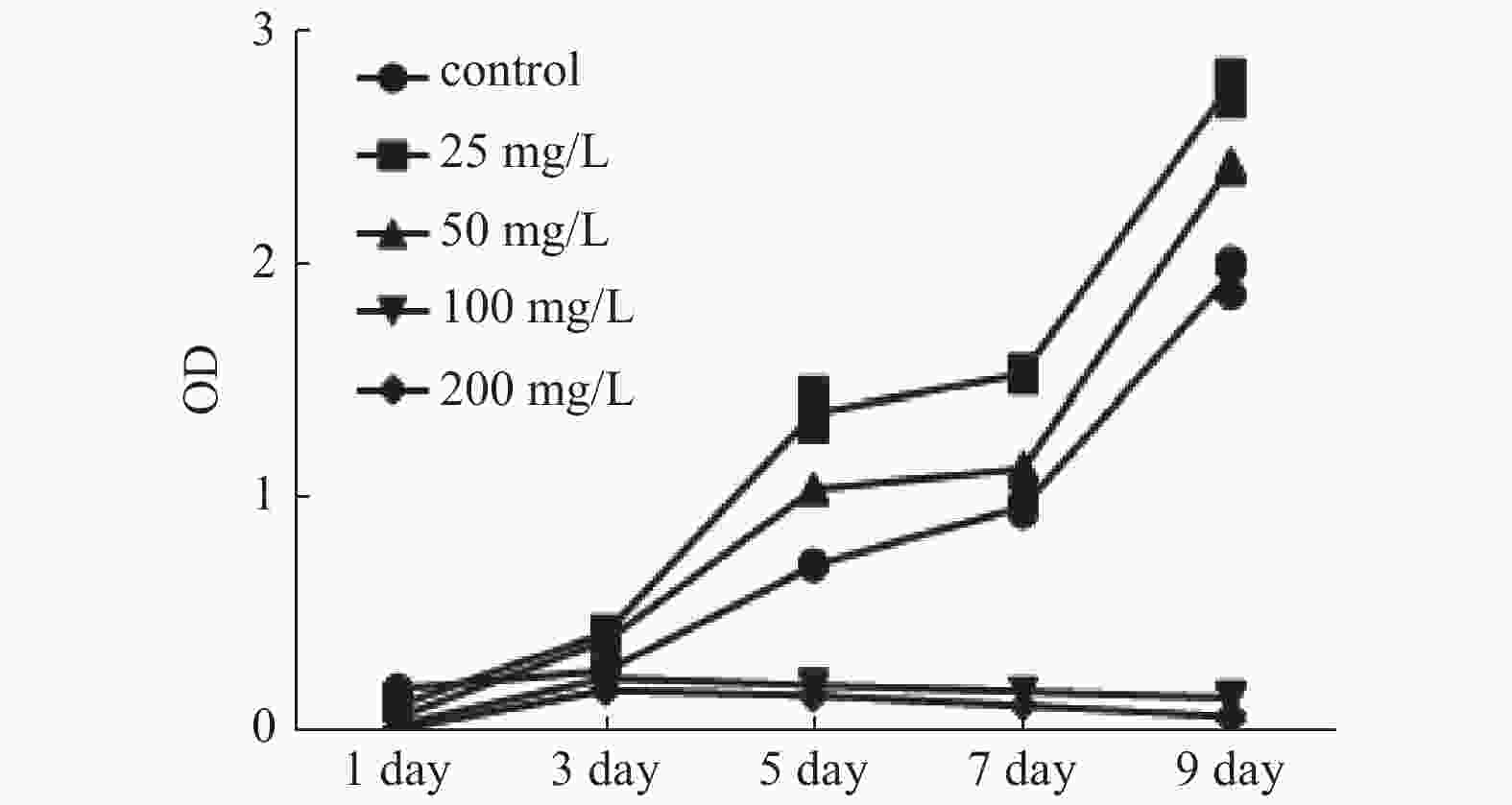
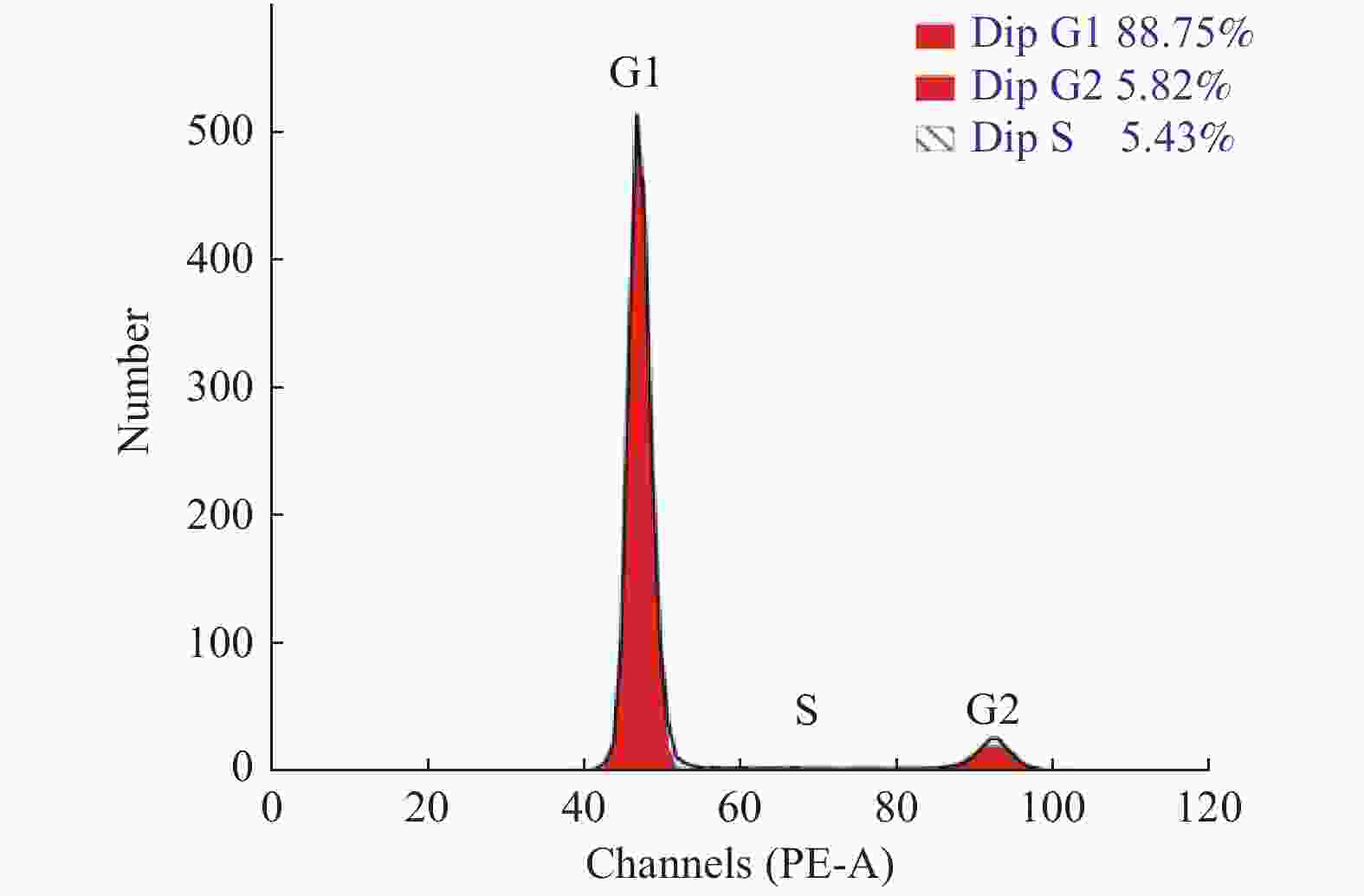
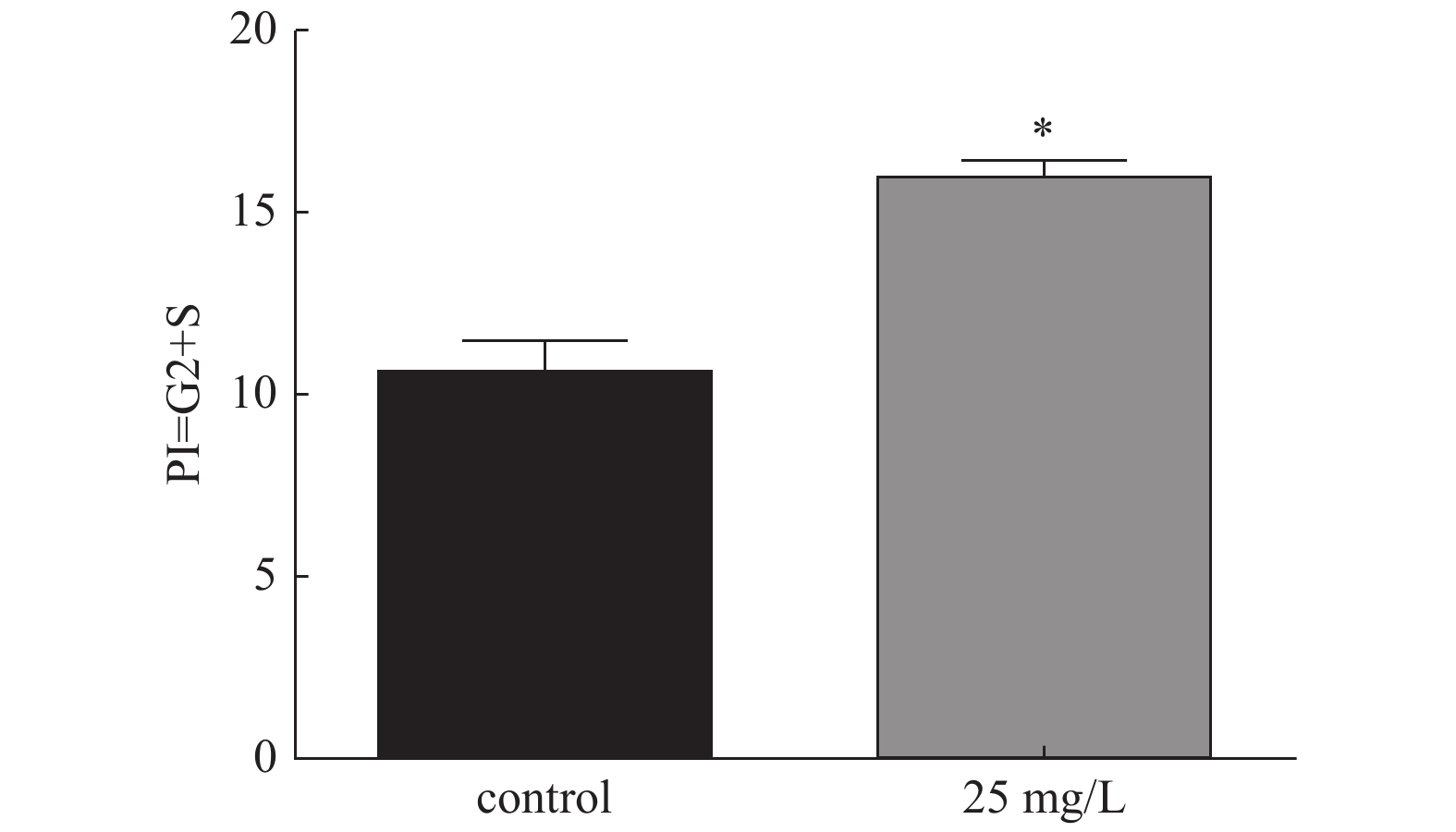
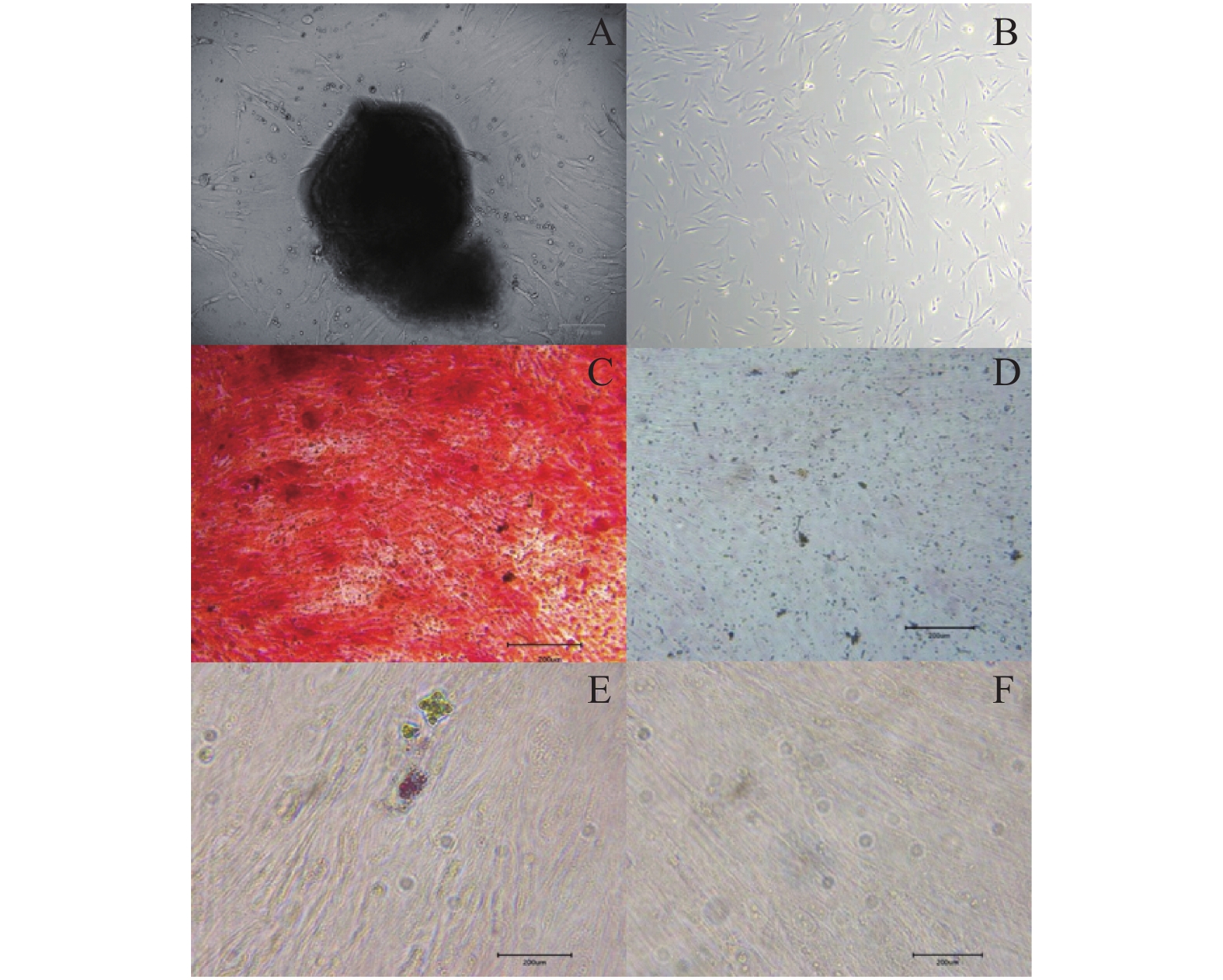
目的 探究三七总皂苷(panax noto-ginseng saponins,PNS)对人根尖牙乳头干细胞(human stem cells from apical papilla, hSCAPs)增殖的影响。 方法 收集牙乳头组织、贴壁法分离培养原代细胞,流式细胞术鉴定hSCAPs表面标志物,诱导成骨及成脂鉴定hSCAPs多向分化潜能;配制25 mg/L、50 mg/L、100 mg/L、200 mg/L的PNS培养基,CCK-8法检测不同浓度PNS下hSCAPs的增殖速率,流式细胞术检测最佳促进增殖组与对照组的细胞周期差异。 结果 原代分离培养成功的hSCAPs符合间充质干细胞来源,相关表面标记物高表达,可向成脂和成骨分化;与对照和其他实验组比较,25 mg/LPNS促进hSCAPs增殖效果最佳,差异具有统计学意义(P < 0.05)。 结论 25 mg/LPNS促进hSCAPs增殖能力的效果最佳,提示hSCAPs对PNS具有很强的敏感性。 Abstract:Objective To explore the effects of which Panax noto-ginseng saponins (PNS) influence the proliferation of human stem cells from apical papilla (hSCAPs). Methods We collected apical papilla and separated primary cells with wall methods. Flow cytometry was used to identify the surface markers of hSCAPs, the multi-directional-differentiation potential of hSCAPs was identified by inducing bone and fat differentiation. PNS-culture-medium with 25 mg/L, 50 mg/L, 100 mg/L, and 200 mg /L was prepared, CCK-8 method was used to detect the proliferation rate of hSCAPs under different concentrations of PNS, and the changes of the cell cycle at the best proliferation concentration were observed. Results hSCAPs was cultivated successfully by primary separation and belong to the source of mesenchymal stem cells. The related surface markers were highly expressed and induced to fat differentiation and bone differentiation. Compared with the control and other experimental groups, PNS with 25 mg/L promoted highly hSCAPs proliferation. The difference was statistically significant (P < 0.05). Conclusions PNS with 25 mg/L has the best effect for boosting hSCAPs proliferation abilities. It is prompted that hSCAPs has a strong sensitivity to PNS, that is, a low concentration can significantly promote the proliferation of hSCAPs. -
表 1 不同浓度PNS下hSCAPs增殖的差异
Table 1. Differences in HSCAPS proliferation under different concentrations of PNS
OD 值, $ \stackrel{-}{X} $ ± S组别 第1天 第3天 第5天 第7天 第9天 对照组 0.199 ± 0.005 0.275 ± 0.005 0.731 ± 0.006 0.984 ± 0.023 1.975 ± 0.062 25 mg/L 0.126 ± 0.006* 0.442 ± 0.01* 1.385 ± 0.067* 1.549 ± 0.017* 2.784 ± 0.057* 50 mg/L 0.075 ± 0.005*# 0.407 ± 0.011*# 1.058 ± 0.007*# 1.146 ± 0.016*# 2.443 ± 0.015*# 100 mg/L 0.044 ± 0.003*#& 0.245 ± 0.009*#& 0.213 ± 0.009*#& 0.187 ± 0.003*#& 0.158 ± 0.007*#& 200 mg/L 0.024 ± 0.002*#&△ 0.192 ± 0.003*#&△ 0.168 ± 0.005*#&△ 0.126 ± 0.003*#&△ 0.079 ± 0.013*#&△ F 490.006 358.621 598.128 3 552.492 2 174.635 P 0.000 0.000 0.000 0.000 0.000 与对照组比较,*P < 0.05;实验组两两比较,与25 mg/L组比较,#P < 0.05;与50 mg/L组比较,&P < 0.05;与100 mg/L组比较,△P < 0.05。 -
[1] SANZ J L,FORNER L,ALMUDEVER A,et al. Viability and Stimulation of Human Stem Cells from the Apical Papilla (hSCAPs) Induced by Silicate-Based Materials for Their Potential Use in Regenerative Endodontics:A Systematic Review[J]. Materials (Basel),2020,13(4):947-961. [2] Matichescu A,Ardelean L C,Rusu L C,et al. Advanced Biomaterials and Techniques for Oral Tissue Engineering and Regeneration-A Review[J]. Materials (Basel),2020,13(22):5303-5339. [3] Nada O A,El Backly R M. Stem Cells From the Apical Papilla (SCAP) as a Tool for Endogenous Tissue Regeneration[J]. Front Bioeng Biotechnol,2018,6:103-118. doi: 10.3389/fbioe.2018.00103 [4] Sonoyama W,Liu Y,Fang D,et al. Mesenchymal stem cell-mediated functional tooth regeneration in swine[J]. PLoS One,2006,1(1):e79-88. doi: 10.1371/journal.pone.0000079 [5] Duan L,Xiong X,Hu J,et al. Efficacy and safety of oral Panax notoginseng saponins for unstable angina patients:A meta-analysis and systematic review[J]. Phytomedicine,2018,47:23-33. doi: 10.1016/j.phymed.2018.04.044 [6] QU J,XU N,ZHANG J,et al. Panax notoginseng saponins and their applications in nervous system disorders:a narrative review[J]. Ann Transl Med,2020,8(22):1525-1534. doi: 10.21037/atm-20-6909 [7] Xie W,Meng X,Zhai Y,et al. Panax Notoginseng Saponins:A Review of Its Mechanisms of Antidepressant or Anxiolytic Effects and Network Analysis on Phytochemistry and Pharmacology[J]. Molecules,2018,23(4):940-957. [8] Sangkert S,Kamolmatyakul S,Meesane J. Mimicked scaffolds based on coated silk woven fabric with gelatin and chitosan for soft tissue defect in oral maxillofacial area[J]. Int J Artif Organs,2020,43(3):189-202. doi: 10.1177/0391398819877191 [9] Hu L, Zhao B, Gao Z, et al. Regeneration characteristics of different dental derived stem cell sheets [J]. J Oral Rehabil, 2020, 47 Suppl 1: 66-72. [10] Smeda M, Galler K M, Woelflick M, et al. Molecular Biological Comparison of Dental Pulp- and Apical Papilla-Derived Stem Cells [J]. Int J Mol Sci, 2022, 23(5): 2615-2632. [11] Kwon S G,Kwon Y W,Lee T W,et al. Recent advances in stem cell therapeutics and tissue engineering strategies[J]. Biomater Res,2018,22:36-43. doi: 10.1186/s40824-018-0148-4 [12] Jang S, Jeong J G, Oh T I, et al. Biomaterials for Cell-Surface Engineering and Their Efficacy [J]. J Funct Biomater, 2021, 12(3): 41-55. [13] Zheng H,Liu C,Ou Y,et al. Total saponins of Panax notoginseng enhance VEGF and relative receptors signals and promote angiogenesis derived from rat bone marrow mesenchymal stem cells[J]. J Ethnopharmacol,2013,147(3):595-602. doi: 10.1016/j.jep.2013.03.043 [14] Ou Y F,Fu X K,Mei X S,et al. [Inhibitory effect of total saponins of Panax notoginseng on rat bone marrow mesenchymal stem cell apoptosis][J]. Sheng Li Xue Bao,2016,68(3):285-292. [15] Zhu P,Jiang W,He S,et al. Panax notoginseng saponins promote endothelial progenitor cell angiogenesis via the Wnt/beta-catenin pathway[J]. BMC Complement Med Ther,2021,21(1):53-63. doi: 10.1186/s12906-021-03219-z [16] Tee A R. The Target of Rapamycin and Mechanisms of Cell Growth [J]. Int J Mol Sci, 2018, 19(3): 880-812. [17] Matthews H K,Bertoli C,De Bruin R A M. Cell cycle control in cancer[J]. Nat Rev Mol Cell Biol,2022,23(1):74-88. doi: 10.1038/s41580-021-00404-3 [18] Otto T,Sicinski P. Cell cycle proteins as promising targets in cancer therapy[J]. Nat Rev Cancer,2017,17(2):93-115. doi: 10.1038/nrc.2016.138 [19] Schaffer J E. Lipotoxicity:Many Roads to Cell Dysfunction and Cell Death:Introduction to a Thematic Review Series[J]. J Lipid Res,2016,57(8):1327-1328. doi: 10.1194/jlr.E069880 -






 下载:
下载: