Effect of Reasonable Sedation on Image Quality before PET/CT Examination in Children with Epilepsy
-
摘要:
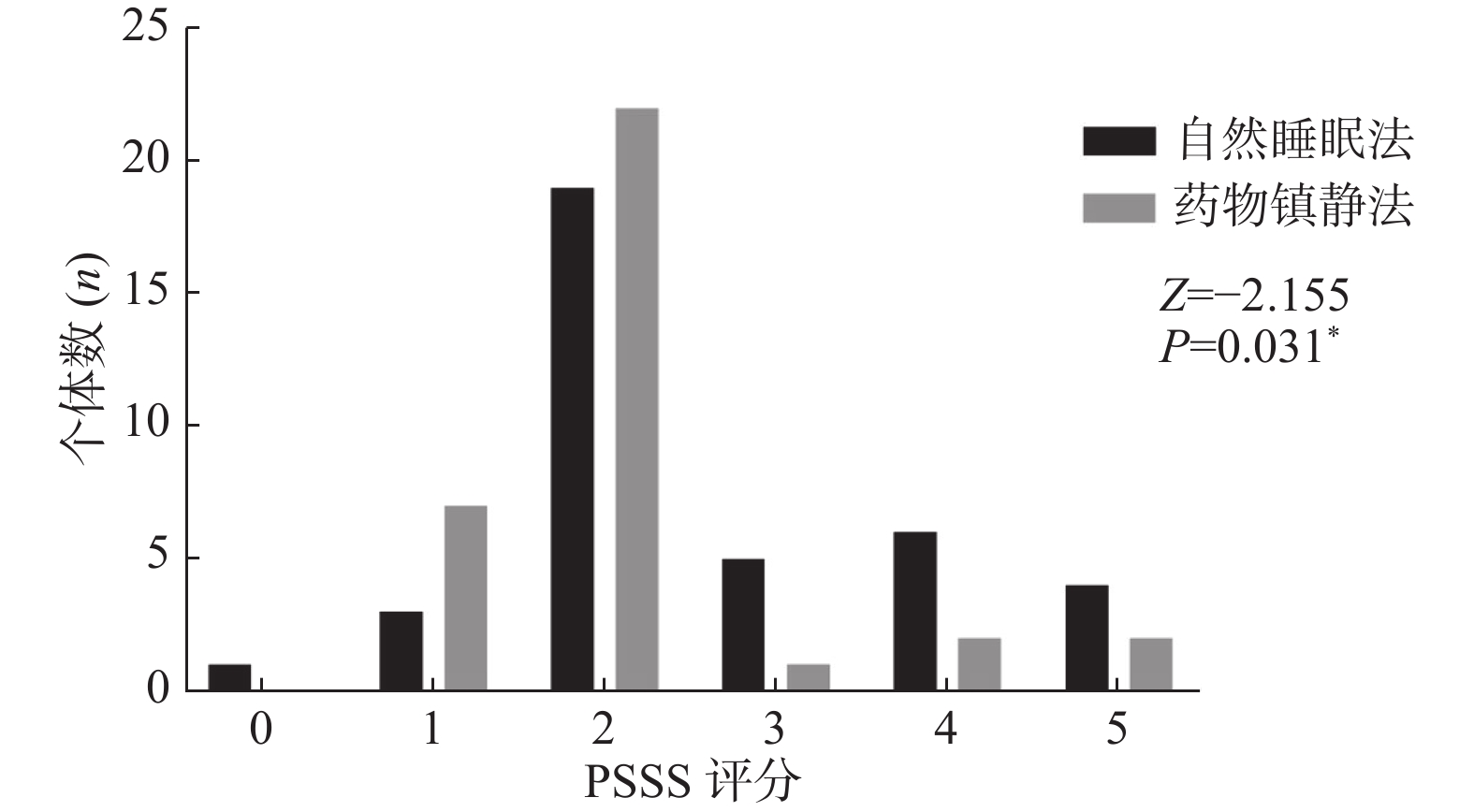
目的 探索自然睡眠法及药物镇静法对小儿癫痫患者检查配合程度及图像质量的影响,指导护理人员掌握2种方法的优缺点。 方法 回顾性分析云南省第一人民医院PET/CT中心自2020年5月至2022年1月共72例(男45例、女27例,年龄1~12岁)小儿癫痫患者资料,所有患儿检查前均采用自然睡眠法及药物镇静法其中之一进行镇静,平静休息1 h后由麻醉师及护师对患儿进行配合程度评分(PSSS评分 0~5分)并进行PET/CT扫描,扫描后由后处理工作站进行图像融合,工作站自动计算图像偏移距离,2名影像医师对影像总体质量、病灶显著程度及图像背景噪声进行评价(Likert评分 1~5分)。采用t检验及秩和检验分析2种镇静方法的差异。 结果 2组患儿仅血糖差异有有统计学意义(P < 0.05),年龄、性别、体重、身长、注射剂量均差异无统计学意义(P > 0.05)。2组患儿PSSS评分分布、图像偏移距离及影像总体质量Likert评分分布差异存在统计学意义(P < 0.05),病灶显著程度及图像背景噪声Likert评分分布无统计学差异(P > 0.05)。 结论 采用药物镇静法患儿PET/CT图像质量优于自然睡眠法,护理人员需要掌握2种方法的优缺点,才能配合监护人灵活应对患儿癫痫PET/CT检查前准备。 Abstract:Objective To explore the effects of natural sleep and drug sedation on the degree of cooperation and image quality in children with epilepsy, and to guide nurses to master the advantages and disadvantages of the two methods. Methods A total of 72 children with epilepsy (45 males and 27 females, aged from 1 to 12 years old) in the PET/CT Center of the First People’s Hospital of Yunnan Province from May 2020 to January 2022 were enrolled retrospectively. all children were sedated by natural sleep and drug the sedation before examination. After resting for 1 hour, the anesthesiologist and nurse scored the cooperation degree (PSSS score 0-5) and performed PET/CT scan. After scanning, the image fusion was performed by the post-processing workstation, and the image offset distance was calculated automatically by the workstation. Two imaging doctors evaluated the overall image quality, lesion saliency and image background noise (Likert score 1-5). T-test and rank sum test was used to analyze the differences between the two sedation methods; the natural sleep method was set to 0 and the drug sedation method was set to 1 for Pearson correlation analysis, and the correlation between the two sedation methods and other scores and indexes was observed. Results There was only significant difference in blood glucose between the two groups (P < 0.05), but there was no significant difference in age, sex, body weight, body length and injection dose between the two groups (P > 0.05). There were significant differences in PSSS score distribution, image offset distance and overall image quality Likert score distribution between the two groups (P < 0.05), but there was no significant difference in lesion significance and image background noise Likert score distribution between the two groups. Correlation analysis showed that the overall Likert score of PET/CT image quality of children with drug sedation was higher (P < 0.05, r>0) and the image offset distance was small (P < 0.05, r < 0). Conclusions The quality of PET/CT images of children with drug sedation is better than that of natural sleep. Nurses need to master the advantages and disadvantages of the two methods in order to cooperate with guardians to flexibly prepare before PET/CT examination of epilepsy. -
Key words:
- Sedation /
- Natural sleep /
- Drug sedation /
- Positron emission tomography /
- Pediatric /
- Epilepsy
-
表 1 患儿一般资料[(
$\bar x \pm s $ )/n(%)]Table 1. Baseline characteristics of patients [(
$\bar x \pm s $ )/n(%)]项目 自然睡眠法(n = 38) 药物镇静法(n = 34) χ2/t P 年龄(岁) 5.840 ± 3.027 6.590 ± 3.465 −0.975 0.333 性别 0.728 0.393 男 22(57.9) 23(67.6) 女 16(42.1) 11(32.4) 体重(kg) 24.490 ± 14.205 26.259 ± 13.408 −0.542 0.590 身长(cm) 115.816 ± 22.221 114.353 ± 26.257 0.256 0.799 血糖水平(mmol/L) 4.668 ± 0.683 4.991 ± 0.493 −2.276 0.026* 注射剂量(MBq) 128.741 ± 66.300 130.425 ± 64.095 −0.109 0.913 *P < 0.05。 -
[1] Guerrini R. Epilepsy in children[J]. The Lancet,2006,367(9509):499-524. doi: 10.1016/s0140-6736(06)68182-8 [2] Juhasz C,John F. Utility of MRI,PET,and ictal SPECT in presurgical evaluation of non-lesional pediatric epilepsy[J]. Seizure,2020,77:15-28. doi: 10.1016/j.seizure.2019.05.008 [3] Tian M,Watanabe Y,Kang K W,et al. International consensus on the use of [(18)F]-FDG PET/CT in pediatric patients affected by epilepsy[J]. Eur J Nucl Med Mol Imaging,2021,48(12):3827-3834. doi: 10.1007/s00259-021-05524-8 [4] Mcguirt D. Alternatives to sedation and general anesthesia in pediatric magnetic resonance Imaging:A literature review[J]. Radiol Technol,2016,88(1):18-26. [5] Schulte-Uentrop L,Goepfert M S. Anaesthesia or sedation for MRI in children[J]. Curr Opin Anaesthesiol,2010,23(4):513-517. doi: 10.1097/ACO.0b013e32833bb524 [6] Kitt E,Friderici J,Kleppel R,et al. Procedural sedation for MRI in children with ADHD[J]. Paediatr Anaesth,2015,25(10):1026-1032. doi: 10.1111/pan.12721 [7] Sauro K M,Wiebe S,Dunkley C,et al. The current state of epilepsy guidelines:A systematic review[J]. Epilepsia,2016,57(1):13-23. doi: 10.1111/epi.13273 [8] Boellaard R,Delgado-Bolton R,Oyen W J,et al. FDG PET/CT:EANM procedure guidelines for tumour imaging:version 2.0[J]. Eur J Nucl Med Mol Imaging,2015,42(2):328-354. doi: 10.1007/s00259-014-2961-x [9] World Medical Association. World Medical Association Declaration of Helsinki:ethical principles for medical research involving human subjects[J]. Jama,2013,310(20):2191-2194. doi: 10.1001/jama.2013.281053 [10] Green S M,Leroy P L,Roback M G,et al. An international multidisciplinary consensus statement on fasting before procedural sedation in adults and children[J]. Anaesthesia,2020,75(3):374-385. doi: 10.1111/anae.14892 [11] 张婉莹,戴燕红,金花,等. 儿童镇静程度评估工具的研究进展[J]. 中华护理杂志,2021,56(11):1644-1648. doi: 10.3761/j.issn.0254-1769.2021.11.007 [12] Cravero J P,Askins N,Sriswasdi P,et al. Validation of the pediatric sedation state scale[J]. Pediatrics,2017,139(5):e20162897. doi: 10.1542/peds.2016-2897 [13] 余冬兰,刘阳萍,易畅,等. PET/CT的PET质量控制[J]. 中国医疗设备,2015,30(05):125-127. doi: 10.3969/J.ISSN.1672-8270.2021.02.041 [14] Zhao Y M,Li Y H,Chen T,et al. Image quality and lesion detectability in low-dose pediatric (18)F-FDG scans using total-body PET/CT[J]. Eur J Nucl Med Mol Imaging,2021,48(11):3378-3385. doi: 10.1007/s00259-021-05304-4 [15] Taylor J S,Keller L,Maybody M. PET/CT-guided interventions in oncology patients:A nursing perspective[J]. J Radiol Nurs,2017,36(2):99-103. doi: 10.1016/j.jradnu.2016.10.014 [16] Brendle C,Stefan N,Grams E,et al. Determinants of activity of brown adipose tissue in lymphoma patients[J]. Sci Rep,2020,10(1):21802. doi: 10.1038/s41598-020-78419-7 [17] Skovgaard D,Kjaer M,El-Ali H,et al. 18F-fluorodeoxyglucose and PET/CT for noninvasive study of exercise-induced glucose uptake in rat skeletal muscle and tendon[J]. Eur J Nucl Med Mol Imaging,2009,36(5):859-868. doi: 10.1007/s00259-008-1020-x [18] Niccoli-Asabella A,Iuele F I,Merenda N,et al. 18F-FDGPET/CT:diabetes and hyperglycaemia[J]. Nucl Med Rev Cent East Eur,2013,16(2):57-61. doi: 10.5603/NMR.2013.0035 [19] Parisi M T,Bermo M S,Alessio A M,et al. Optimization of pediatric PET/CT[J]. Semin Nucl Med,2017,47(3):258-274. doi: 10.1053/j.semnuclmed.2017.01.002 [20] Liu X,Ji J,Zhao G Q. General anesthesia affecting on developing brain:evidence from animal to clinical research[J]. J Anesth,2020,34(5):765-772. doi: 10.1007/s00540-020-02812-9 [21] Warde D J. First death under anesthesia?[J]. Paediatr Anaesth, 2006, 16(9): 1000-1001; author reply 1001. doi: 10.1111/j.1460-9592.2006.01950.x [22] Lee H H,Milgrom P,Starks H,et al. Trends in death associated with pediatric dental sedation and general anesthesia[J]. Paediatr Anaesth,2013,23(8):741-746. doi: 10.1111/pan.12210 [23] Krauss B,Green S M. Procedural sedation and analgesia in children[J]. The Lancet,2006,367(9512):766-780. doi: 10.1016/s0140-6736(06)68230-5 [24] Fong C Y,Lim W K,Li L,et al. Chloral hydrate as a sedating agent for neurodiagnostic procedures in children[J]. Cochrane Database Syst Rev,2021,8(8):CD011786. doi: 10.1002/14651858.CD011786.pub3 [25] Paparella S F. Chloral hydrate:Safety risks still worth mentioning[J]. J Emerg Nurs,2018,44(1):81-83. doi: 10.1016/j.jen.2017.09.002 [26] Vincent J L,Shehabi Y,Walsh T S,et al. Comfort and patient-centred care without excessive sedation:the eCASH concept[J]. Intensive Care Med,2016,42(6):962-971. doi: 10.1007/s00134-016-4297-4 [27] Vade A,Sukhani R,Dolenga M,et al. Chloral hydrate sedation of children undergoing CT and MR imaging:safety as judged by American Academy of Pediatrics guidelines[J]. AJR Am J Roentgenol,1995,165(4):905-909. doi: 10.2214/ajr.165.4.7676990 [28] Pereira J K,Burrows P E,Richards H M,et al. Comparison of sedation regimens for pediatric outpatient CT[J]. Pediatr Radiol,1993,23(5):341-344. doi: 10.1007/BF02011952 -






 下载:
下载: