The Diagnostic Value of Combined Prediction Model for Acute Type A Aortic Dissection Rupture
-
摘要:
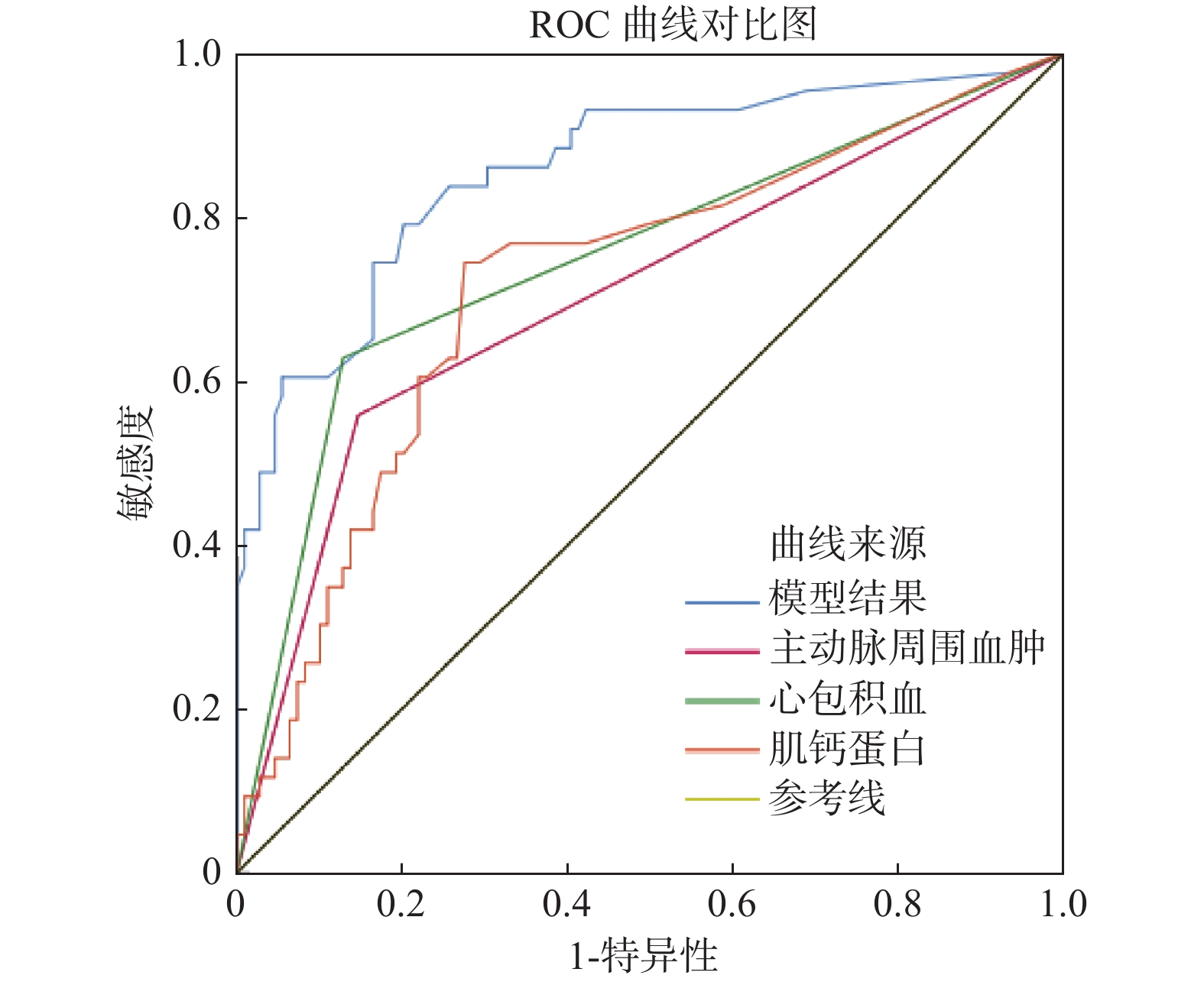
目的 创建了一个联合预测模型并探讨其预测急性A型主动脉夹层(acute type A aortic dissection,ATAAD)破裂风险的价值。 方法 回顾性分析2018年9月至2020年12月在某三甲医院就诊的ATAAD患者的相关资料以及入院后首次肌钙蛋白I(troponin-I,cTn-I)值,根据患者入院后是否发生主动脉破裂死亡将患者分为死亡组(n = 44)和存活组(n = 109)。比较2组患者的一般资料及cTn-I值是否存在差异,并采用二元逻辑回归分析探索ATAAD患者破裂死亡的相关危险因素。 结果 2组患者在晕厥、WBC > 15×109/L、心包积血、主动脉周围血肿方面,差异有统计学意义(P < 0.05),而在其余方面,差异无统计学意义(P > 0.05)。2组患者的cTn-I值差异有统计学意义(P < 0.05)。晕厥、WBC > 15×109/L、心包积血、主动脉周围血肿及cTn-I被纳入二元逻辑回归分析。多因素分析表明心包积血、主动脉周围血肿、cTn-I水平的差异有统计学意义,联合上述因素创建的联合模型预测ATAAD破裂死亡的AUC为0.859(P < 0.05)。 结论 联合预测模型对预测ATAAD破裂具有一定预测价值。 Abstract:Objective To create a combined model and explore its value in predicting the rupture risk of acute type A aortic dissection (ATAAD). Methods The relevant data and the first cTn-I value of the ATAAD patients admitted and treated in a tertiary hospital from September 2018 to December 2020 were collected and analyzed retrospectively. The patients were divided into the dead group according to whether they died after admission (n = 44) and the survival group (n = 109). The general data and cTn-I value of the two groups were compared, and a binary logistic regression analysis was used to explore the risk factors related to the in-hospital rupture of ATAAD. Results There were significant differences in syncope, WBC > 15×109/L, pericardium, and periaortic hematoma between the two groups (P < 0.05), but no significant differences in other aspects (P > 0.05). There was significant difference in cTn-I value between the two groups (P < 0.05). Syncope, WBC > 15×109/L, pericardium, periaortic hematoma and cTn-I were included in binary logistic regression analysis. The results showed that there were significant differences in the multivariate analysis of pericardium, periaortic hematoma, and cTn-I value. The combined model created by combining the above factors predicted the AUC of ATAAD rupture was 0.859 (P < 0.05). Conclusion The joint prediction model has the prediction performance. -
Key words:
- Acute type A aortic dissection /
- Joint prediction model /
- Rupture
-
表 1 2组患者的一般情况分析[(
$ \bar x \pm s $ )/n(%)]Table 1. The analysis of normal data from two groups[(
$ \bar x \pm s $ )/n(%)]组别 破裂组(n = 44) 未破裂组(n = 109) χ2/t P 男
女32(72.72)
12(27.27)83(76.14)
26(23.85)
0.196
0.658平均年龄(岁) 57.23 ± 11.45 53.53 ± 12.81 1.668 0.097 高血压 17(38.63) 42(38.53) 0.005 0.099 晕厥 9(20.50) 6(5.50) 7.923 0.012* 双下肢麻木/疼痛 9(2.05) 17(15.60) 0.525 0.469 De Bekey I 型 41(93.18) 90(82.57) 2.868 0.090 头臂干受累 30(68.18) 58(53.21) 2.875 0.090 急性肝损伤 16(36.36) 33(30.28) 0.534 0.465 WBC>15×109/L 15(34.09) 20(18.35) 4.403 0.036* 心包积血 28(63.64) 14(12.84) 40.606 0.005* 主动脉周围血肿 25(56.82) 16(14.68) 28.375 0.005* 胸腔积液 15(34.09) 38(34.86) 0.086 0.928 肾动脉受累 20(45.45) 42(38.53) 0.623 0.430 入院时BP>160 mmHg 12(27.27) 27(24.77) 0.103 0.748 主动脉大小(cm) 4.75 ± 0.66 4.81 ± 0.85 −0.452 0.656 AHI(kg/m2) 2.92 ± 0.43 2.92 ± 0.50 −0.114 0.913 BMI(cm/m) 22.69 ± 1.84 22.07 ± 2.02 1.780 0.076 *P < 0.05。 表 2 2组患者的cTn-I值比较
Table 2. The comparison of cTn-I value from two groups
组别 破裂组 未破裂组 检验值 P cTn-I(ng/mL) 0.17(0.04,0.78) 0.02(0.01,0.10) Z = −4.27 0.012* *P < 0.05。 表 3 组间具有差异性因素的二元逻辑回归分析
Table 3. The binary logistic regression analysis for the factors with difference
常量 参照类别 B S.E Wals. P OR 95%CI 晕厥 是 1.367 0.737 3.443 0.064 3.924 0.926~16.624 WBC>15×109/L 是 0.925 0.540 2.933 0.087 2.541 0.875~7.267 心包积血 是 2.270 0.494 21.106 0.001* 9.684 3.676~25.512 主动脉周围血肿 是 1.930 0.499 14.949 0.001* 6.891 2.590~18.332 cTn-I 是 0.480 0.222 4.652 0.031* 1.615 1.045~2.498 常量 3.509 0.964 13.241 0.001* 33.419 *P < 0.05。 表 4 各因素与联合预测模型的AUC
Table 4. The area under the curve of factors and combined model
组别 AUC S.E 95%CI 敏感度(%) 特异度(%) 约登指数 截断值 P 主动脉周围血肿 0.706 0.050 0.607~0.805 55.8 85.1 0.411 0.500 0.001* 心包积血 0.750 0.048 0.655~0.844 62.8 85.3 0.499 0.500 0.001* cTn-I 0.720 0.048 0.626~0.813 74.4 72.5 0.469 0.075 0.001* 联合预测模型 0.859 0.037 0.787~0.931 79.1 79.8 0.589 5.473 0.001* 注:AUC大于0.5提示具有一定预测能力;*P < 0.05。 -
[1] 陶惠明,冷巧云,刘汉,等. “胸痛中心”对主动脉夹层患者诊疗及预后的影响[J]. 内科急危重症杂志,2018,24(6):459-462. [2] Guo T,Fang Z,Yang G,et al. Machine learning models for predicting in-hospital mortality in acute aortic dissection patients[J]. Front Cardiovasc Med,2021,8(1):727773. [3] 叶绍东,黎励文,蔺亚晖,等. 规范应用心肌肌钙蛋白和利钠肽现场快速检测专家共识(2020年)[J]. 中国循环杂志,2020,35(11):1045-1051. doi: 10.3969/j.issn.1000-3614.2020.11.001 [4] Wen M,Han Y,Ye J,et al. Peri-operative risk factors for in-hospital mortality in acute type A aortic dissection[J]. J Thorac Dis,2019,11(9):3887-3895. doi: 10.21037/jtd.2019.09.11 [5] Lippi G,Cervellin G,Sanchis-Gomar F. Predicting mortality with cardiac troponins: Recent insights from meta-analyses[J]. Diagnosis,2021,8(1):37-49. doi: 10.1515/dx-2019-0061 [6] Wang Z,Tao L,Yan Y,et al. Rationale and design of a prospective,multicentre,randomised,conventional treatment-controlled,parallel-group trial to evaluate the efficacy and safety of ulinastatin in preventing acute respiratory distress syndrome in high-risk patients[J]. BMJ Open,2019,9(3):e025523. doi: 10.1136/bmjopen-2018-025523 [7] Han C H,Guan Z B,Zhang P X,et al. Oxidative stress induced necroptosis activation is involved in the pathogenesis of hyperoxic acute lung injury[J]. Biochem Bioph Res Co,2018,495(3):2178-2183. doi: 10.1016/j.bbrc.2017.12.100 [8] 易定华,段维勋. 中国主动脉夹层诊疗现状与展望[J]. 中国循环杂志,2013,28(1):1-2. doi: 10.3969/j.issn.1000-3614.2013.01.001 [9] 赵锐,吴进林,丘俊涛,等. 主动脉夹层多中心注册数据库概况[J]. 中华外科杂志,2020,58(8):604-607. [10] 中国医师协会心血管外科分会大血管外科专业委员会. 主动脉夹层诊断与治疗规范中国专家共识[J]. 中华胸心血管外科杂志,2017,33(11):641-654. doi: 10.3760/cma.j.issn.1001-4497.2017.11.001 [11] 霍勇. 中国胸痛中心建设理论与医学模式[J]. 中国介入心脏病学杂志,2021,29(1):1-3. doi: 10.3969/j.issn.1004-8812.2021.01.001 [12] Fan J,Hammonds K,Izekor B,et al. Association of maximum troponin levels with diagnosis of acute myocardial infarction and elevated risk of mortality[J]. Ochsner J,2021,21(3):261-266. doi: 10.31486/toj.20.0135 [13] 石国欣,冯磊光,宋志伟,等. 急性心肌梗死早期诊断的血清标志物研究进展[J]. 医学综述,2020,26(22):4528-4532. [14] Eggers K M,Lindahl B. Application of cardiac coronary syndrome[J]. Clin Chem,2017,63(1):223-235. [15] Pourafkari L,Tajlil A,Ghaffari S,et al. Electrocardiography changes in acute aortic dissection-association with troponin leak,coronary anatomy,and prognosis[J]. Am J Emerg Med,2016,34(8):1431-1436. doi: 10.1016/j.ajem.2016.04.024 [16] Vrsalovic M. Prognostic effect of cardiac troponin elevation in acute aortic dissection: A meta-analysis[J]. Int J Cardiol,2016(214):277-278. [17] 李卓东. 急性Stanford A型主动脉夹层临床分析及住院死亡危险因素探讨[D]. 上海: 中国人民解放军海军军医大学博士学位论文, 2018. [18] Li Z D,Liu Y,Zhu J,et al. Risk factors of pre-operational aortic rupture in acute and subacute stanford type A aortic dissection patients[J]. J Thorac Dis,2017,9(12):4979-4987. doi: 10.21037/jtd.2017.11.59 [19] Wu,J,Qiu J,Xie E,et al. Predicting in-hospital rupture of type A aortic dissection using random forest[J]. J Thorac Dis,2019,11(11):4634-4646. doi: 10.21037/jtd.2019.10.82 [20] 颜建辉,邝爱玲. D-二聚体联合B超早期诊断主动脉夹层的临床应用价值[J]. 临床急诊杂志,2020,21(6):461-464. -






 下载:
下载: