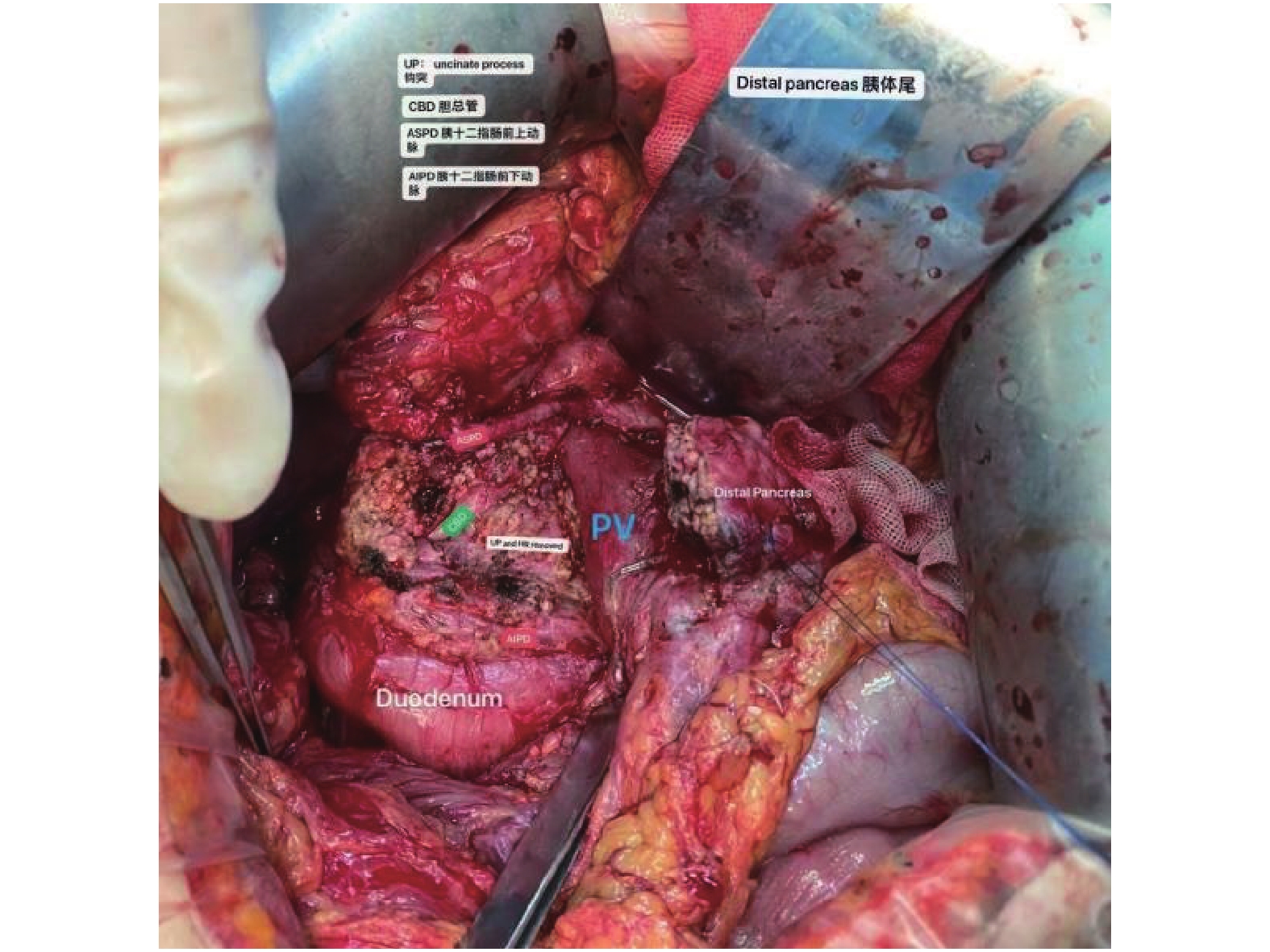
Clinical Effect of Duodenum-Preserving Pancreaticohead Resection And Pancreaticojejunostomy for Pancreatic Head Calculi
-
摘要:
目的 探讨保留十二指肠的胰头切除术(duodenum-preserving pancreatic head resection,DPPHR)与胰管切开取石胰腺管空肠吻合术(Partington手术)对于胰腺头部结石手术治疗的疗效差别,评估二者手术的优缺点,并对其进行一定的优化和改进。 方法 通过回顾性分析2017年1月1日至2022年10月1日以来,昆明医科大学第二附属医院肝胆胰外科一至四病区收治的139例需行手术治疗的胰腺头部结石患者的临床、影像和病理资料;根据对患者所施行的手术方式不同,将其分为DPPHR组和Partington组,分析2组患者临床特征以及外科治疗的近期和远期疗效。 结果 术前一般资料分析差异均无统计学意义(P > 0.05);DPPHR组以Ⅰ型结石为主(80.2%),而Partington组以Ⅰ、Ⅲ型结石为主(45.3%、47.2%),差异有统计学意义( P < 0.001);近期疗效中,DPPHR组在手术时间、术中出血量、术后住院天数和术后并发症发生率方面较Partington组具优势( P <0.05);远期疗效中,DPPHR组在结石复发再手术、术后胰腺功能等方面均优于Partington组(P <0.05);Logistic多因素分析显示CP≥5 a (95%CI 1.057~3.884,P = 0.012)、术后长期有饮酒史(95%CI 0.987~3.128,P = 0.025),CP≥5a和术后长期有饮酒史均是影响胰腺头部结石术后无疼痛复发生存期的独立危险因素。 结论 胰腺头部结石患者近期疗效(手术时间、术中出血量、术后住院天数和术后并发症发生率)和远期疗效(结石复发再手术、术后胰腺功能)分析,DPPHR手术均优于Partington术,可认为DPPHR手术目前成为一种有效的治疗PDS的方法;但还需为患者制定个体化手术策略,并重视术后护理和随访,以便为患者提供最佳预后。 -
关键词:
- 保留十二指肠的胰头切除术 /
- 胰管切开取石胰腺管空肠吻合术 /
- 慢性胰腺炎 /
- 胰头结石
Abstract:Objective To explore the difference between duodenum-preserving pancreatic head resection (DPPHR) and pancreatic-preserving pancreatic duct jejunostomy (Partington operation) in the treatment of pancreatic head calculus, and evaluate the advantages and disadvantages of the two operations, and optimize and improve them. Methods From January 1, 2017 to October 1, 2022, the clinical, imaging and pathological data of 139 patients with pancreatic head stones requiring surgical treatment admitted to the Department of Hepatobiliary and Pancreatic Surgery, the Second Affiliated Hospital of Kunming Medical University were retrospectively analyzed. According to the different surgical methods, the patients were divided into DPPHR group and Partington group. The clinical characteristics of patients in the two groups and the short-term and long-term outcomes of surgical treatment were analyzed. Results There was no significant difference in preoperative general data (P > 0.05). Type Ⅰ stones were predominant in DPPHR group (80.2%), while type Ⅰ and Ⅲ stones were predominant in Partington group (45.3%, 47.2%), and the difference was statistically significant ( P < 0.001). In terms of short-term efficacy, DPPHR group had advantages over Partington group in terms of operation time, intraoperative blood loss, postoperative hospital stay and postoperative complication rate ( P < 0.05). In the long-term efficacy, the DPPHR group was better than the Partington group in stone recurrence reoperation and postoperative pancreatic function ( P < 0.05). Logistic multivariate analysis showed that CP≥5 a (95%CI 1.057-3.884, P = 0.012) and long postoperative drinking history (95%CI 0.987-3.128, P = 0.025). CP≥5 a and a long history of postoperative alcohol consumption were independent risk factors for survival without pain recurrence after pancreatic head calculi surgery Conclusions Based on the analysis of the short-term efficacy (operation time, intraoperative blood loss, postoperative hospital stay and postoperative complication rate) and long-term efficacy (stone recurrence and reoperation, postoperative pancreatic function) of patients with pancreatic head calculi in this study, DPPHR surgery was superior to Partington surgery, suggesting that DPPHR surgery has become an effective treatment for PDS at present. However, it is also necessary to develop an individualized surgical strategy for the patient, with emphasis on postoperative care and follow-up to provide the best outcome for the patient. -
Key words:
- DPPHR /
- Partington /
- Chronic pancreatitis /
- Pancreatic head stone
-
表 1 临床特征比较[n(%)/
$ \bar x \pm s $ ]Table 1. Comparison of clinical characteristics [n(%)/
$ \bar x \pm s $ ]临床特征 DPPHR组(n = 86) Partington组(n = 53) t/χ2 P CP病程(月) 0.018 0.999 < 6 28(32.6) 17(32.1) 6~24 16(18.6) 10(18.9) 25~60 20(23.3) 12(22.6) > 60 22(25.5) 14(26.4) CP分期 1.174 0.759 早期 2(2.3) 2(3.8) 进展期 26(30.2) 18(34.0) 并发症期 28(32.6) 13(24.5) 终末期 30(34.9) 20(37.7) 肿瘤标记物增高a 27(31.4) 9(17.0) 3.550 0.060 胰腺内分泌功能不全 29(33.7) 17(32.1) 0.040 0.841 胰腺外分泌功能不全 15(17.4) 8(15.1) 0.131 0.718 注:a指肿瘤标记物检查中任意CA19-9、CA12-5或CEA升高1项。 表 2 影像学特征比较[n(%)]
Table 2. Comparison of imaging features [n(%)]
临床特征 DPPHR组(n = 86) Partington组(n = 53) t/χ2 P 结石分型 24.810 < 0.001 * Ⅰ型 69(80.2) 24(45.3) Ⅱ型 4(4.7) 1(1.9) Ⅲ型 9(10.5) 25(47.2) Ⅳ型 4(4.7) 3(5.7) 结石大小(mm) 2.404 0.301 ≥13 17(19.8) 16(30.2) 7~13 44(51.2) 26(49.1) < 7 25(29.1) 11(20.8) 胰腺明显萎缩 25(29.1) 27(50.9) 6.701 0.010* 胰头肿大 33(38.4) 6(11.3) 11.888 0.001* 胆总管扩张或受压迫 44(51.2) 14(26.4) 8.259 0.004* 合并其他并发症a 29(33.7) 9(17.0) 4.626 0.031* 注:a表示包括胰腺真/假性囊肿、压迫门静脉或脾静脉、压迫导致门脉高压症等;*P < 0.05。 表 3 术中指标比较[n(%)/
$ \bar x \pm s $ ]Table 3. Comparison of intraoperative indicators [n(%)/
$ \bar x \pm s $ ]项目 DPPHR组(n = 86) Partington组(n = 53) t/χ2 P 术中出血(mL) 234.50 ± 85.47 270.50 ± 105.11 −0.460 0.669 手术时间(min) 385.47 ± 92.60 311.00 ± 62.34 2.601 0.014* 术中输血 5(5.8) 3(5.7) 0.001 0.970 *P < 0.05。 表 4 费用及住院时间比较(
$ \bar x \pm s $ )Table 4. Comparison of cost and length of hospital stay (
$ \bar x \pm s $ )项目 DPPHR组(n = 86) Partington组(n = 53) t P 术后住院天数(d) 8.98 ± 0.24 14.28 ± 2.42 −3.771 0.020* 住院总费用(万元) 4.25 ± 1.12 5.95 ± 1.67 2.856 0.046* 术后阵痛时间(d) 0.78 ± 0.65 2.64 ± 0.66 −3.503 0.025* *P < 0.05。 表 5 术后并发症比较[n(%)]
Table 5. Comparison of postoperative complications [n(%)]
项目 DPPHR组(n = 86) Partington组(n = 53) χ2 P 残留结石发生率 21(24.4) 34(64.2) 21.649 < 0.001 * 术后并发症发生率 腹腔感染 2(2.3) 6(11.3) 4.892 0.027* 胰漏 6(7.0) 3(5.7) 0.094 0.759 胆漏 1(1.2) 5(9.4) 5.432 0.020* 呕吐 12(14.0) 10(19.2) 0.673 0.412 术后发热 6(7.0) 7(13.2) 1.502 0.220 胸腔积液 0(0.0) 3(5.7) 4.975 0.026* 肺部感染 0(0.0) 3(5.7) 4.975 0.026* 术后出血 1(1.2) 6(11.3) 7.075 0.008* 胃排空障碍 13(15.1) 29(54.7) 24.388 < 0.001 * 术后胰腺功能障碍 1(1.2) 12(22.6) 17.844 < 0.001 * Clavien-Dindo分级 Ⅰ 24(100.0) 15(57.7) Ⅱ 0(0.0) 9(34.6) 13.018 0.001* Ⅲa/b 0(0.0) 2(7.7) 并发症再手术 0(0.0) 2(3.8) 3.940 0.048* 并发症相关死亡 0(0.0) 0(0) − − 术后疼痛缓解率 84(97.7) 46(86.8) 6.412 0.011* *P < 0.05;-表示无数据。 表 6 远期疗效分析比较[n(%)/
$ \bar x \pm s $ ]Table 6. Comparison of long-term efficacy analysis [n(%)/
$ \bar x \pm s $ ]随访指标 DPPHR组(n = 86) Partington组(n = 53) t/χ2 P 新发结石 3(3.5) 11(20.8) 10.793 0.001* 体重变化(kg) 2.51 ± 1.19 2.88 ± 2.08 −0.267 0.802 胰腺内分泌功能障碍 1(1.1) 10(18.9) 14.282 < 0.001 * 胰腺外分泌功能障碍 5(5.8) 19(35.8) 20.708 < 0.001 * 术后脂肪肝 8(9.3) 16(30.2) 10.014 0.002* 总远期并发症 2(2.3) 15(28.3) 26.475 < 0.001 * 再次入院治疗 2(2.3) 5(9.4) 3.465 0.063 再次手术治疗 2(2.3) 3(11.3) 1.052 0.305 *P < 0.05。 表 7 远期并发症比较[n(%)]
Table 7. Comparison of long-term complications [n(%)]
并发症 DPPHR组(n = 86) Partington组(n = 53) χ2 P 胰肠吻合口溃疡 0(0) 3(5.7) 4.975 0.026* 胰肠吻合口出血 0(0) 4(7.5) 6.683 0.010* 胰肠吻合口漏 2(2.3) 3(5.7) 4.975 0.026* 胃溃疡 0(0) 3(5.7) 4.975 0.026* 消化道出血 0(0) 2(3.8) 3.293 0.070 *P < 0.05。 表 8 影响患者胰头结石术后无疼痛复发的单因素比较
Table 8. Comparison of single factors affecting the postoperative pain recurrence of patients with pancreatic head stones
临床因素 n 生存时间[月,均数(范围)] χ2 P 性别 0.082 0.751 男 111 20.74(15.69~24.83) 女 35 18.51(12.31~23.58) 年龄(岁) 0.388 0.857 < 35 34 19.57(15.39~27.58) 35~50 76 21.03(16.53~29.74) > 50 29 13.76(8.59~25.81) BMI(kg/m2) 0.517 0.682 < 18.5 24 20.91(11.86~32.53) 18.5~24.0 99 19.94(13.62~30.28) > 24.0 16 16.69(11.28~29.70) CP病程(a) 11.375 0.002* < 5 103 21.62(16.84~27.33) ≥5 36 16.58(12.89~21.05) CP分期 2.519 0.473 早期 4 7.55(5.29~12.53) 进展期 44 21.01(11.06~25.92) 并发症期 41 19.26(13.75~29.67) 终末期 50 20.52(12.66~31.86) 手术方式 0.316 0.935 DPPHR 86 20.28(14.59~27.81) Partington 53 20.13(13.24~26.46) 术后长期吸烟 1.057 0.129 是 44 19.28(13.59~25.70) 否 95 22.15(16.28~30.11) 术后长期饮酒 9.446 0.003* 是 25 16.48(10.90~20.54) 否 114 21.25(16.83~27.95) *P < 0.05。 -
[1] Talukdar R,Unnisa M. Optimizing nutrition in chronic pancreatitis[J]. Curr Opin Gastroenterol,2022,38(5):495-500. doi: 10.1097/MOG.0000000000000866 [2] Bundred J,Thakkar R G,Pandanaboyana S. Systematic review of sarcopenia in chronic pancreatitis: prevalence,impact on surgical outcomes,and survival[J]. Expert Rev Gastroenterol Hepatol,2022,16(7):665-672. doi: 10.1080/17474124.2022.2091544 [3] Okazaki K,Kawa S,Kamisawa T,et al. Amendment of the Japanese consensus guidelines for autoimmune pancreatitis,2020[J]. J Gastroenterol,2022,57(4):225-245. doi: 10.1007/s00535-022-01857-9 [4] Khan M N,Raza S S,Hussain A K,et al. Pancreatic duct stones[J]. J Ayub Med Coll Abbottabad,2017,29(1):154-156. [5] Büchler M W,Friess H,Bittner R,et al. Duodenum-preserving pancreatic head resection: Long-term results[J]. J Gastrointest Surg,1997,1(1):13-19. doi: 10.1007/s11605-006-0004-z [6] Beger H G,Mayer B,Poch B. Duodenum-preserving pancreatic head resection: A local parenchyma-sparing treatment of benign and premalignant tumors of the pancreatic head[J]. Chirurg,2019,90(9):736-743. doi: 10.1007/s00104-019-0942-0 [7] Beger H G,Mayer B. Duodenum-preserving pancreatic head resection in chronic pancreatitis: Limitations of the Heidelberg multicenter ChroPac study[J]. Chirurg,2018,89(5):392-396. doi: 10.1007/s00104-018-0615-4 [8] Boni L,Huo B,Alberici L,et al. EAES rapid guideline: updated systematic review,network meta-analysis,CINeMA and GRADE assessment,and evidence-informed European recommendations on the management of common bile duct stones[J]. Surg Endosc,2022,36(11):7863-7876. doi: 10.1007/s00464-022-09662-4 [9] 沈磊,杨自轩,丁睿博,等. 胰管结石诊治进展[J]. 中华肝胆外科杂志,2022,28(4):317-320. doi: 10.3760/cma.j.cn113884-20211108-00360 [10] Jeon C Y,Chen Q,Yu W,et al. Identification of individuals at increased risk for pancreatic cancer in a community-based cohort of patients with suspected chronic pancreatitis[J]. Clin Transl Gastroenterol,2020,11(4):e00147. doi: 10.14309/ctg.0000000000000147 [11] Beyna T,Neuhaus H,Gerges C. Endoscopic treatment of pancreatic duct stones under direct vision: Revolution or resignation? Systematic review[J]. Dig Endosc,2018,30(1):29-37. doi: 10.1111/den.12909 [12] Adler J M,Gardner T B. Endoscopic therapies for chronic pancreatitis[J]. Dig Dis Sci,2017,62(7):1729-1737. doi: 10.1007/s10620-017-4502-5 [13] Farkas G,Leindler L,Daróczi M,et al. Prospective randomised comparison of organ-preserving pancreatic head resection with pylorus-preserving pancreaticoduodenectomy[J]. Langenbecks Arch Surg,2006,391(4):338-342. doi: 10.1007/s00423-006-0051-7 [14] Busquets J,Martín S,Secanella L,et al. Delayed gastric emptying after classical Whipple or pylorus-preserving pancreatoduodenectomy: a randomized clinical trial[J]. Langenbecks Arch Surg,2022,407(6):2247-2258. doi: 10.1007/s00423-022-02583-9 [15] Keck T,Adam U,Makowiec F,et al. Short- and long-term results of duodenum preservation versus resection for the management of chronic pancreatitis: a prospective,randomized study[J]. Surgery,2012,152(3):S95-S102. doi: 10.1016/j.surg.2012.05.016 [16] Boregowda U,Echavarria J,Umapathy C,et al. Endoscopy versus early surgery for the management of chronic pancreatitis: a systematic review and meta-analysis[J]. Surg Endosc,2022,36(12):8753-8763. doi: 10.1007/s00464-022-09425-1 [17] Guzmán-Calderón E,Martinez-Moreno B,Casellas J A,et al. Per-oral pancreatoscopy-guided lithotripsy for the endoscopic management of pancreatolithiasis: A systematic review and meta-analysis[J]. J Dig Dis,2021,22(10):572-581. doi: 10.1111/1751-2980.13041 [18] Zhao X,Cui N,Wang X,et al. Surgical strategies in the treatment of chronic pancreatitis: An updated systematic review and meta-analysis of randomized controlled trials[J]. Medicine (Baltimore),2017,96(9):e6220. [19] McCarty T R,Sobani Z,Rustagi T. Per-oral pancreatoscopy with intraductal lithotripsy for difficult pancreatic duct stones: a systematic review and meta-analysis[J]. Endosc Int Open,2020,8(10):E1460-E1470. doi: 10.1055/a-1236-3187 [20] Gerges C,Pullmann D,Schneider M,et al. Pancreatoscopy in endoscopic treatment of pancreatic duct stones: a systematic review[J]. Minerva Chir,2019,74(4):334-347. [21] Malka D,Hammel P,Sauvanet A,et al. Risk factors for diabetes mellitus in chronic pancreatitis[J]. Gastroenterology,2000,119(5):1324-1332. doi: 10.1053/gast.2000.19286 [22] Ueda J,Miyasaka Y,Ohtsuka T,et al. Short- and long-term results of the Frey procedure for chronic pancreatitis[J]. J Hepatobiliary Pancreat Sci,2015,22(3):211-216. doi: 10.1002/jhbp.176 -






 下载:
下载: