Voluntary Exercise Training Attenuated the Proliferation and Growth of Human Breast Cancer with BRCA1 Mutation by Regulating Caspase-3 Activity
-
摘要:
目的 探讨自主运动训练在乳腺癌发生发展中的作用及其机制。 方法 将携带原发性人乳腺癌基因1(breast cancer gene 1,BRCA-1)突变基因的癌细胞在体外进行培养,用连续14 d自主跑轮运动鼠血清以及静坐鼠血清处理BRCA-1突变肿瘤细胞,并将上述条件血清培养的乳腺癌细胞注射到BALB/c裸鼠皮下,观察经过不同处理后体内外BRCA-1突变乳腺癌细胞及移植瘤的情况。 结果 在体外,与静坐鼠血清处理组相比,自主运动鼠血清处理后抑制了BRCA-1突变乳腺癌细胞的活力、生长,促进其凋亡,差异具有统计学意义(P < 0.05);在体内,自主运动鼠血清培养的BRCA-1突变乳腺癌细胞移植瘤较静坐对照组体积减小、生长缓慢(P < 0.05),体内外自主运动组均呈现出增强的Caspase-3活性(P < 0.05)。 结论 自主跑轮运动可能通过增强Caspase3的活性、抑制了BRCA1突变乳腺癌细胞以及其在BALB/c裸鼠皮下异种移植瘤的增殖、促进肿瘤细胞凋亡,从而抑制其体内外的生长。 Abstract:Objective This study aims to explore the role and mechanism of voluntary exercise training in the development and progression of breast cancer. Methods Primary human Breast Cancer gene 1-mutation (BRCA-1 mutation) cancer cells were cultured in vitro, before treated with the serum of wheel running rats and sedentary rats for 14 consecutive days. The cells cultured in above conditions were injected subcutaneously into BALB/c nude mice to observe the in vitro and in vivo breast cancer cells with BRCA-1 mutation and tumor transplantation after different interventions. Results In vitro, compared with sedentary rat serum group, the activity and growth of BRCA-1 mutant breast cancer cells were inhibited and apoptosis was promoted after in the wheel running group. In vivo, the grafts of BRCA-1 mutated breast cancer cells cultured from in the wheel running group decreased in volume and grew slower compared with the sedentary group, and the wheel running group showed enhanced Caspase-3 activity both in vivo and in vitro. Conclusion Voluntary wheel running may attenuate the growth of BRCA1 mutant breast cancer cells and their proliferation and apoptosis in BALB/c nude mice by enhancing the activity of Caspase3, thus inhibiting the growth of breast cancer cells in vitro and in vivo. -
Key words:
- Breast cancer /
- Breast Cancer (BRCA) gene 1 /
- Voluntary running wheel /
- Proliferation /
- Apoptosis
-
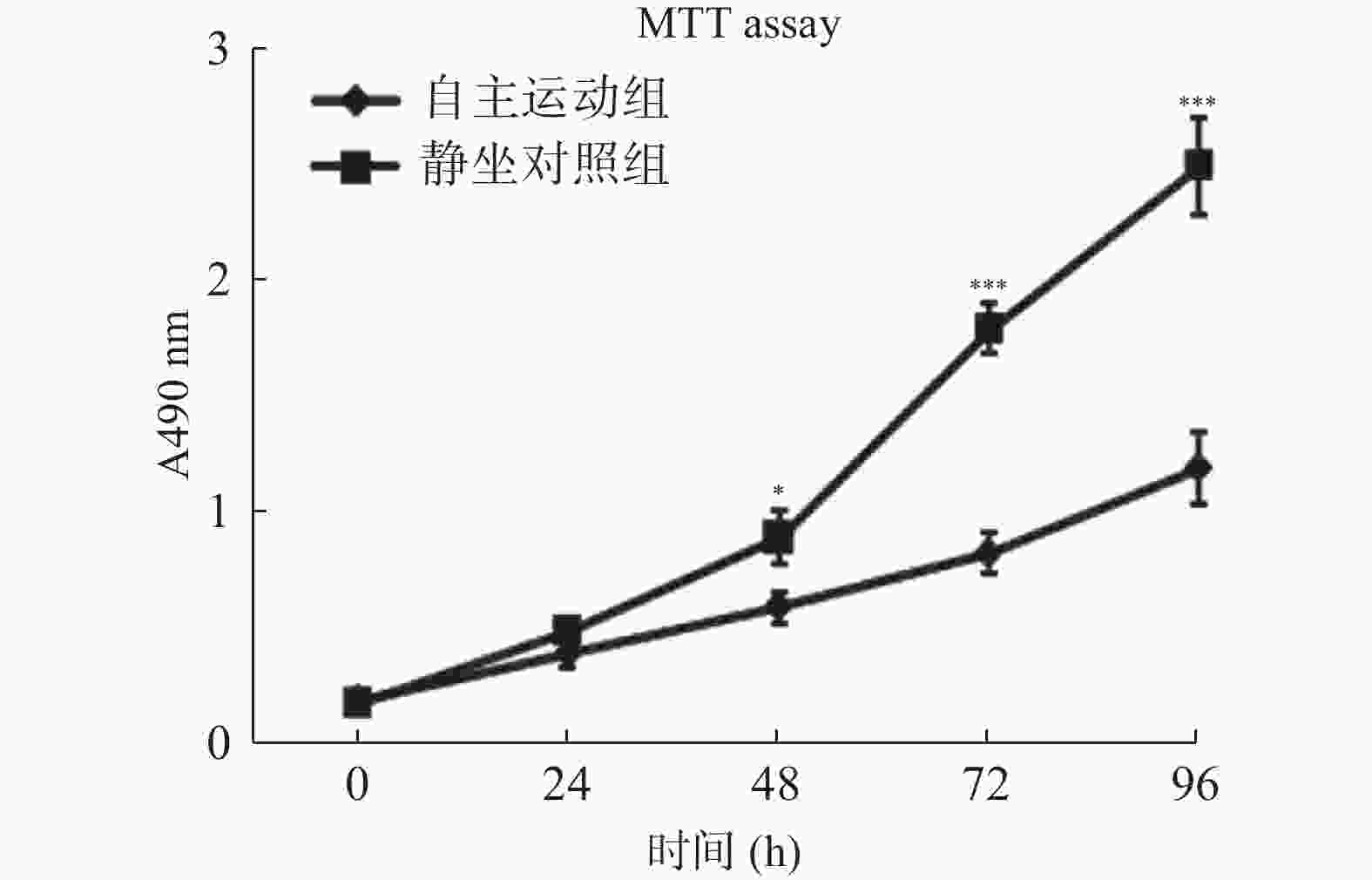
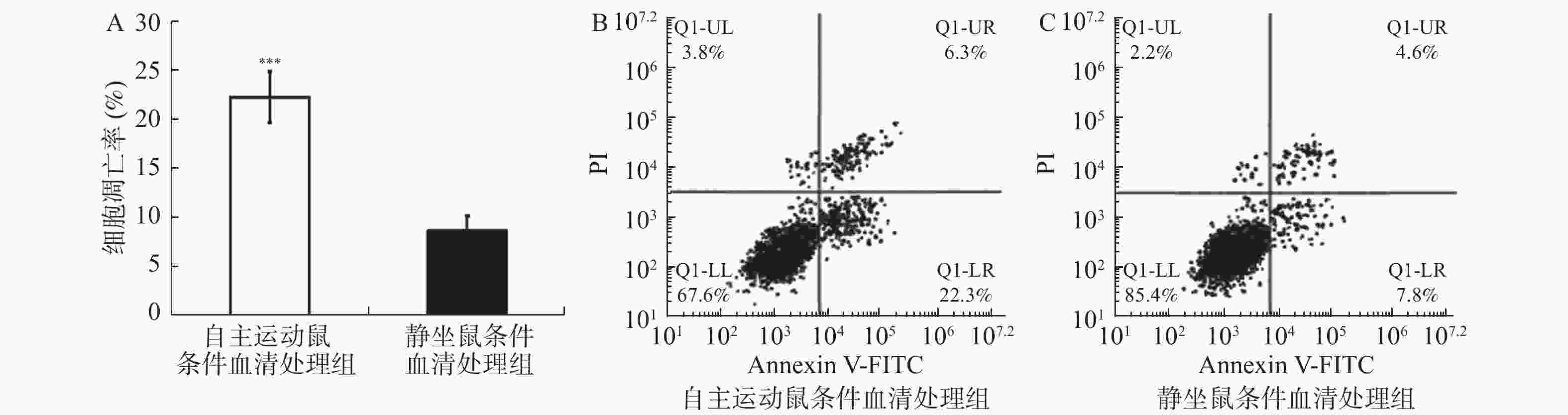
图 3 自主跑轮运动鼠条件血清处理促进了乳腺癌细胞的凋亡
流式细胞术检测自主运动鼠条件血清及静坐鼠条件血清处理后BRCA1-mut细胞在体外的凋亡情况。A:2组乳腺癌BRCA1-mut细胞的凋亡率比较;B:2组经流式检测显示乳腺癌BRCA1-mut细胞呈现不同的对PI(提示细胞死亡)与Annexin V-FITC荧光染料(提示细胞凋亡)的着色比率,自主运动鼠条件血清处理后有更多的细胞发生凋亡。与静坐鼠条件血清处理组相比:*P < 0.05,**P < 0.01,***P < 0.001。
Figure 3. Conditioned serum treatment promotes apoptosis of breast cancer cells
图 4 自主跑轮运动抑制了BRCA1-mut乳腺癌移植瘤在裸鼠体内的生长
A:自BRCA1-mut细胞皮下注射开始至第77天期间2组裸鼠移植瘤的体积比较;B:BRCA1-mut细胞皮下移植注射后77天分离2组裸鼠皮下肿瘤的代表性对比图;C:BRCA1-mut细胞皮下注射后第77天观察结束时2组裸鼠移植瘤的重量比较。与静坐对照组相比:*P < 0.05,**P < 0.01,***P < 0.001。
Figure 4. Voluntary running wheel exercise inhibites the growth of BRCA1-mut breast cancer grafts in nude mice
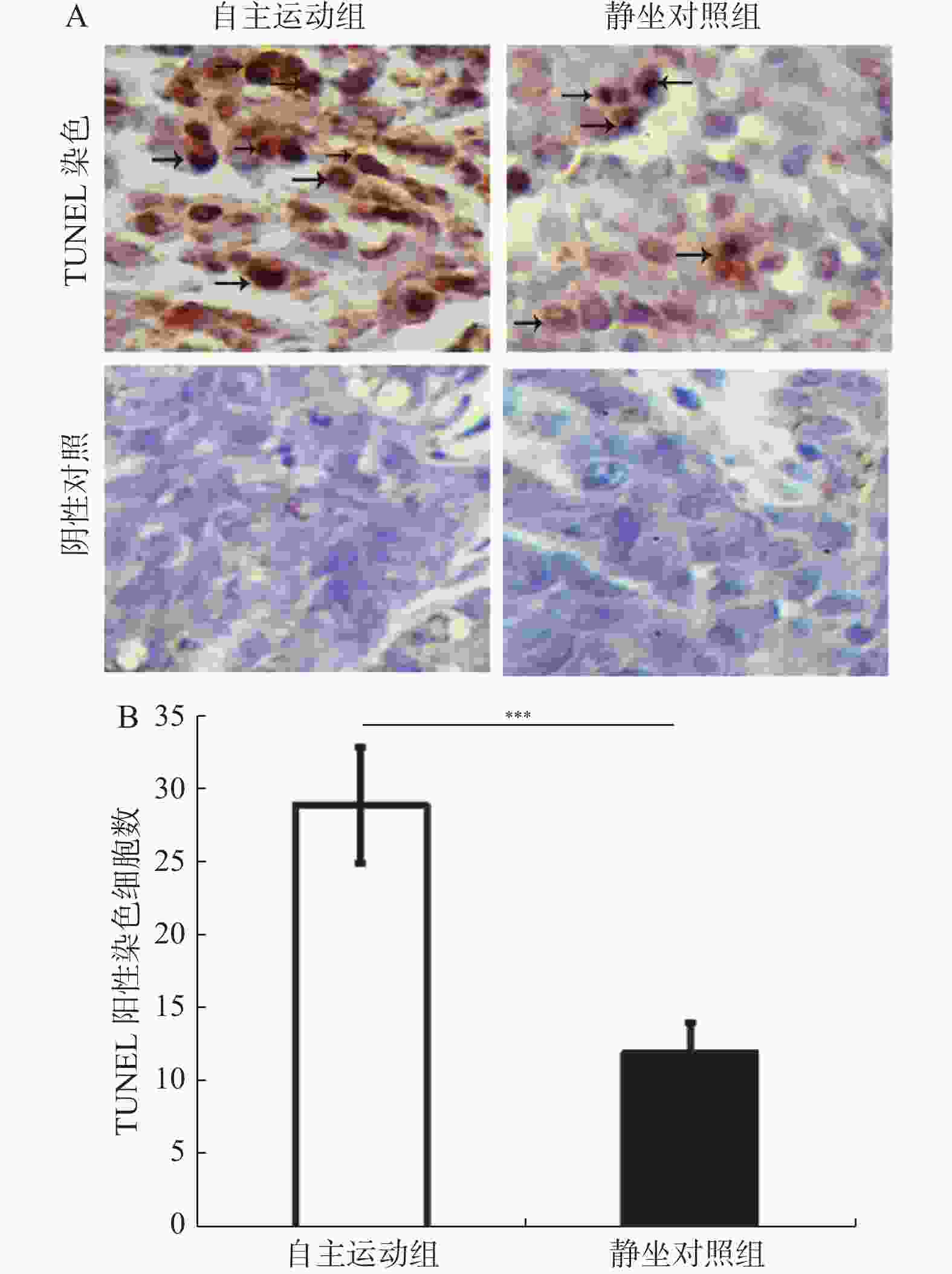
图 5 自主跑轮运动诱导了BRCA1-mut乳腺癌移植瘤的凋亡(×400)
自主运动对BRCA1-mut乳腺癌细胞裸鼠移植瘤细胞凋亡的检测,用TUNEL末端标记法对各组凋亡情况做检测。A:各组组织TUNEL染色着色细胞,箭头标示的为TUNEL阳性染色细胞,放大倍数为400倍;B:各组TUNEL阳性染色细胞计数结果。与静坐对照组相比:*P < 0.05,**P < 0.01,***P < 0.001。
Figure 5. Voluntary running wheel induces the apoptosis of the BRCA1-mut breast cancer cells transplanted tumors in the nude mice (×400)
图 6 自由运动激活BRCA1-mut乳腺癌细胞及移植瘤的Caspase 3
自主运动对体外培养的BRCA1-mut乳腺癌细胞及裸鼠移植瘤内Caspase 3活性及活化片段的影响。A:自主运动组与静坐对照组中移植肿瘤内Caspase 3的活性比较;B:自主运动组与静坐对照组中移植肿瘤内Caspase 3活性片段的表达检测;C:自主运动鼠条件血清及静坐鼠条件血清处理后BRCA1-mut细胞Caspase 3的活性比较;D:自主运动鼠条件血清及静坐鼠条件血清处理后BRCA1-mut细胞Caspase 3活性片段的表达检测。O.D.405,405 nm 波长下酶标仪检测到的光密度值。与静坐鼠条件血清处理组相比:*P < 0.05,**P < 0.01,***P < 0.001。
Figure 6. Voluntary running wheel increases the Caspase 3 activity in either of BRCA1-mut breast cancer cells and transplanted tumorsin nude mice
表 1 携带BRCA1突变基因的乳腺癌患者BRCA1的突变状况及信息
Table 1. BRCA1 gene mutation status and clinical information of breast cancer patients
BRCA1 突变类型(n) 家庭表型(n) 患者年龄(岁)(n) 组织学分类(n) 肿瘤分期(0-Ⅳ期)(n) K679X(5) family BC#(16) < 30(1) 小叶型(5) ⅡA&(5) 185delAG(4) family OC(2) 30~35(8) 导管型(25) ⅡB(5) E1353X(5) family BC及 OC(1) 36~40(2) 混合型(1) ⅢA(8) 5382insC(4) 无(12) 41~45(6) ⅢB(7) S770X(4) 46~50(7) ⅢC(5) S868X(3) 51~55(4) Ⅳ(1) 231delAA(3) 56~60(2) 8548delAAGG(1) >60(1) 335delA(1) IVS17+2T>C(1) #,家庭表型,包括:家族性乳腺癌(family breast cancer,family BC),家族性卵巢癌(family ovarian cancer,family OC);&,乳腺癌分期根据国际通用的UICC (union for international cancer control) 以及AJCC (American joint committee on cancer) 标准进行[11]。 -
[1] Schünemann H J,Lerda D,Quinn C,et al. Breast cancer screening and diagnosis: A synopsis of the European breast guidelines[J]. Ann Intern Med,2020,172(1):46-56. doi: 10.7326/M19-2125 [2] Kharel S, Shrestha S, Yadav S, et al. BRCA1/BRCA2 mutation spectrum analysis in South Asia: A systematic review[J]. J Int Med Res, 2022, 50(1): 3000605211070757. [3] Friebel T M,Domchek S M,Rebbeck T R. Modifiers of cancer risk in BRCA1 and BRCA2 mutation carriers: Systematic review and meta-analysis[J]. Journal of the National Cancer Institute,2014,106(6):dju091. [4] Dubeau L. Pathogenesis of serous,extra-uterine Müllerian epithelial cancer and therapeutic implications[J]. Transl Cancer Res,2015,4(1):3-13. [5] Kamińska M,Ciszewski T,Łopacka-Szatan K,et al. Breast cancer risk factors[J]. Przegla̜d Menopauzalny,2015,14(3):196-202. [6] Waxman A,World Health Assembly. WHO global strategy on diet,physical activity and health[J]. Food Nutr Bull,2004,25(3):292-302. doi: 10.1177/156482650402500310 [7] García-Chico C,López-Ortiz S,Peñín-Grandes S,et al. Physical exercise and the hallmarks of breast cancer: A narrative review[J]. Cancers (Basel),2023,15(1):324. doi: 10.3390/cancers15010324 [8] Christensen J F,Jones L W,Andersen J L,et al. Muscle dysfunction in cancer patients[J]. Annals of Oncology,2014,25(5):947-958. doi: 10.1093/annonc/mdt551 [9] Ju J,Nolan B,Cheh M,et al. Voluntary exercise inhibits intestinal tumorigenesis in Apc(Min/+) mice and azoxymethane/dextran sulfate sodium-treated mice[J]. BMC Cancer,2008,2(8):316. [10] Lu Y P,Lou Y R,Nolan B,et al. Stimulatory effect of voluntary exercise or fat removal (partial lipectomy) on apoptosis in the skin of UVB light-irradiated mice[J]. Proc Natl Acad Sci U S A,2006,103(44):16301-16306. doi: 10.1073/pnas.0607789103 [11] Kostourou V,Cartwright J E,Johnstone A P,et al. The role of tumour-derived iNOS in tumour progression and angiogenesis[J]. Br J Cancer,2011,104(1):83-90. doi: 10.1038/sj.bjc.6606034 [12] National research council (US) institute for laboratory animal research. Guide for the care and use of laboratory animals[M]. Washington (DC): National Academies Press (US), 1996: 37-88. [13] Hojman P,Dethlefsen C,Brandt C,et al. Exercise-induced muscle-derived cytokines inhibit mammary cancer cell growth[J]. Am J Physiol Endocrinol Metab,2011,301(3):504-510. doi: 10.1152/ajpendo.00520.2010 [14] Hu T,Zhou F J,Chang Y F,et al. miR21 is associated with the cognitive improvement following voluntary running wheel exercise in TBI mice[J]. J Mol Neurosci,2015,57(1):114-122. doi: 10.1007/s12031-015-0584-8 [15] Minemura H,Takagi K,Miki Y,et al. Abnormal expression of miR-1 in breast carcinoma as a potent prognostic factor[J]. Cancer Sci,2015,106(11):1642-1650. doi: 10.1111/cas.12808 [16] Hu T,Zhang C,Tang Q,et al. Variant G6PD levels promote tumor cell proliferation or apoptosis via the STAT3/5 pathway in the human melanoma xenograft mouse model[J]. BMC Cancer,2013,13:251. doi: 10.1186/1471-2407-13-251 [17] Gordon C J,Phillips P M,Johnstone A F. Impact of genetic strain on body fat loss,food consumption,metabolism,ventilation,and motor activity in free running female rats[J]. Physiol Behav,2016,153(1):56-63. [18] Otsuka A,Shiuchi T,Chikahisa S,et al. Voluntary exercise and increased food intake after mild chronic stress improve social avoidance behavior in mice[J]. Physiol Behav,2015,151(1):264-271. [19] Pagliusi M Jr,Bonet I J M,Brandão A F,et al. Therapeutic and preventive effect of voluntary running wheel exercise on social defeat stress (SDS)-induced depressive-like behavior and chronic pain in mice[J]. Neuroscience,2020,428(4):165-177. [20] Sartori C R,Pagliusi M Jr,Bonet I J M,et al. Running wheel exercise induces therapeutic and preventive effects on inflammatory stimulus-induced persistent hyperalgesia in mice[J]. PLoS One,2020,15(10):e0240115. doi: 10.1371/journal.pone.0240115 [21] Reddy B S, Sugie S, Lowenfels A. Effect of voluntary exercise on azoxymethane-induced colon carcinogenesis in male F344 rats[J]. Cancer Research, 1998, 48(24 Part 1): 7079-7081. [22] Lu M,Sanderson S M,Zessin A,et al. Exercise inhibits tumor growth and central carbon metabolism in patient-derived xenograft models of colorectal cancer[J]. Cancer Metab,2018,6(3):14. [23] Cohen L A,Kendall M E,Zang E,et al. Modulation of N-nitrosomethylurea-induced mammary tumor promotion by dietary fiber and fat[J]. J Natl Cancer Inst,1991,83(7):496-501. doi: 10.1093/jnci/83.7.496 [24] Zhou Y,Jia N,Ding M,et al. Effects of exercise on inflammatory factors and IGF system in breast cancer survivors: A meta-analysis[J]. BMC Womens Health,2022,22(1):507. doi: 10.1186/s12905-022-02058-5 [25] Agostini D,Natalucci V,Baldelli G,et al. New insights into the role of exercise in inhibiting mTOR signaling in triple-Negative breast cancer[J]. Oxid Med Cell Longev,2018,2018:5896786. [26] Theriau C F,Connor M K. Voluntary physical activity counteracts the proliferative tumor growth microenvironment created by adipose tissue via high-fat diet feeding in female rats[J]. Physiol Rep,2017,5(13):e13325. doi: 10.14814/phy2.13325 [27] Pedersen L,Idorn M,Olofsson G H,et al. Voluntary running suppresses tumor growth through epinephrine- and IL-6-dependent NK cell mobilization and redistribution[J]. Cell Metab,2016,23(3):554-562. doi: 10.1016/j.cmet.2016.01.011 [28] Thompson H J. Effect of exercise intensity and duration on the induction of mammary carcinogenesis[J]. Cancer Res, 1994, 54(7 Suppl): 1960s-1963s. [29] Steiner J L,Davis J M,McClellan J L,et al. Effects of voluntary exercise on tumorigenesis in the C3(1)/SV40Tag transgenic mouse model of breast cancer[J]. Int J Oncol,2013,42(4):1466-1472. doi: 10.3892/ijo.2013.1827 [30] Welsch M A,Cohen L A,Welsch C W. Inhibition of growth of human breast carcinoma xenografts by energy expenditure via voluntary exercise in athymic mice fed a high-fat diet[J]. Nutrition and Cancer,1995,23(3):309-318. doi: 10.1080/01635589509514385 -





 下载:
下载: