Analysis of Serum G-17 and PG Levels in Ethnic Minority Patients with Gastric Cancer in Lijiang Area
-
摘要:
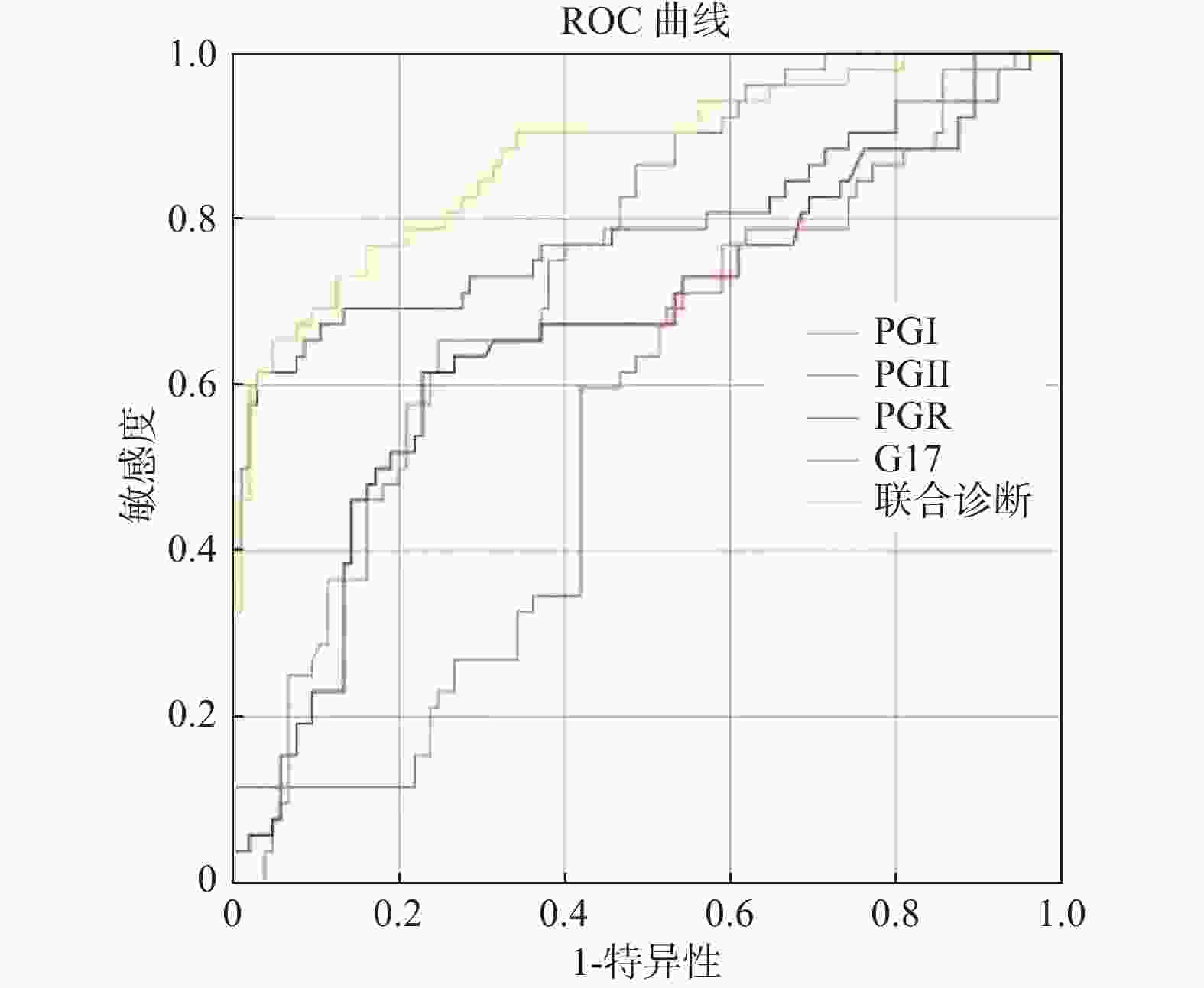
目的 分析丽江少数民族胃癌患者G-17、PG水平,探讨其在胃癌筛查中的价值。 方法 选取2020年7月至2022年8月丽江市人民医院行胃镜检查的胃癌及胃炎患者,将活检确诊胃癌的52例少数民族患者作为观察组,进一步将胃癌组分为早期胃癌组及进展期胃癌组,同时选取丽江市人民医院同期行胃镜检查后诊断为慢性胃炎(萎缩性胃炎、非萎缩性胃炎)的105例少数民族患者作为对照组。收集患者血清G-17、PGI、PGII、PGR水平进行相关分析。 结果 胃癌组、萎缩性胃炎组血清 G-17水平高于非萎缩性胃炎组(P < 0.05),胃癌组血清 PGⅡ水平高于萎缩性胃炎组(P < 0.05);早期胃癌组PGI 水平低于进展期胃癌组,差异均具有统计学意义(P < 0.05);血清G-17、PGI、PGII、PGR 4项联合检测的AUC值高于单项检测(P < 0.0001)。 结论 血清G-17、PG可用于丽江少数民族胃癌患者的识别和筛查,同时也可作为初筛早期胃癌以及进展期胃癌的无创指标。 Abstract:Objective This study aims to analyze the level of G-17 and PG in ethnic minority gastric cancer patients in Lijiang, and to investigate their value in gastric cancer screening. Methods Selected from July 2020 to August 2022, Lijiang people’s hospital of gastroscopy patients with gastric cancer and gastritis, the biopsy confirmed gastric cancer in 52 cases of minority patients as an observation group, further gastric cancer group for early gastric cancer group and advanced gastric cancer group, while the same gastroscopy diagnosis of chronic gastritis (atrophic gastritis, atrophic gastritis) in 105 cases of ethnic minority patients as a control group. Serum G-17, PGI, PGII, and PGR levels were collected for correlation analysis. Results The serum G-17 level in gastric cancer group and atrophic gastritis group was significantly higher than that in non-atrophic gastritis group (P < 0.05). The serum PGⅡ level in gastric cancer group was significantly higher than that in atrophic gastritis group (P < 0.05). The PGI level in early gastric cancer group was lower than that in advanced gastric cancer group, and the difference was statistically significant (P < 0.05). The AUC values of serum G-17, PGI, PGII and PGR combined tests were higher than those of single test (P < 0.0001). Conclusion Serum G-17 and PG can be used for the identification and screening of ethnic minority gastric cancer patients in Lijiang, as well as as non-invasive indicators of early and advanced gastric cancer. -
Key words:
- Gastric cancer /
- Gastrin-17 /
- Pepsinogen /
- Correlation
-
表 1 一般资料 [n(%)]
Table 1. General Information [n(%)]
项目 对照组 观察组 χ2 P 非萎缩(n = 50) 萎缩(n = 55) 早期(n = 14) 进展期(n = 38) 性别 男 34(21.7) 32(20.3) 7(4.5) 27(17.2) 7.070 0.520 女 16(10.2) 23(14.6) 7(4.5) 11(7.0) 年龄(岁) >60 17(10.8) 24(15.3) 9(5.7) 22(14.1) 5.210 0.070 ≤60 33(21.0) 31(19.7) 5(3.2) 16(10.2) 表 2 各组血清PGI、PGII、PGR、G-17 水平的比较[M(P25,P75)]
Table 2. Comparison of serum PGI,PGII,PGR,and G-17 levels in each group [M(P25,P75)]
组别 非萎缩 萎缩 胃癌 Z P n 50 55 52 PGⅠ(μg/L) 72.88(91.75,145.60) 82.40(122.10,191.90)△ 50.98(74.10,90.13)△# 25.771 < 0.001* PGⅡ(μg/L) 3.75(7.10,12.93) 5.90(10.00,17.40)△ 6.4(20.50,26.63)△# 14.468 0.001* PGR 9.70(15.75,23.53) 7.50(12.70,18.50) 2.33(3.80,11.20)△ 37.394 < 0.001* G-17(pg/mL) 4.55(10.15,34.48) 8.50(29.00,60.10)△ 14.35(25.30,45.50)△# 10.080 0.006* △与非萎缩组比;#与萎缩组比;*P < 0.05。 表 3 早期胃癌组、进展期胃癌组血清 PGⅠ、PGⅡ、G-17水平及PGR的比较[M(P25,P75),
$\bar x \pm s $ ]Table 3. Comparison of serum PGI,PGII and G-17 levels and PGR in early and advanced-stage gastric cancer groups [M(P25,P75),
$\bar x \pm s $ ]组别 进展期胃癌组 早期胃癌组 t/Z P n 38 14 PGⅠ(μg/L) 68.09 ± 21.62 97.56 ± 33.08 −3.754 < 0.001* PGⅡ(μg/L)) 6.25(21.20,26.48) 6.25(17.55,31.75) −0.041 0.967 PGR 2.18(3.50,8.98) 2.48(4.65,17.13) −0.929 0.353 G-17(pg/mL) 13.33(24.85,37.80) 13.45(33.25,51.98) −1.032 0.302 *P < 0.05。 表 4 血清 PGⅠ、PGⅡ、PGR及G-17水平诊断胃癌的比较
Table 4. Comparison of serum PGI,PGII,PGR and G-17levels for the diagnosis of gastric cancer
检测指标 n AUC 95%CI 截断值 灵敏度 特异度 PGⅠ(μg/L) 157 0.74 0.67~0.82 31.60 0.65 0.75 PGⅡ(μg/L) 157 0.67 0.57~0.76 14.90 0.62 0.77 PGR 157 0.79 0.70~0.88 0.10 0.62 0.97 G-17(pg/mL) 157 0.55 0.46~0.65 13.30 0.77 0.41 联合检测 157 0.88 0.82~0.94 0.25 0.87 0.77 -
[1] Kishikawa H,Nakamura K,Ojiro K,et al. Relevance of pepsinogen,gastrin,and endoscopic atrophy in the diagnosis of autoimmune gastritis[J]. Sci Rep,2022,12(1):4202. doi: 10.1038/s41598-022-07947-1 [2] Chen X,Wang R,Huang X,et al. The level of serum pepsinogen in diagnosing and evaluating the severity of subacute sombined degeneration due to vitamin B12 deficiency[J]. Front Neurol,2021,12:604523. doi: 10.3389/fneur.2021.604523 [3] Nejadi-Kelarijani F,Roshandel G,Semnani S,et al. Diagnostic values of serum levels of pepsinogens and gastrin-17 for screening gastritis and gastric cancer in a high risk area in northern Iran[J]. Asian Pac J Cancer Prev,2014,15(17):7433-7436. doi: 10.7314/APJCP.2014.15.17.7433 [4] 潘克明,王琦. 血清CA724、PG、胃泌素17、Hp抗体在胃癌患者中的变化及意义[J]. 中国卫生工程学,2021,20(2):337-338. [5] Liu Y,Zhu J,Liu J,et al. Knockdown of gastrin promotes apoptosis of gastric cancer cells by decreasing ROS generation[J]. Biomed Res Int,2021,2021:5590037. [6] Agréus L,Kuipers E J,Kupcinskas L,et al. Rationale in diagnosis and screening of atrophic gastritis with stomach-specific plasma biomarkers[J]. Scand J Gastroenterol,2012,47(2):136-147. doi: 10.3109/00365521.2011.645501 [7] Di Mario F,Crafa P,Barchi A,et al. Pepsinogen II in gastritis and helicobacter pylori infection[J]. Helicobacter,2022,27(2):e12872. [8] Parthasarathy G,Maroju N K,Kate V,et al. Serum pepsinogen I and II levels in various gastric disorders with special reference to their use as a screening test for carcinoma stomach[J]. Trop Gastroenterol,2007,28(4):166-170. [9] In H,Sarkar S,Ward J,et al. Serum pepsinogen as a biomarker for gastric cancer in the United States: A nested case-control study using the PLCO cancer screening trial data[J]. Cancer Epidemiol Biomarkers Prev,2022,31(7):1426-1432. doi: 10.1158/1055-9965.EPI-21-1328 [10] 北京市科委重大项目《早期胃癌治疗规范研究》专家组. 早期胃癌内镜下规范化切除的专家共识意见(2018, 北京)[J/CD]. 中华胃肠内镜电子杂志, 2018, 5(2): 49-60. [11] 中华医学会,中华医学会杂志社,中华医学会消化病学分会,中华医学会全科医学分会,中华医学会《中华全科医师杂志》编辑委员会,消化系统疾病基层诊疗指南编写专家组. 慢性胃炎基层诊疗指南(2019年)[J]. 中华全科医师杂志,2020,19(9):768-775. [12] Syrjänen K. A panel of erum biomarkers (GastroPanel®) in non-invasive diagnosis of atrophic gastritis. systematic review and meta-analysis[J]. Anticancer Res,2016,36(10):5133-5144. doi: 10.21873/anticanres.11083 [13] 陈卿奇,羊文芳,吴素江,等. 血清胃蛋白酶原及胃泌素-17水平与胃癌的相关性研究[J]. 重庆医学,2016,45(35):4938-4941. doi: 10.3969/j.issn.1671-8348.2016.35.013 [14] Wang Y,Zhu Z,Liu Z,et al. Diagnostic value of serum pepsinogen I,pepsinogen II,and gastrin-17 levels for population-based screening for early-stage gastric cancer[J]. J Int Med Res,2020,48(3):1220714378. [15] 萧飞,张卓云,刘发河,等. 胃泌素17水平、胃蛋白酶原1、胃蛋白酶原2与胃癌的相关性研究[J]. 现代诊断与治疗,2020,31(22):3623-3625. [16] Terasawa T,Nishida H,Kato K,et al. Prediction of gastric cancer development by serum pepsinogen test and helicobacter pylori seropositivity in Eastern Asians: A systematic review and meta-analysis[J]. PLoS One,2014,9(10):e109783. doi: 10.1371/journal.pone.0109783 [17] 盛倩,章国东,温敏雅. 血清G-17、PGⅠ、PGⅡ、Hp-IgG检测对胃癌与癌前病变的筛查价值及与肿瘤浸润深度关系[J]. 世界华人消化杂志,2022,30(5):235-241. [18] 高玮,赖跃兴,徐萍,等. 两种评分方法在早期胃癌和癌前病变筛查中的比较研究[J]. 胃肠病学,2020,25(4):204-207. [19] 王亚平,朱智勇,刘芝兰,等. 青海胃癌患者血清PGⅠ、PGⅡ及G17水平[J]. 中国高原医学与生物学杂志,2017,38(1):50-54. [20] Xu W,Chen G S,Shao Y,et al. Gastrin acting on the cholecystokinin2 receptor induces cyclooxygenase-2 expression through JAK2/STAT3/PI3K/Akt pathway in human gastric cancer cells[J]. Cancer Lett,2013,332(1):11-18. doi: 10.1016/j.canlet.2012.12.030 [21] Cao Q,Ran Z H,Xiao S D. Screening of atrophic gastritis and gastric cancer by serum pepsinogen,gastrin-17 and Helicobacter pylori immunoglobulin G antibodies[J]. J Dig Dis,2007,8(1):15-22. doi: 10.1111/j.1443-9573.2007.00271.x [22] Haj-Sheykholeslami A,Rakhshani N,Amirzargar A,et al. Serum pepsinogen I,pepsinogen II,and gastrin 17 in relatives of gastric cancer patients: Comparative study with type and severity of gastritis[J]. Clin Gastroenterol Hepatol,2008,6(2):174-179. doi: 10.1016/j.cgh.2007.11.016 [23] 姚肖,刘凯歌. 胃泌素17、胃蛋白酶原检测对早期胃癌筛查的意义[J]. 医学信息,2021,34(2):98-100. [24] Li Y,Zhao Y,Li Y,et al. Gastrin-17 induces gastric cancer cell epithelial-mesenchymal transition via the Wnt/β-catenin signaling pathway[J]. J Physiol Biochem,2021,77(1):93-104. doi: 10.1007/s13105-020-00780-y [25] Loor A,Dumitraşcu D L. Helicobacter pylori Infection,gastric cancer and gastropanel[J]. Rom J Intern Med,2016,54(3):151-156. [26] 马颖才,王亚平,刘芝兰,等. 血清学检测联合胃镜检查在青海胃癌高发地区早期胃癌筛查中的价值研究[J]. 中华消化内镜杂志,2020,37(2):88-89. [27] Kikuchi R,Abe Y,Iijima K,et al. Low serum levels of pepsinogen and gastrin 17 are predictive of extensive gastric atrophy with high-risk of early gastric cancer[J]. Tohoku J Exp Med,2011,223(1):35-44. doi: 10.1620/tjem.223.35 [28] Shafaghi A,Mansour-Ghanaei F,Joukar F,et al. Serum gastrin and the pepsinogen I/II ratio as markers for diagnosis of premalignant gastric lesions[J]. Asian Pac J Cancer Prev,2013,14(6):3931-3936. doi: 10.7314/APJCP.2013.14.6.3931 [29] Zhou M J,Huang R J. Catching up with the world: Pepsinogen screening for gastric cancer in the United States[J]. Cancer Epidemiol Biomarkers Prev,2022,31(7):1257-1258. doi: 10.1158/1055-9965.EPI-22-0372 [30] Trivanovic D,Plestina S,Honovic L,et al. Gastric cancer detection using the serum pepsinogen test method[J]. Tumori,2022,108(4):386-391. doi: 10.1177/03008916211014961 [31] Tong Y,Wang H,Zhao Y,et al. Serum pepsinogen levels in different regions of China and its influencing factors: A multicenter cross-sectional study[J]. BMC Gastroenterol,2021,21(1):264. doi: 10.1186/s12876-021-01794-6 [32] Liu W,Sun Y,Yuan Y. Analysis of serum gastrin-17 and Helicobacter pylori antibody in healthy Chinese population[J]. J Clin Lab Anal,2020,34(12):e23518. [33] 易文全,郝卫刚,刘睿,等. 血清胃蛋白酶原Ⅰ、Ⅱ及胃泌素17检测对慢性萎缩性胃炎的诊断价值[J]. 西部医学,2022,34(7):1021-1025. -





 下载:
下载:




