Clinical Correletions between Helper T Cells 17,Regulatory T Cells and Chronic Actinic Dermatitis
-
摘要:
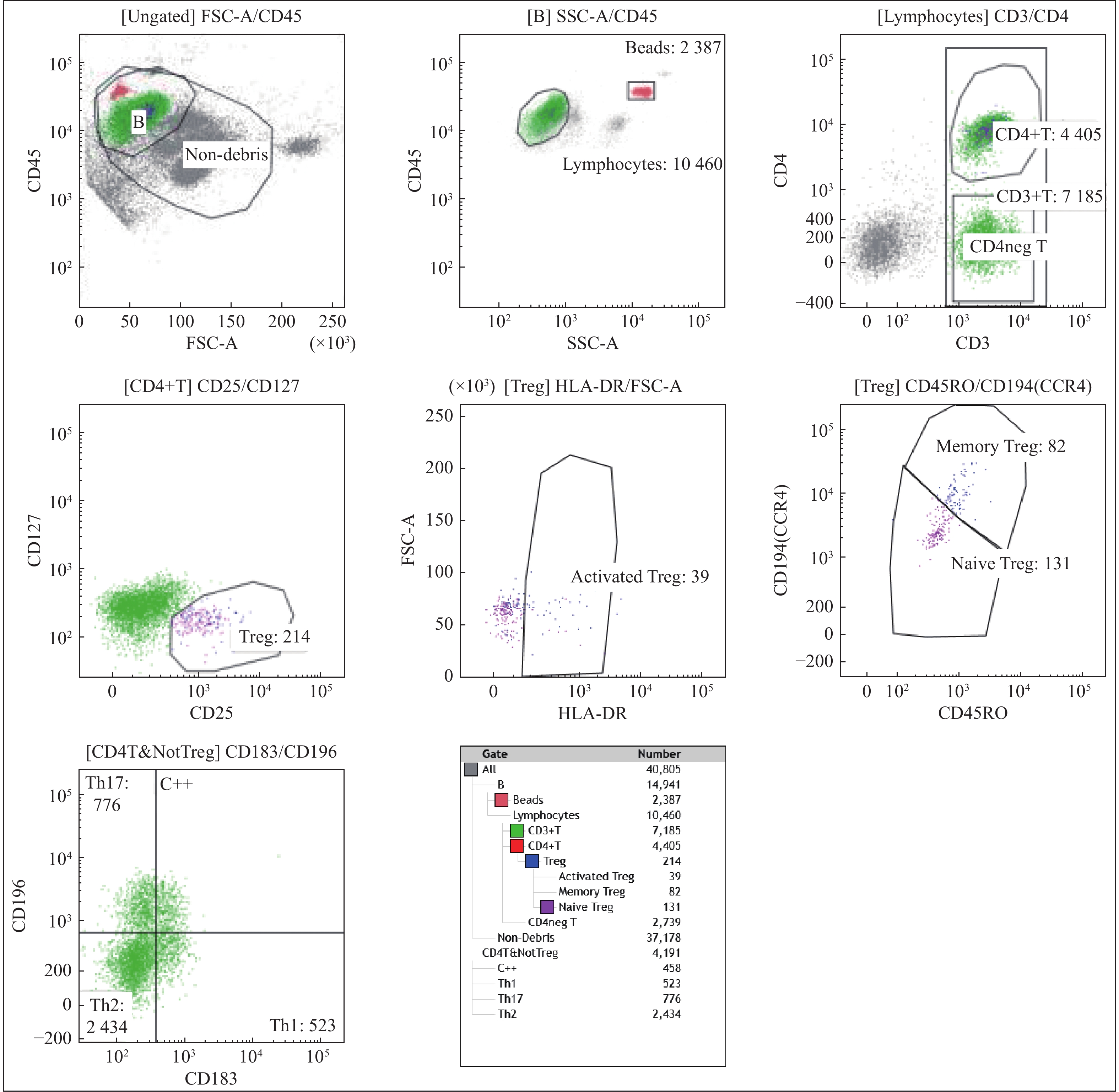
目的 探讨外周血中辅助性T淋巴细胞17(Th17 cells)和调节性T淋巴细胞(Treg cells)在慢性光化性皮炎 (chronic actinic dermatitis,CAD)发病机制中可能的作用。 方法 流式细胞术检测25例CAD患者及20名健康志愿者外周血CD4+T淋巴细胞中Th17细胞/Tregd 的比值,同时应用免疫组织化学法检测25例CAD患者和10例健康人皮肤组织皮损白介素-17(IL-17)、叉头转录因子p3 (Foxp3)的表达。 结果 CAD患者Th17明显高于志愿者;CAD患者Treg细胞明显少于志愿者(P < 0.05);CAD患者的Th17/Treg显著高于健康志愿者(P < 0.05)。Th17细胞和EASI评分2者间存在正相关关系(P < 0.05);Treg细胞和EASI评分间存在负相关关系;CAD组患者皮损中IL-17高表达,与健康对照组相比,差异有统计学意义(P < 0.05),Foxp3在皮肤中的表达与健康对照组相比差异无统计学意义(P > 0.05)。 结论 CAD患者存在Th17 /Treg的失衡,由此导致的免疫反应向促炎方向发展,可能是CAD重要的发病机制。 -
关键词:
- 慢性光化性皮炎 /
- 辅助性T淋巴细胞17 /
- 调节性T淋巴细胞
Abstract:Objective To investigate the the possible roles of helper T cells 17 (Thl7 cells) and regulatory T cells (Treg cells) of chronic actinic dermatitis. Methods The percentages of Th17 cells and Treg cells in CD4+ T cells in peripheral blood of 25 CAD patients and 20 healthy volunteers were detected by flow cytometry, and the expression of IL-17 and Foxp3 in skin lesions of 25 patients with chronic actinic dermatitis and 10 healthy people were detected by immunohistochemistry. Results Compared with the healthy volunteers, Th17 cells in CAD patients were significantly more than those in volunteers; Treg cells in CAD patients were significantly less than those in volunteers; Th17/Treg in CAD patients was significantly higher than that in volunteers and all the differences were statistically significant (P < 0.05). The correlation coefficients of Th17 cells and EASI scores showed that there was a positive correlation between them (P < 0.05); the correlation coefficients of Treg cells and EASI scores showed that there was a negative correlation between them. The expression of IL-17 in lesions of CAD group was higher than that of healthy control group and the difference was statistically significant (P < 0.05). There was no significant difference in the expression of Foxp3 in the skin compared with the healthy control group (P > 0.05). Conclusion The imbalance of Th17/Treg in patients with CAD leads to the development of immune response to pro-inflammatory, which may be an important pathogenesis of CAD. -
Key words:
- Chronic actinic dermatitis /
- T help cells 17 /
- Regulatory T cells
-
表 1 各组Th17细胞,Treg细胞比例及Th17/Treg比值(
$\bar x \pm s $ )Table 1. Th17 cells,Treg cell ratio and Th17/Treg ratio in each group
分组 n Th17(%) Treg(%) Th17/Treg CAD患者 25 16.64 ± 6.12* 3.05 ± 1.29** 5.72 ± 1.68** 健康志愿者 20 11.49 ± 4.44 6.04 ± 1.41 2.01 ± 0.88 t 3.15 7.41 8.93 P 0.001 P < 0.01 P < 0.01 与健康对照组比较,*P < 0.05,**P < 0.01。 表 2 Foxp3在CAD病例组与健康对照组皮肤中表达差异(n)
Table 2. The difference of Foxp3 expression in skin (n)
分组 n 阳性 阴性 阳性率(%) χ2 P CAD病例组 25 3 22 12 0.373 > 0.05 健康对照组 10 2 8 20 表 3 IL-17在CAD病例组与健康对照组皮肤中表达差异(n)
Table 3. The difference of IL-17 expression in skin (n)
分组 n 阳性 阴性 阳性率(%) χ2 P CAD病例组 25 22 3 88* 19.288 < 0.05 健康对照组 10 1 9 10 与健康对照组比较,*P < 0.05。 -
[1] 王海波,刘海春,王振清. 慢性光化性皮炎患者外周血T细胞亚群水平变化及意义[J]. 海南医学院学报,2015,21(1):71-72,76. doi: 10.13210/j.cnki.jhmu.20141016.003 [2] Norris P G,Hawk J L. Chronic actinic dermatitis. A unifying concept[J]. Arch Dermatol,1990,126(3):376-378. doi: 10.1001/archderm.1990.01670270108018 [3] 农祥,孙思昊,何黎. 敏感性皮肤与光敏性皮肤病的鉴别[J]. 皮肤科学通报,2020,37(6):581-584. [4] Hanifin J M,Thurston M,Omoto M,et al. The eczema area and severity index (EASI): Assessment of reliability in atopic dermatitis[J]. Experimental Dermatology,2001,10(1):11-18. doi: 10.1034/j.1600-0625.2001.100102.x [5] 陈浩,邓丹琪,周晓鸿,等. Tcl/Tc2失衡和慢性光线性皮炎发病的相关性研究[J]. 中华皮肤科杂志,2005,38(10):628-630. [6] Milner J D,Brenchley J M,Laurence A,et al. Impaired T(H)17 cell differentiation in subjects with autosomal dominant hyper-IgE syndrome[J]. Nature,2008,452(7188):773-776. doi: 10.1038/nature06764 [7] Ma C S,Chew G Y,Simpson N,et al. Deficiency of Thl7 cells in hyper IgH syndrome due to mutations in STAT3[J]. J Exp Med,2008,205(7):1551-1557. doi: 10.1084/jem.20080218 [8] Chang S H,Dong C. IL-17F; Regulation,signaling and function in inflammation[J]. Cytokine,2009,46(1):7-11. doi: 10.1016/j.cyto.2008.12.024 [9] Iwakura Y,Ishigame H,Saijo S,et al. Functional specialization of interleukin-17 family members[J]. Immunity,2011,34(2):149-162. doi: 10.1016/j.immuni.2011.02.012 [10] Baliwag J,Barnes D H,Johnston A. Cytokines in psoriasis[J]. Cytokine,2015,73(2):342-350. doi: 10.1016/j.cyto.2014.12.014 [11] Buckner J H. Mechanisms of impaired regulation by CD4+ CD25+ FOXP3+ regulatory T cells in human autoimmune diseases[J]. Nature Reviews Immunology,2010,10(12):849. doi: 10.1038/nri2889 [12] Huang Hui,Lu Zhiwei,Jiang Chunguo,et al. Imbalance between Th17 and regulatory T-Cells in sarcoidosis[J]. International Journal of Molecular Sciences,2013,14(11):21463-21473. doi: 10.3390/ijms141121463 [13] Alexander Y,Rudensky. Regulatory T cells and Foxp3[J]. Immunological Reviews,2011,241(1):260-268. doi: 10.1111/j.1600-065X.2011.01018.x [14] Shimon,Sakaguchi,Tomoyuki,et al. Regulatory T cells and immune tolerance[J]. Cell,2008,133(5):775-787. doi: 10.1016/j.cell.2008.05.009 [15] He J,Zhang X,Wei Y,et al. Low-dose interleukin-2 treatment selectively modulates CD4+ T cell subsets in patients with systemic lupus erythematosus[J]. Nature Medicine,2016,22(9):991. doi: 10.1038/nm.4148 [16] Park J S,Kwok S K,Lim M A,et al. STA-21,a promising STAT-3 inhibitor that reciprocally regulates Th17 and Treg cells,inhibits osteoclastogenesis in mice and humans and alleviates autoimmune inflammation in an experimental model of rheumatoid arthritis[J]. Arthritis Rheumatol,2014,66(4):918-929. doi: 10.1002/art.38305 -






 下载:
下载: