Clinical Value of Fecal SDC2 Gene Methylation Detection in Early Screening of Colorectal Cancer
-
摘要:
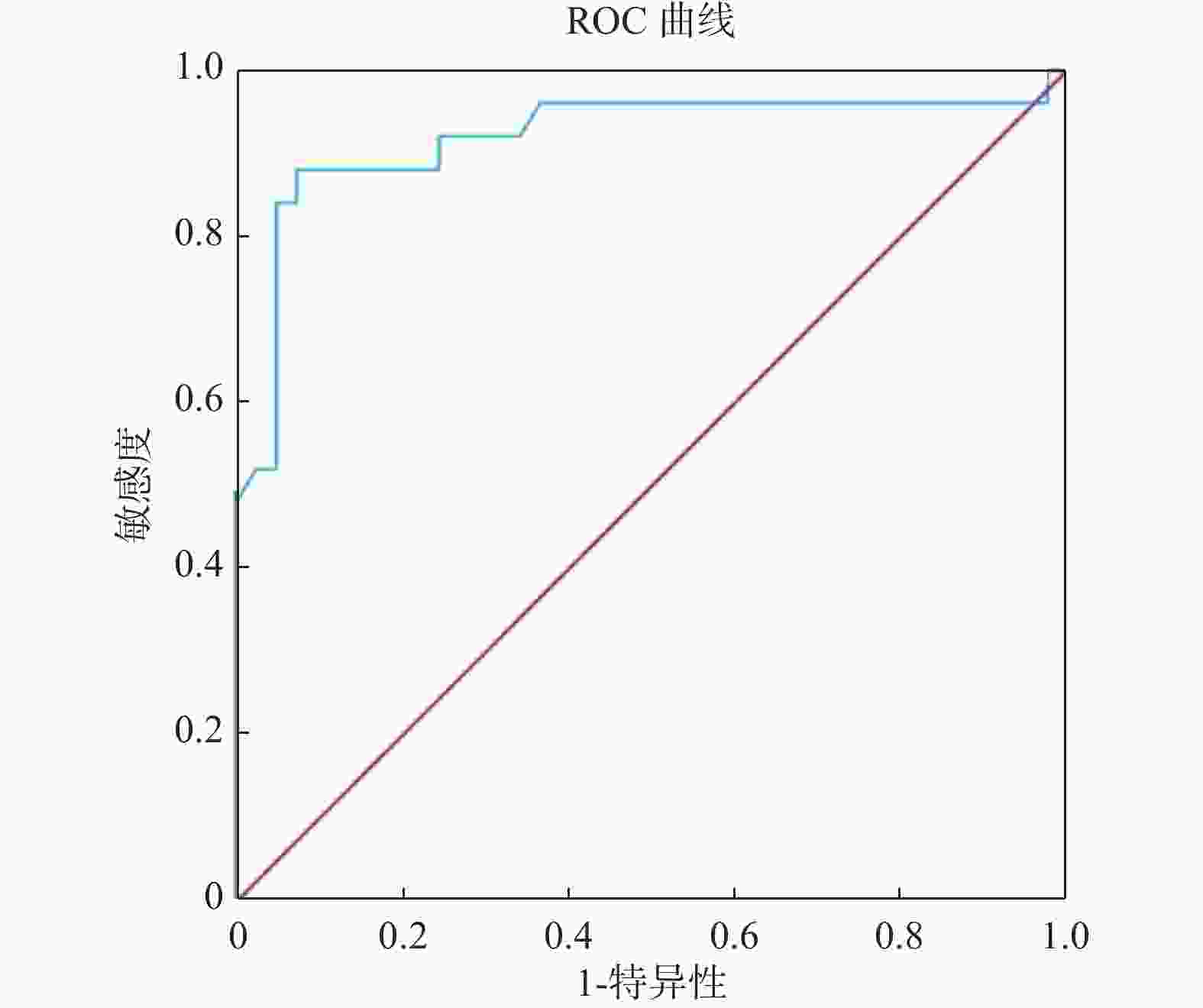
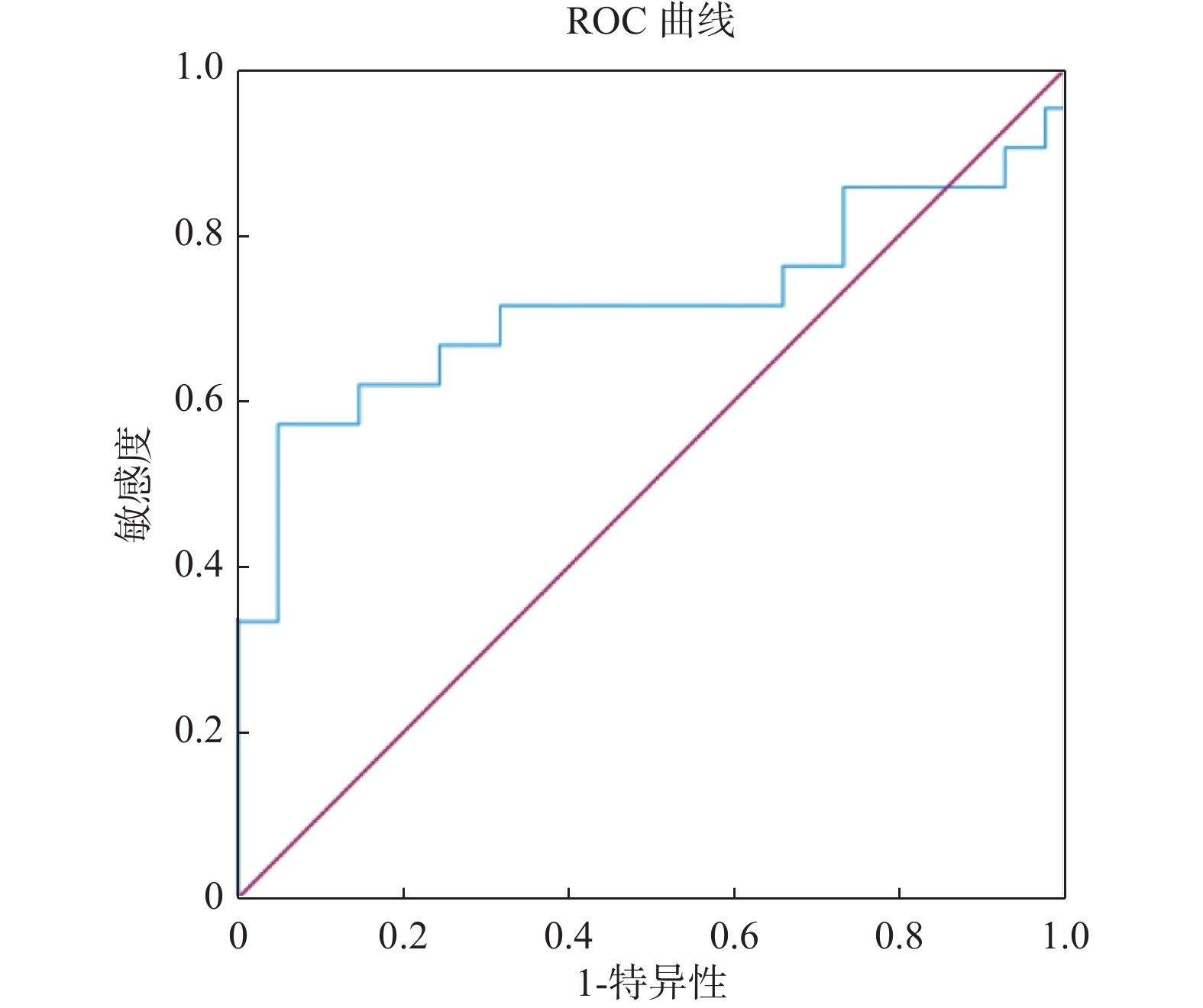
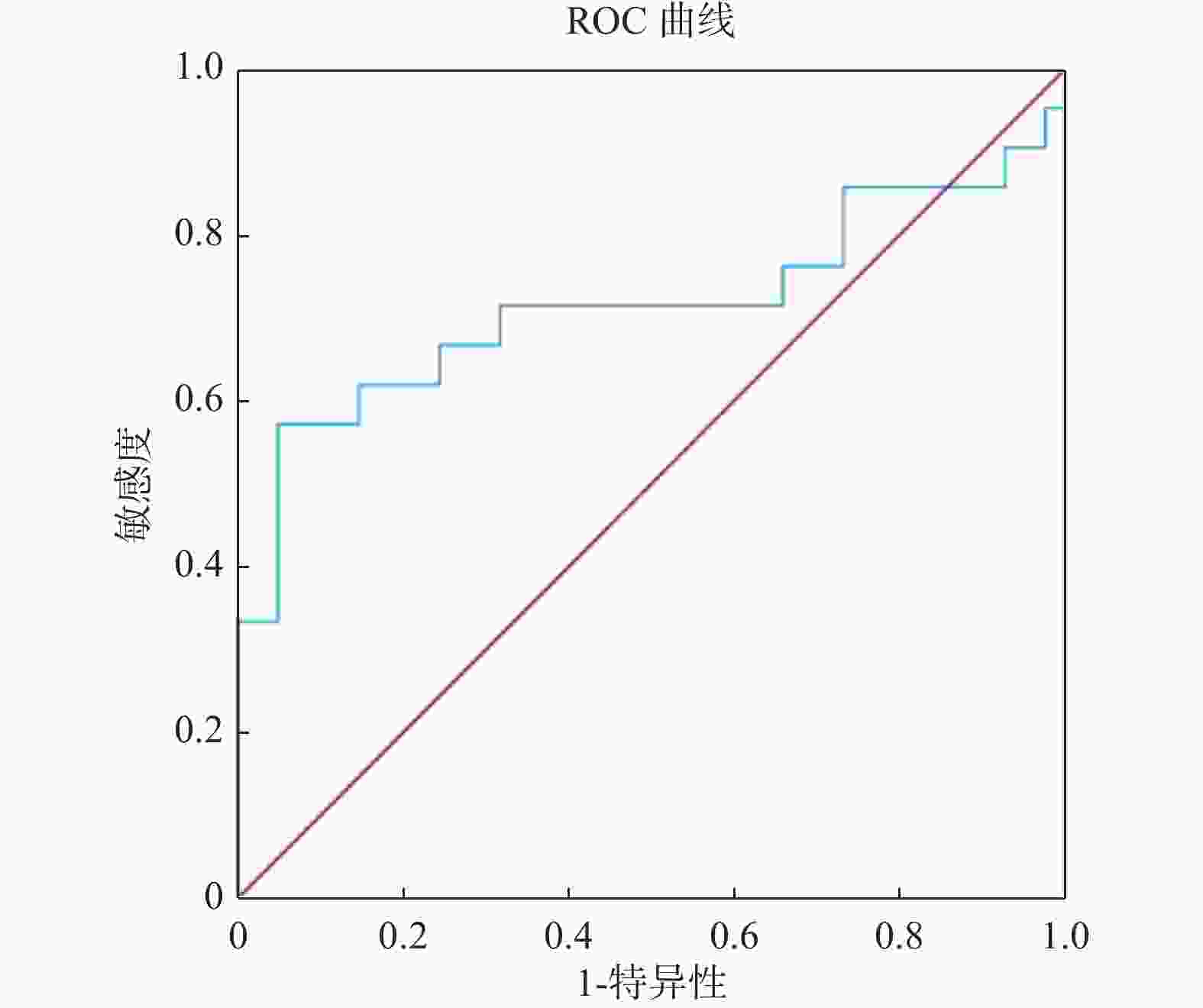
目的 探究粪便重组人黏结蛋白聚糖2(syndecan-2,SDC2)基因甲基化检测在结直肠癌早期筛查中的临床价值。 方法 选择2021年3月至2022年10月昆明医科大学第三附属医院收治的87例受检者作为研究对象,其中结直肠正常者41例,结直肠腺瘤患者21例,结直肠癌患者25例。研究将提取研究对象的粪便DNA用于进行粪便SDC2基因甲基化检测,根据试剂盒设定的Cutoff值,确定被测标本的阴性和阳性结果,对比SDC2基因甲基化检测结果与结直肠镜诊断结果,对受检者一般资料进行卡方检验分析,对SDC2基因甲基化循环阈值(cycle threshold,Ct)进行方差分析用于评估SDC2基因甲基化在结直肠肿瘤中的表达程度,并做受试者工作特征曲线(receiver operating characteristic curve,ROC curve)计算曲线下面积(area under the curve,AUC)用于评估SDC2基因甲基化在结直肠肿瘤中的诊断价值,分析SDC2基因甲基化在结直肠肿瘤诊断中的灵敏度和特异度。 结果 在87例入组人群中检测出SDC2基因甲基化阳性35例,阴性52例,其在结直肠腺瘤患者和结直肠癌患者粪便中的阳性率分别为57.14%(12/21)、84.00%(21/25),差异具有统计学意义(P = 0.044)。ROC曲线下分析结果显示,SDC基因甲基化检测诊断结直肠腺瘤和结直肠癌的曲线下面积(AUC)分别为0.715、0.918,灵敏度分别为57.14%、88.00%,特异度分别为95.12%,92.68%,差异有统计学意义(P = 0.0107,P < 0.0001)。 结论 粪便SDC2基因甲基化对于检测结直肠癌及其癌前病变有着较高的特异度,并且随着癌变进程检测灵敏度不断升高,故在结直肠癌早期筛查中具有重要临床价值。 Abstract:Objective This study aims to investigate the clinical application of fecal recombinant human adhesin syndecan 2 (SDC2) gene methylation test in the early screening of colorectal tumors. Methods Eighty-seven subjects admitted to the hospital from March 2021 to October 2022 were selected as the study subjects, including 41 cases with normal colorectum, 21 with colorectal adenoma and 25 with colorectal cancer. In this study, the fecal DNA of the subjects was extracted for the fecal SDC2 gene methylation test, and the negative and positive results of the tested specimens were determined according to the Cutoff value set by the kit. The effects of the SDC2 gene methylation test were compared with the results of colonoscopy diagnosis. The analysis of variance on SDC2 gene methylation cycle thresholds (Ct) was performed to assess the expression of SDC2 methylation in colorectal tumors. The subject operating characteristic curve (ROC) was used to calculate the area under the curve (AUC) to evaluate the diagnostic value of SDC2 gene methylation in colorectal tumors and to analyze the sensitivity and specificity of SDC2 gene methylation in colorectal tumor diagnosis. Results Among the 87 enrolled cases, 35 were positive for SDC2 gene methylationand 52 were negative. The positive rate in the stool of colorectal adenoma patients and colorectal cancer patients was 57.14% (12/21) and 84.00% (21/25), respectively and there were statistically significant differences (P = 0.044). The results of the analysis under the ROC curve showed that the area of SDC2 gene methylation under the curve (AUC) of the test for the diagnosis of colorectal adenoma and colorectal cancer was 0.715 and 0.918, respectively, with a sensitivity of 57.14% and 88.00% and a specificity of 95.12% and 92.68%, respectively and there were statistically significant differences (P = 0.0107, P < 0.0001). Conclusion Fecal SDC2 gene methylation has a high specificity for detecting colorectal cancer and its precancerous lesions, and the sensitivity of detection increases as the cancer progresses, so it is of great clinical value in early screening of colorectal cancer. -
Key words:
- SDC2 gene /
- Colorectal cancer /
- Clinical value
-
表 1 87例入组人群的一般临床资料( $\bar x \pm s $)
Table 1. General clinical information of the 87 enrolled cases ( $\bar x \pm s $)
项目 正常(n = 41) 结直肠腺瘤(n = 21) 结直肠癌(n = 25) F/χ2 P 性别(男/女) 36/5 18/3 17/8 4.369 0.113* 年龄(岁) 42.17 ± 13.54 42.38 ± 14.19 54.24 ± 11.79 7.330 0.001* SDC2甲基化检测
(阳性/阴性)2/39 12/9 21/4 43.727 <0.001* *P < 0.05。 表 2 粪便SDC2基因甲基化在结直肠腺瘤和结直肠癌中的表达情况比较( $\bar x \pm s $)
Table 2. Comparison of fecal SDC2 gene methylation expression in colorectal adenoma and colorectal cancer ( $\bar x \pm s $)
项目 正常(n = 41) 结直肠腺瘤(n = 21) 结直肠癌(n = 25) F P Ct值 40.15 ± 1.24 38.19 ± 2.94 36.62 ± 2.47 21.928 < 0.001* *P < 0.05。 表 3 粪便SDC2基因甲基化检测结直肠腺瘤和结直肠癌的阳性率[(n)%]
Table 3. Positive fecal SDC2 gene methylation for detection of colorectal adenoma and colorectal cancer [(n)%]
SDC2甲基化检测 结直肠镜(金标准) 合计 χ2 P 结直肠腺瘤 结直肠癌 阳性 12(57.14) 21(84.00) 33(71.74) 4.060 0.044* 阴性 9(42.86) 4(16.00) 13(28.26) 合计 21 25 46 *P < 0.05。 表 4 粪便SDC2基因甲基化在结直肠腺瘤和结直肠癌中的诊断价值
Table 4. Diagnostic value of fecal SDC2 gene methylation in colorectal adenoma and colorectal cancer
项目 AUC(95%CI) Cutoff值(%) 灵敏度(%) 特异度(%) 约登指数 P SDC基因甲基化 结直肠腺瘤 0.715(0.587~0.823) 37.63 57.14 95.12 0.523 0.010* 结直肠癌 0.918(0.824~0.971) 38.89 88.00 92.68 0.807 < 0.001* *P < 0.05。 -
[1] Wong M C S,Huang J,Lok V,et al. Differences in incidence and mortality trends of colorectal cancer worldwide based on sex,age,and anatomic location[J]. Clinical Gastroenterology and Hepatology,2020,19(5):955-966. [2] Sung H,Ferlay J,Siegal R L,et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA:A Cancer Journal for Clinicians,2021,71(3):209-249. doi: 10.3322/caac.21660 [3] Huybrechts I,Kliemann N,Perol O,et al. Feasibility study to assess the impact of a lifestyle intervention during colorectal cancer screening in France[J]. Nutrients,2021,13(11):3685. doi: 10.3390/nu13113685 [4] Edwardson N,Cartwright K,Sheche J,et al. Colorectal cancer screening among adults in Zuni Pueblo: Factors associated with FOBT and colonoscopy utilization[J]. J Community Health,2023,48(1):1-11. [5] Luo L,Liu Y,Zhang L,et al. Optimizing bowel preparation for colonoscopy: A cross-sectional study of the Chinese population[J]. Front Public Health,2022,10(1):953441. doi: 10.3389/fpubh.2022.953441 [6] Agrawal R,Majeed M,Attar B M,et al. Predictors of poor bowel preparations and colonoscopy cancellations in inpatient colonoscopies,a single center retrospective study[J]. Transl Gastroenterol Hepatol,2022,7(1):4. doi: 10.21037/tgh.2020.02.13 [7] 刘宇英,魏君丽,李艳红,等. 结直肠镜漏诊结直肠癌情况一致性的评价研究[J]. 中华疾病控制杂志,2020,24(8):961-964. doi: 10.16462/j.cnki.zhjbkz.2020.08.019 [8] Imperiale T F,Gruber R N,Stump T E,et al. Performance characteristics of fecal immunochemical tests for colorectal cancer and advanced adenomatous polyps: A systematic review and meta-analysis[J]. Annals of Internal Medicine,2019,170(5):319-329. doi: 10.7326/M18-2390 [9] Duran-Sanchon S,Herrera-Pariente C,Moreira L. New non-invasive biomarkers for colorectal cancer screening[J]. Rev Esp Enferm Dig,2020,112(8):642-648. [10] Nagtegaal I D,Odze R D,Klimstra D,et al. The 2019 WHO classification of tumours of the digestive system[J]. Histopathology,2020,76(2):182-188. doi: 10.1111/his.13975 [11] Kværner A S,Birkeland E,Bucher-Johannessen C,et al. The CRCbiome study: A large prospective cohort study examining the role of lifestyle and the gut microbiome in colorectal cancer screening participants[J]. BMC Cancer,2021,21(1):930. doi: 10.1186/s12885-021-08640-8 [12] 夏晨静,陈志荣. 粪便DNA甲基化检测对结直肠癌诊断及预后评估临床价值研究进展[J]. 临床军医杂志,2019,47(6):657-659. doi: 10.16680/j.1671-3826.2019.06.45 [13] Shaukat A,Kahi C J,Burke C A,et al. ACG clinical guidelines: Colorectal cancer screening 2021[J]. American Journal of Gastroenterology,2021,116(3):458-479. doi: 10.14309/ajg.0000000000001122 [14] Ahnen D J,Patel S G. Cost-effectiveness and national effects of initiating colorectal cancer screening for average-risk persons at age 45 years instead of 50 years[J]. Gastroenterology,2019,157(6):1691-1692. doi: 10.1053/j.gastro.2019.04.056 [15] Zhong G C,Sun W P,Wan L,et al. Efficacy and cost-effectiveness of fecal immunochemical test versus colonoscopy in colorectal cancer screening: A systematic review and meta-analysis[J]. Gastrointestinal Endoscopy,2020,91(3):684-697. doi: 10.1016/j.gie.2019.11.035 [16] Chan S C H,Liang J Q. Advances in tests for colorectal cancer screening and diagnosis[J]. Expert Review of Molecular Diagnostics,2022,22(4):449-460. doi: 10.1080/14737159.2022.2065197 [17] Zhang J,Yang C,Wu C,et al. DNA Methyltransferases in cancer: Biology,paradox,aberrations,and targeted therapy[J]. Cancers,2020,12(8):2123. doi: 10.3390/cancers12082123 [18] Fatemi N,Tierling S,Es H A,et al. DNA methylation biomarkers in colorectal cancer: Clinical applications for precision medicine[J]. International Journal of Cancer,2022,151(12):2068-2081. doi: 10.1002/ijc.34186 [19] Hua R,Yu J,Yan X,et al. Syndecan-2 in colorectal cancer plays oncogenic role via epithelial-mesenchymal transition and MAPK pathway[J]. Biomed Pharmacother,2020,121(1):109630. doi: 10.1016/j.biopha.2019.109630 [20] Wang L,Liu Y,Zhang D,et al. Diagnostic accuracy of DNA-based SDC2 methylation test in colorectal cancer screening: A meta-analysis[J]. BMC Gastroenterol,2022,22(1):314. doi: 10.1186/s12876-022-02395-7 [21] Han Y D,Oh T J,Chung T H,et al. Early detection of colorectal cancer based on presence of methylated syndecan-2 (SDC2) in stool DNA[J]. Clin Epigenetics,2019,11(1):51. doi: 10.1186/s13148-019-0642-0 [22] Wang J,Liu S,Wang H,et al. Robust performance of a novel stool DNA test of methylated SDC2 for colorectal cancer detection: A multicenter clinical study[J]. Clinical Epigenetics,2020,12(1):162. doi: 10.1186/s13148-020-00954-x [23] Syed A R,Thakkar P,Horne Z D,et al. Old vs new: Risk factors predicting early onset colorectal cancer[J]. World Journal of Gastrointestinal Oncology,2019,11(11):1011-1020. doi: 10.4251/wjgo.v11.i11.1011 -





 下载:
下载: