Changes of Serum Levels of 6-Keto-PGF1α,TGF-α and TXB2 during the Treatment of Peptic Ulcer in Children and Their Influence on Prognosis
-
摘要:
目的 探讨小儿消化性溃疡治疗期间血清6-酮前列腺素(6-Keto-PGF1α)、转化生长因子α(TGF-α)、血栓素B2(TXB2)水平变化,并分析其对预后的预测价值。 方法 选取2019年1月至2022年6月消化性溃疡患儿108例为研究对象,根据奥美拉唑三联疗法治疗效果分为预后良好组(86例)与预后不良组(22例)。比较2组临床资料、治疗期间血清6-Keto-PGF1α、TGF-α、TXB2水平。分析各血清指标对治疗预后的影响及预测预后价值。 结果 预后不良组治疗6周后血清6-Keto-PGF1α、TGF-α水平高于预后良好组,TXB2水平低于预后良好组,治疗前后各血清指标变化差值小于预后良好组(P < 0.05);血清6-Keto-PGF1α、TGF-α、TXB2变化差值与预后独立相关,且各血清指标变化差值阳性者发生预后不良风险分别为阴性者的5.804、4.014、3.241倍(P < 0.05);各血清指标变化差值联合预测预后的AUC大于单项指标预测(P < 0.05)。 结论 小儿消化性溃疡治疗期间血清6-Keto-PGF1α、TGF-α水平升高,而TXB2水平降低,治疗前后各血清指标水平变化与预后不良密切相关,联合检测其水平变化对预后不良具有一定预测价值。 Abstract:Objective To investigate the changes of serum levels of 6-Keto-PGF1α, transforming growth factor α (TGF-α) and thromboxane B2 (TXB2) during the treatment of peptic ulcer in children, and to analyze their prognostic value. Methods 108 children with peptic ulcer from January 2019 to June 2022 were selected as the study subjects. According to the therapeutic effect of omeprazole triple therapy, they were divided into the good prognosis group (86 cases) and the poor prognosis group (22 cases). The clinical data and serum levels of 6-Keto-PGF1α, TGF-α and TXB2 during the treatment were compared between the two groups to analyze the influence and prognostic value of each serum index on the treatment and prognosis. Results After 6 weeks of the treatment, the serum levels of 6-Keto-PGF1α and TGF-α in the poor prognosis group were higher than those in the good prognosis group, and the level of TXB2 was lower than that in the good prognosis group, and the difference of serum indexes before and after the treatment was smaller than that in the good prognosis group (P < 0.05). The difference of serum 6-Keto-PGF1α, TGF-α and TXB2 were independently correlated with the prognosis, and the risk of adverse prognosis in positive patients was 5.804, 4.014 and 3.241 times that of negative patients respectively (P < 0.05). The combined prediction AUC of the difference of serum indexes was greater than that of the single indexes (P < 0.05). Conclusion The serum levels of 6-Keto-PGF1α and TGF-α increased during the treatment of peptic ulcer in children, while the levels of TXB2 decreased. The changes of serum indexes before and after treatment are closely related to poor prognosis, and the combined detection of their changes has certain predictive value for poor prognosis. -
Key words:
- Peptic ulcer in children /
- 6-keto prostaglandin /
- Transforming growth factor α /
- Thromboxane B2 /
- Prognosis /
- Forecast
-
表 1 2组临床资料比较[n(%)/(
$\bar x \pm s $ )]Table 1. Comparison of clinical data between the two groups [n(%)/(
$\bar x \pm s $ )]资料 预后不良组(n = 22) 预后良好组(n = 86) t/χ2 P 性别 0.163 0.686 男 12(54.55) 51(59.30) 女 10(45.45) 35(40.70) 年龄(岁) 8.14 ± 1.71 8.23 ± 1.55 0.238 0.812 病程(月) 6.07 ± 1.23 5.89 ± 1.14 0.650 0.517 溃疡直径(cm) 2.16 ± 0.52 1.75 ± 0.39 4.096 0.000* 疾病类型 0.183 0.913 十二指肠溃疡 7(31.82) 29(33.72) 胃溃疡 12(54.55) 48(55.81) 复合型溃疡 3(13.64) 9(10.47) Hp阳性 12.806 0.000* 否 5(22.73) 56(65.12) 是 17(77.27) 30(34.88) 溃疡分期 7.120 0.008* 非活动期 8(36.36) 58(67.44) 活动期 14(63.64) 28(32.56) *P < 0.05。 表 2 2组治疗期间血清6-Keto-PGF1α、TGF-α、TXB2水平及变化差值比较(
$\bar x \pm s $ )Table 2. Comparison of serum levels of 6-Keto-PGF1α,TGF-α and TXB2 and their differences between the two groups during treatment (
$\bar x \pm s $ )指标 预后不良组(n = 22) 预后良好组(n = 86) t P 治疗前 6-Keto-PGF1α(pg/mL) 30.06 ± 6.48 29.73 ± 5.81 0.232 0.817 TGF-α(μg/L) 11.38 ± 3.04 11.09 ± 1.87 0.564 0.574 TXB2(pg/mL) 86.92 ± 18.27 88.14 ± 20.03 0.259 0.796 治疗6周后 6-Keto-PGF1α(pg/mL) 25.67 ± 4.22 18.46 ± 3.36 8.508 0.000* TGF-α(μg/L) 9.22 ± 2.17 6.28 ± 1.23 8.400 0.000* TXB2(pg/mL) 113.58 ± 17.60 136.21 ± 22.57 4.370 0.000* 治疗前与治疗6周后差值 6-Keto-PGF1α(pg/mL) 4.38 ± 1.15 11.27 ± 2.89 10.932 0.000* TGF-α(μg/L) 2.16 ± 0.70 4.81 ± 1.26 9.476 0.000* TXB2(pg/mL) 26.66 ± 8.23 48.07 ± 12.75 7.473 0.000* *P < 0.05。 表 3 血清6-Keto-PGF1α、TGF-α、TXB2变化差值与预后的关系
Table 3. Relationship between the difference of serum 6-Keto-PGF1α,TGF-α and TXB2 and prognosis
自变量 校正前 校正后 OR 95%CI P OR 95%CI P 6-Keto-PGF1α差值 0.510 0.424~0.613 < 0.001* 0.331 0.239~0.458 < 0.001* TGF-α差值 0.499 0.315~0.791 < 0.001* 0.439 0.301~0.639 < 0.001* TXB2差值 0.617 0.437~0.870 < 0.001* 0.395 0.280~0.557 < 0.001* *P < 0.05。 表 4 血清6-Keto-PGF1α、TGF-α、TXB2变化差值预测预后价值
Table 4. Prognostic value of serum difference of 6-Keto-PGF1α,TGF-α and TXB2
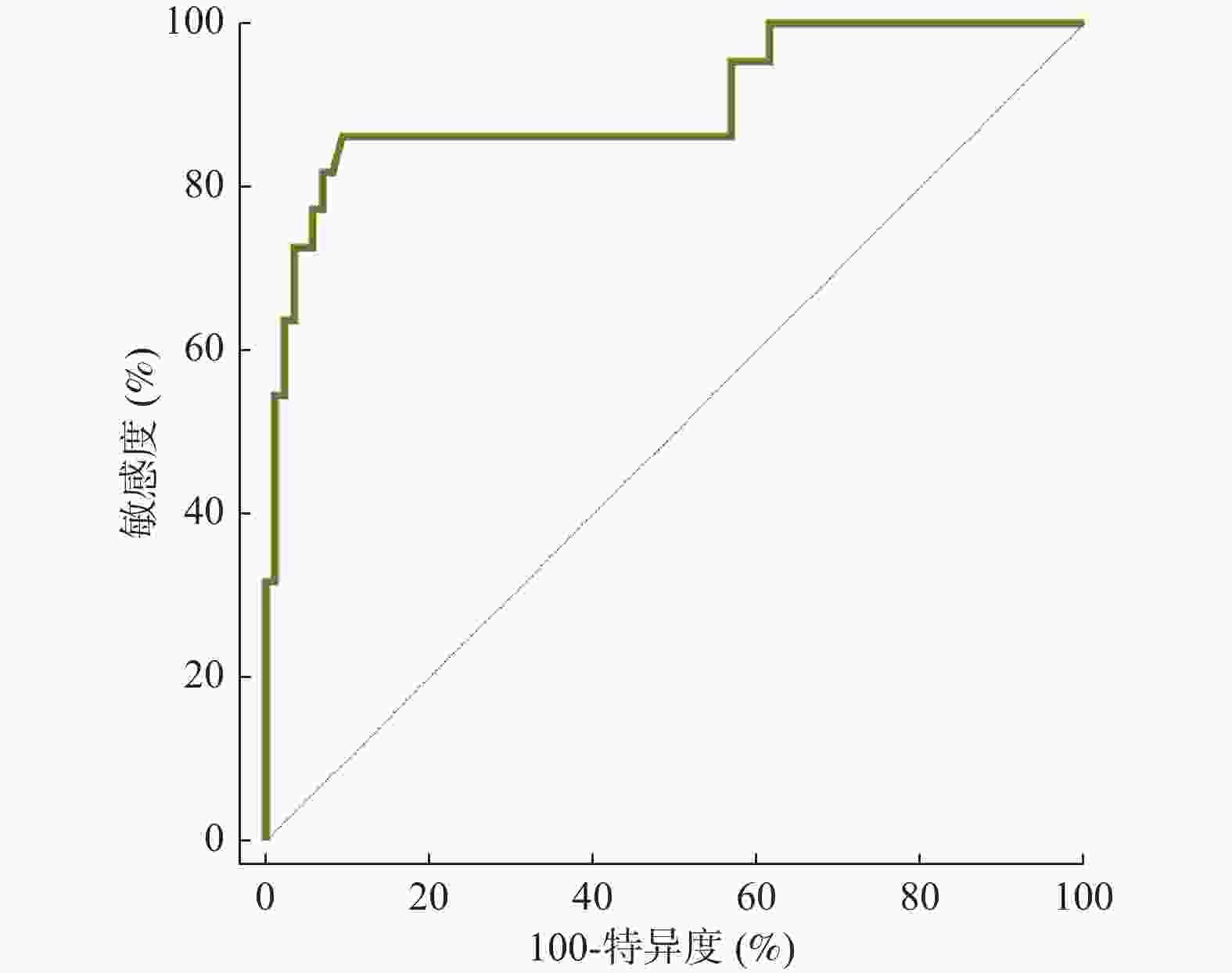
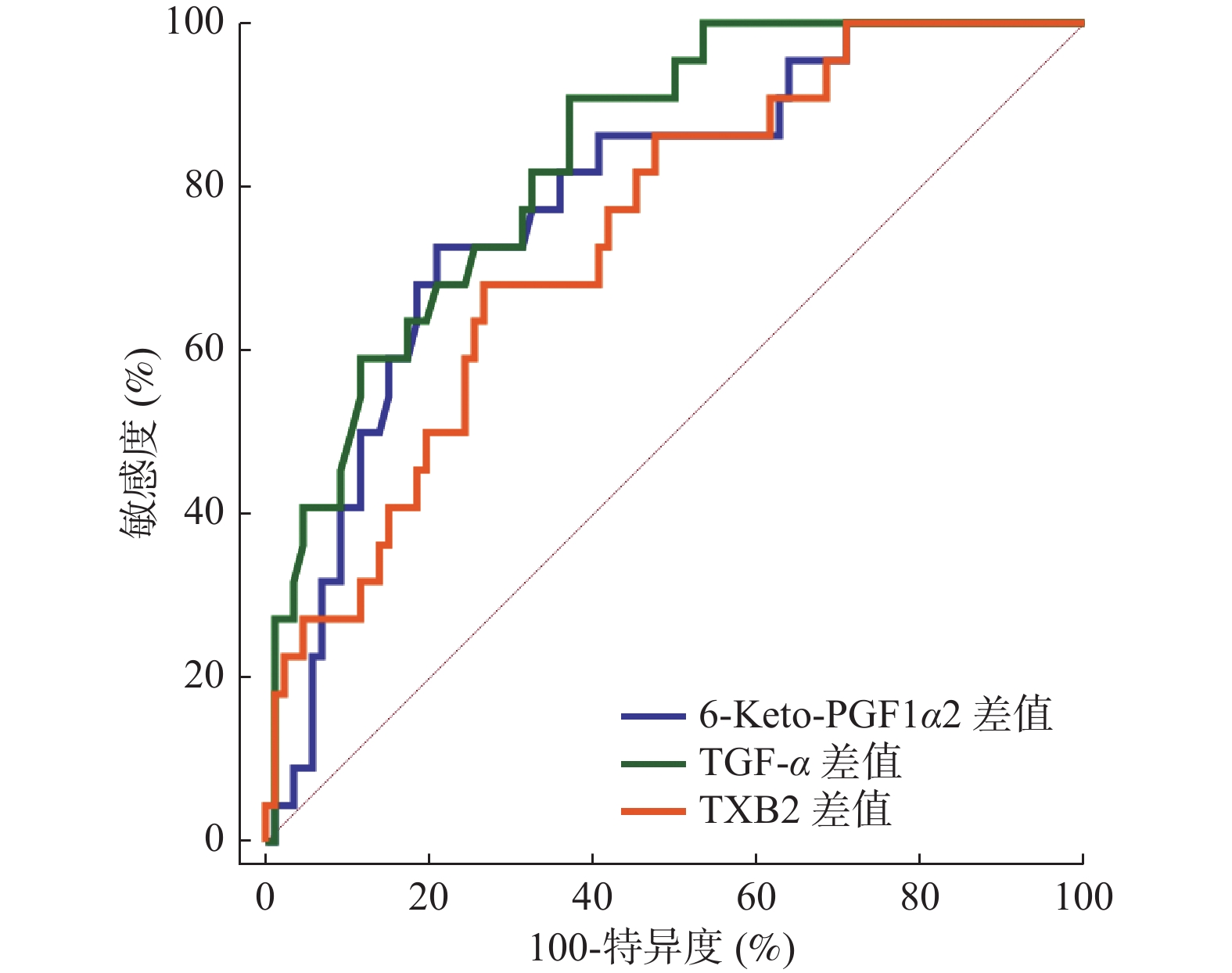
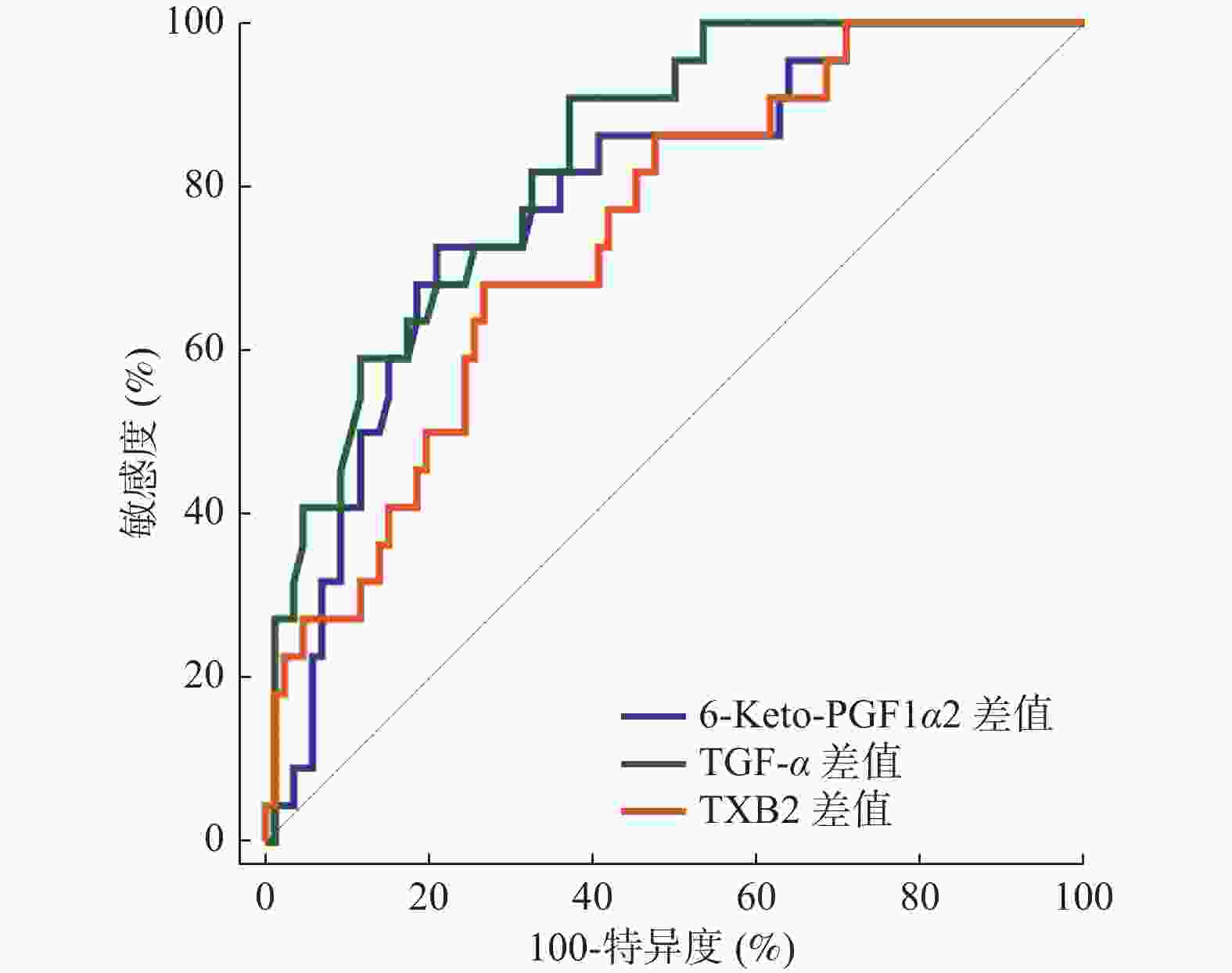
指标 AUC 95%CI 截断值 敏感度(%) 特异度(%) P 6-Keto-PGF1α差值 0.786 0.696~0.859 6.57 pg/mL 72.73 79.07 < 0.001* TGF-α差值 0.834 0.750~0.898 2.84 μg/L 90.91 62.79 < 0.001* TXB2差值 0.742 0.649~0.821 30.30 pg/mL 68.18 73.26 < 0.001* *P < 0.05。 表 5 以最佳截断值为界分析血清6-Keto-PGF1α、TGF-α、TXB2对预后的影响
Table 5. The effects of serum 6-Keto-PGF1α,TGF-α and TXB2 on prognosis were analyzed with the optimal cut-off value as the boundary
指标 预后不良组(n = 22) 预后良好组(n = 86) RR(95%CI) U P 6-Keto-PGF1α差值 阳性 16 18 5.804(2.491~13.523) 4.165 < 0.001* 阴性 6 68 TGF-α差值 阳性 20 32 10.769(2.646~43.833) 4.014 < 0.001* 阴性 2 54 TXB2差值 阳性 15 23 3.947(1.764~8.834) 3.241 0.001* 阴性 7 63 *P < 0.05。 -
[1] Lee E J,Lee Y J,Park J H. Usefulness of ultrasonography in the diagnosis of peptic ulcer disease in children[J]. Pediatr Gastroenterol Hepatol Nutr,2019,22(1):57-62. doi: 10.5223/pghn.2019.22.1.57 [2] Zhou B,Chen X,Huang B,et al. Changes in serum pepsinogen levels and their value as a predictor of treatment outcomes in children with peptic ulcer[J]. J Paediatr Child Health,2019,55(9):1103-1106. doi: 10.1111/jpc.14365 [3] 吕丹丹,孙海青. 奥美拉唑联合凝血酶治疗对慢性胃炎并消化性溃疡出血患者6-Keto-PGF1α及TXB2水平的影响[J]. 贵州医药,2021,45(12):1901-1902. doi: 10.3969/j.issn.1000-744X.2021.12.029 [4] Shi L,An Y,Cheng L,et al. Qingwei San treats oral ulcer subjected to stomach heat syndrome in db/db mice by targeting TLR4/MyD88/NF-κB pathway[J]. Chin Med,2022,17(1):1-10. doi: 10.1186/s13020-021-00565-5 [5] 辛铭,孟高乐,王琦,等. Hp感染消化性溃疡患者血清GAS、hs-CRP及TGF-α水平检测及其临床意义[J]. 中国实验诊断学,2020,24(10):1671-1672. doi: 10.3969/j.issn.1007-4287.2020.10.027 [6] 崔旭辉. 雷贝拉唑联合磷酸铝凝胶对消化性溃疡的临床价值[J]. 中国临床医生杂志,2020,48(9):1063-1065. doi: 10.3969/j.issn.2095-8552.2020.09.020 [7] 刘文忠,谢勇,成虹,等. 第四次全国幽门螺杆菌感染处理共识报告[J]. 胃肠病学,2012,17(10):618-625. doi: 10.3969/j.issn.1008-7125.2012.10.010 [8] 《中华儿科杂志》编辑委员会,中华医学会儿科学分会感染消化学组. 小儿慢性胃炎、消化性溃疡胃镜诊断标准[J]. 中华儿科杂志,2003,41(3):189-189. doi: 10.3760/j.issn:0578-1310.2003.03.011 [9] 谢代彬,王梅,贾雁平,等. 消化性溃疡合并幽门螺杆菌感染患儿奥美拉唑四联疗法治疗效果分析[J]. 中华医院感染学杂志,2016,26(5):1146-1148. [10] Li R,Wang W,Ma Y,et al. Analysis of risk factors for ulcer recurrence and upper gastrointestinal bleeding in children with peptic ulcer treated with Helicobacter pylori eradication therapy[J]. Transl Pediatr,2023,12(4):618-630. doi: 10.21037/tp-23-155 [11] Sochet A A,Son S,Ryan K S,et al. Stress ulcer prophylaxis in children with status asthmaticus receiving systemic corticosteroids: A descriptive study assessing frequency of clinically important bleeding[J]. J Asthma,2020,57(8):858-865. doi: 10.1080/02770903.2019.1614617 [12] Munoz Abraham A S,Osei H,Martino A,et al. Incidence and outcomes of perforated peptic ulcers in children: Analysis of the kid's inpatient database and report of two cases treated by laparoscopic omental patch repair[J]. J Laparoendosc Adv Surg Tech A,2019,29(2):248-255. doi: 10.1089/lap.2018.0186 [13] Kupczyk D,Bilski R,Przewięźlikowski A,et al. Concentration of proinflammatory cytokines in patients with ulcers as a complication of type 2 diabetes mellitus[J]. Postepy Dermatol Alergol,2021,38(5):767-772. doi: 10.5114/ada.2020.96702 [14] Yang X,Fan W,Huang R,et al. β-acetoxyisovaleryl alkannin (AAN-II) from Alkanna tinctoria promotes the healing of pressure-induced venous ulcers in a rabbit model through the activation of TGF-β/Smad3 signaling[J]. Cell Mol Biol Lett,2021,26(1):35-45. doi: 10.1186/s11658-021-00278-5 [15] Ek W E,Karlsson T,Höglund J,et al. Causal effects of inflammatory protein biomarkers on inflammatory diseases[J]. Sci Adv,2021,7(50):l4359-14369. doi: 10.1126/sciadv.abl4359 [16] Sun Q,Shi P,Lin C,et al. Effects of Astragalus polysaccharides nanoparticles on cerebral thrombosis in SD rats[J]. Front Bioeng Biotechnol,2020,8(1):616759-616769. [17] Tang Y,Huang S,Lin W,et al. Arachidonic acid-dependent pathway inhibition in platelets: Its role in multiple injury-induced coagulopathy and the potential mechanisms[J]. Shock,2021,55(1):121-127. doi: 10.1097/SHK.0000000000001563 [18] 闫黎娜,李彩虹,周晓燕,等. 降气止血汤辅助法莫替丁对消化性溃疡急性出血患儿TXB2、6-Keto-PGF1α水平的影响[J]. 现代生物医学进展,2019,19(23):4487-4490. doi: 10.13241/j.cnki.pmb.2019.23.020 [19] Wang W,Yang L,Song L,et al. Combination of Panax notoginseng saponins and aspirin potentiates platelet inhibition with alleviated gastric injury via modulating arachidonic acid metabolism[J]. Biomed Pharmacother,2021,134(1):111165-11175. [20] Chiang C Y,Chien C Y,Qiou W Y,et al. Genetic depletion of thromboxane A2/thromboxane-prostanoid receptor signalling prevents microvascular dysfunction in ischaemia/reperfusion injury[J]. Thromb Haemost,2018,118(11):1982-1996. doi: 10.1055/s-0038-1672206 [21] 赵军利,张利君. 降气止血汤联合西药对消化性溃疡急性出血患儿的疗效及对凝血功能的影响[J]. 血栓与止血学,2022,28(2):214-215. doi: 10.3969/j.issn.1009-6213.2022.02.015 [22] Ebrahiminaseri A,Sadeghizadeh M,Moshaii A,et al. Combination treatment of dendrosomal nanocurcumin and low-level laser therapy develops proliferation and migration of mouse embryonic fibroblasts and alter TGF-β,VEGF,TNF-α and IL-6 expressions involved in wound healing process[J]. PLoS One,2021,16(5):e0247098-e0247108. doi: 10.1371/journal.pone.0247098 [23] Cirac A,Tsaktanis T,Beyer T,et al. The aryl hydrocarbon receptor-dependent TGF-α/VEGF-B ratio correlates with disease subtype and prognosis in multiple sclerosis[J]. Neurol Neuroimmunol Neuroinflamm,2021,8(5):e1043-e1053. doi: 10.1212/NXI.0000000000001043 [24] Zhang S,Bai J,Li M,et al. Predictive value of transforming growth factor-α and Ki-67 for the prognosis of skull Base chordoma[J]. World Neurosurg,2019,129(1):199-206. [25] Yang Q Q,Fang M S,Tu J,et al. Guanxinning tablet inhibits the interaction between leukocyte integrin Mac-1 and platelet GPIbα for antithrombosis without increased bleeding risk[J]. Chin J Nat Med,2022,20(8):589-600. [26] Yamane S,Amano H,Ito Y,et al. The role of thromboxane prostanoid receptor signaling in gastric ulcer healing[J]. Int J Exp Pathol,2022,103(1):4-12. doi: 10.1111/iep.12410 [27] 高成超,程永波. 血小板异常与溃疡性结肠炎关系的研究进展[J]. 山东医药,2020,60(35):109-111. doi: 10.3969/j.issn.1002-266X.2020.35.030 -





 下载:
下载: