Differences of Placental Microbiota DNA between Gestational Diabetes Mellitus and Normal Full-term Mothers
-
摘要:
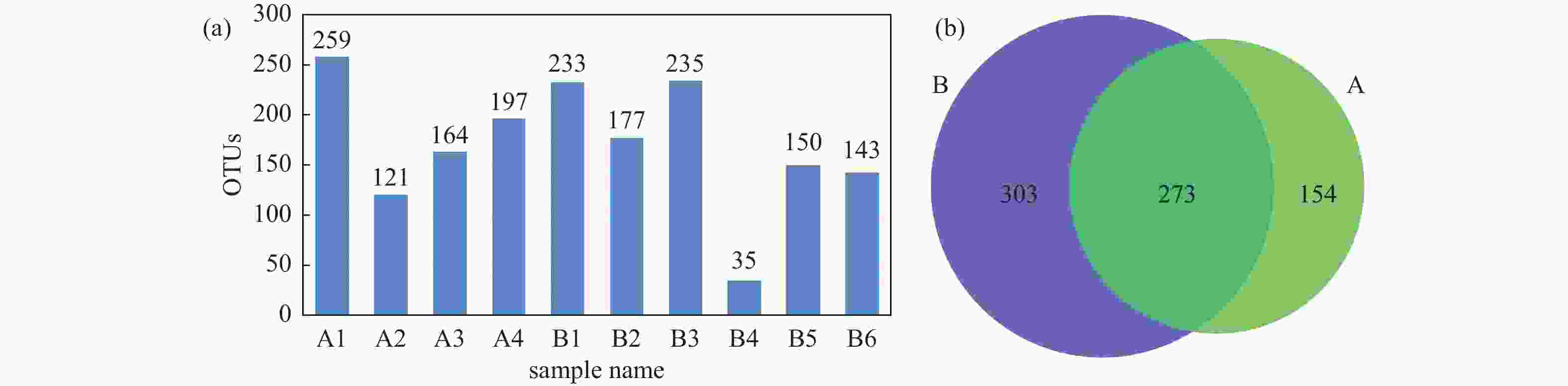
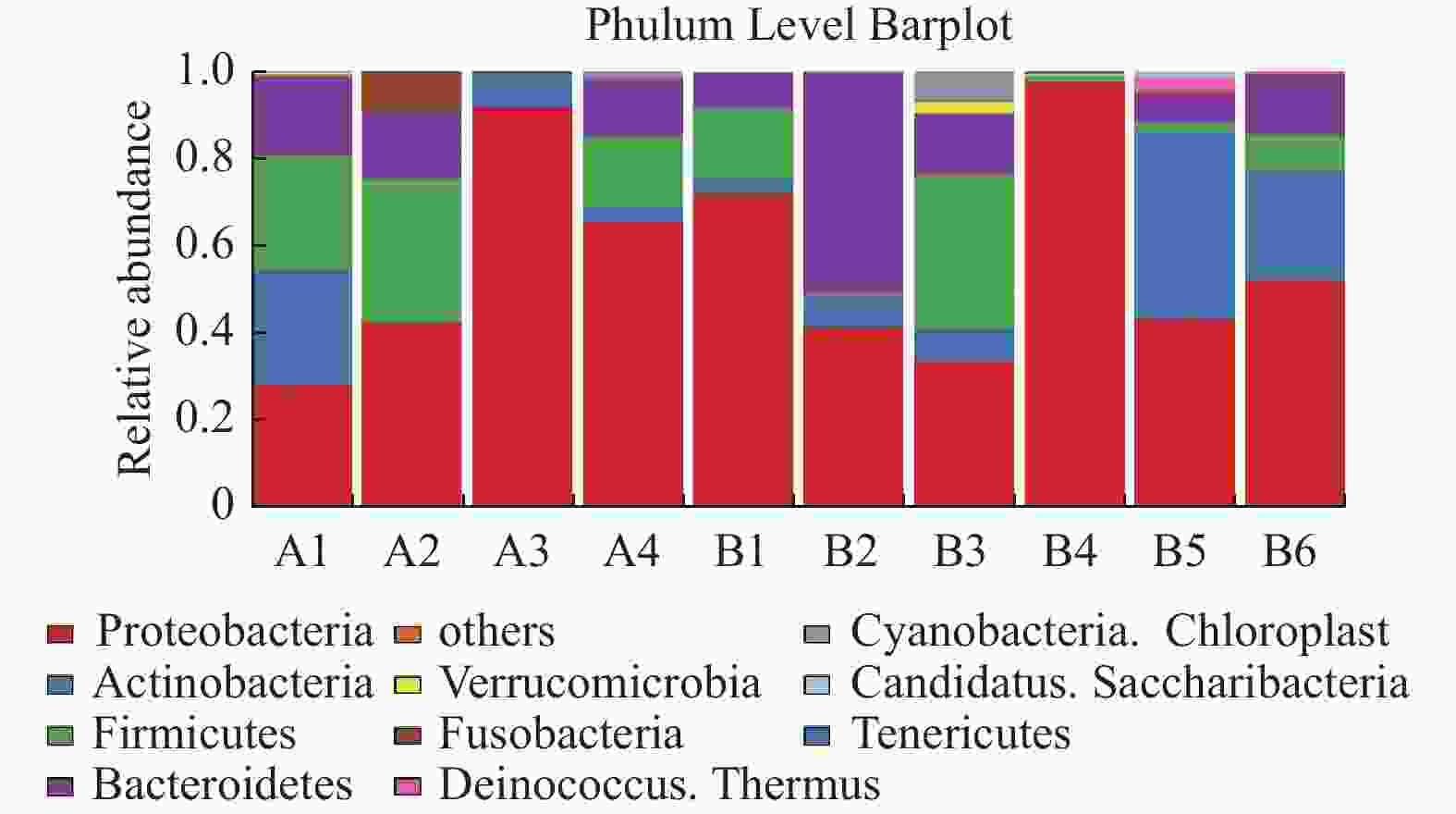
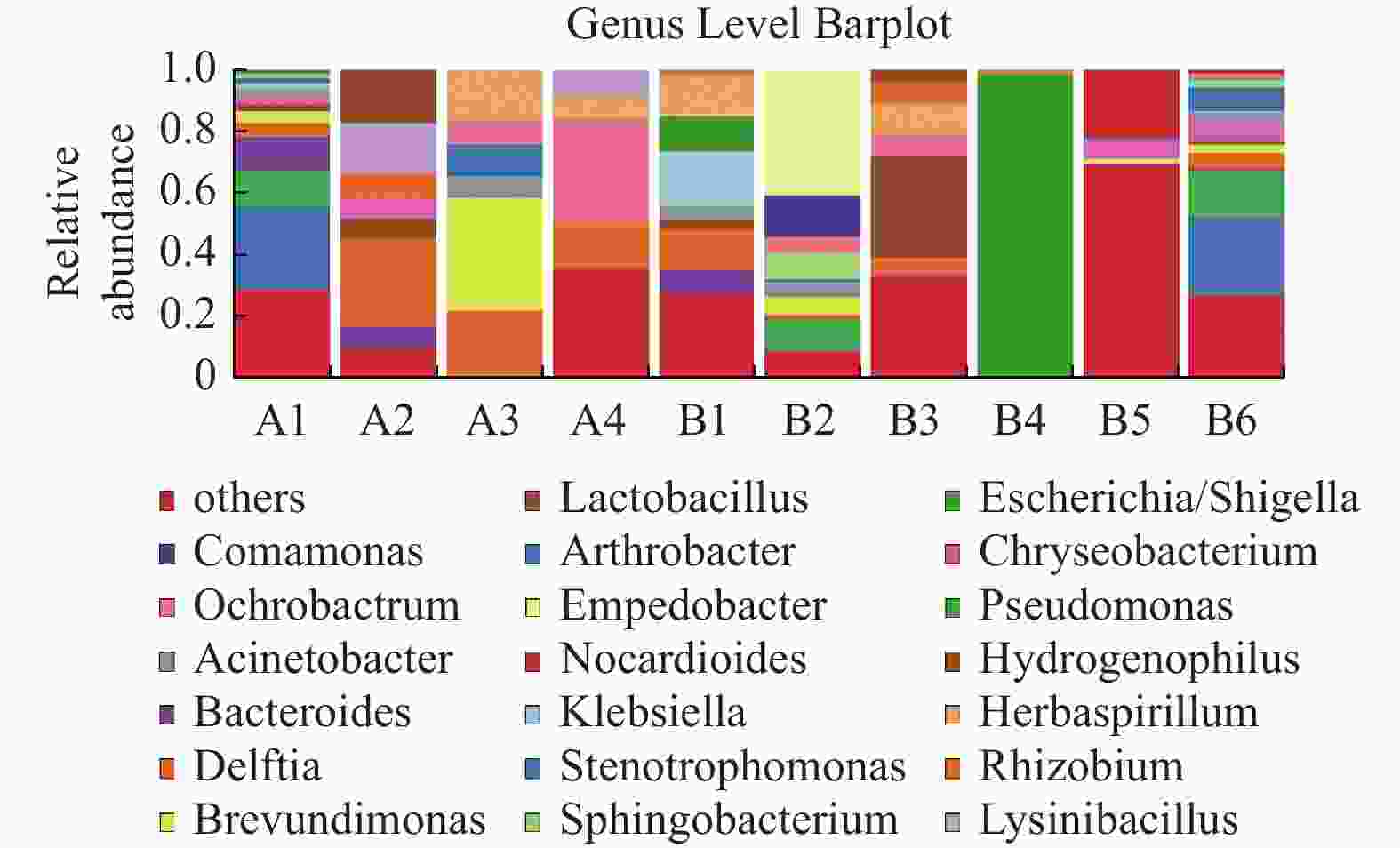
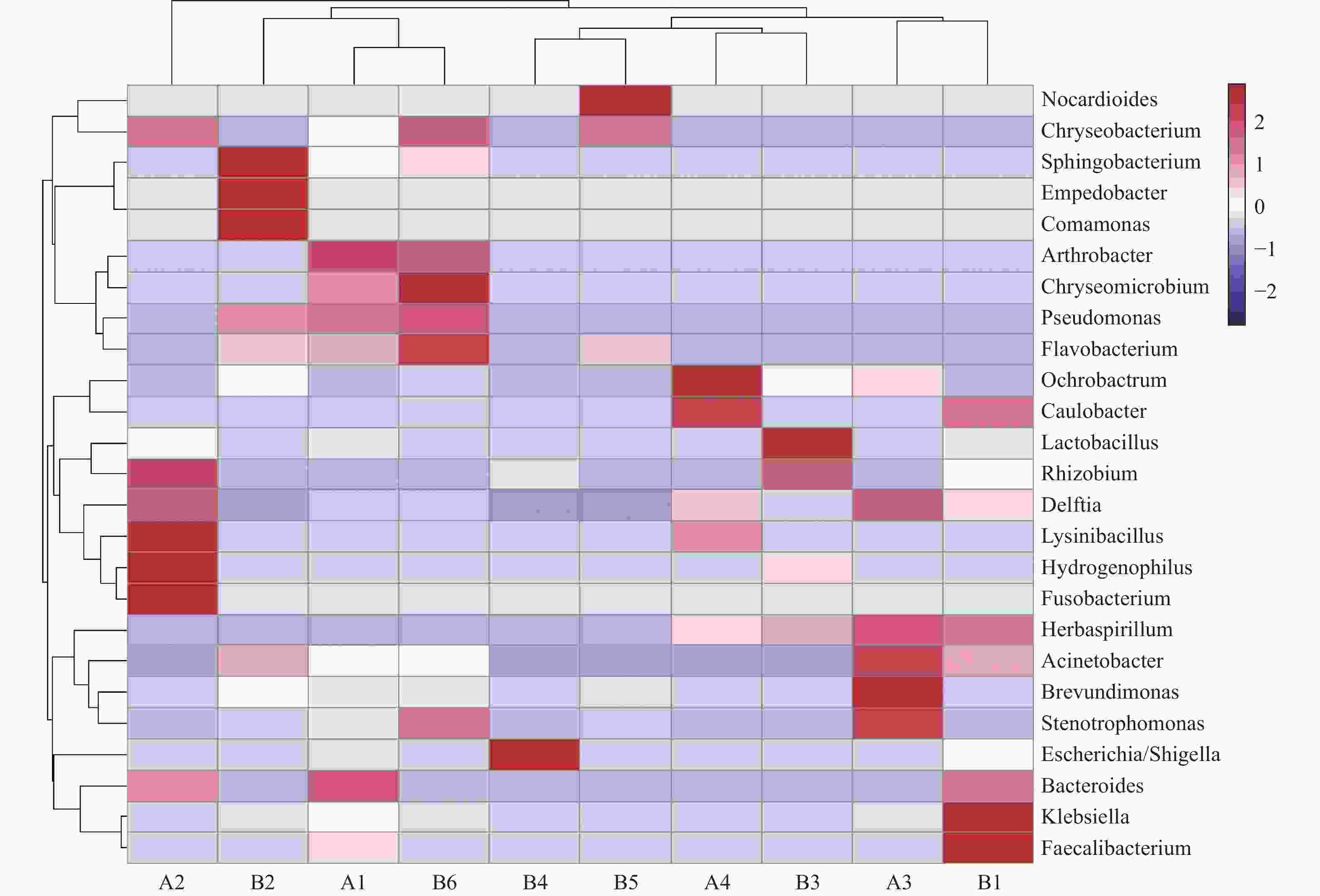
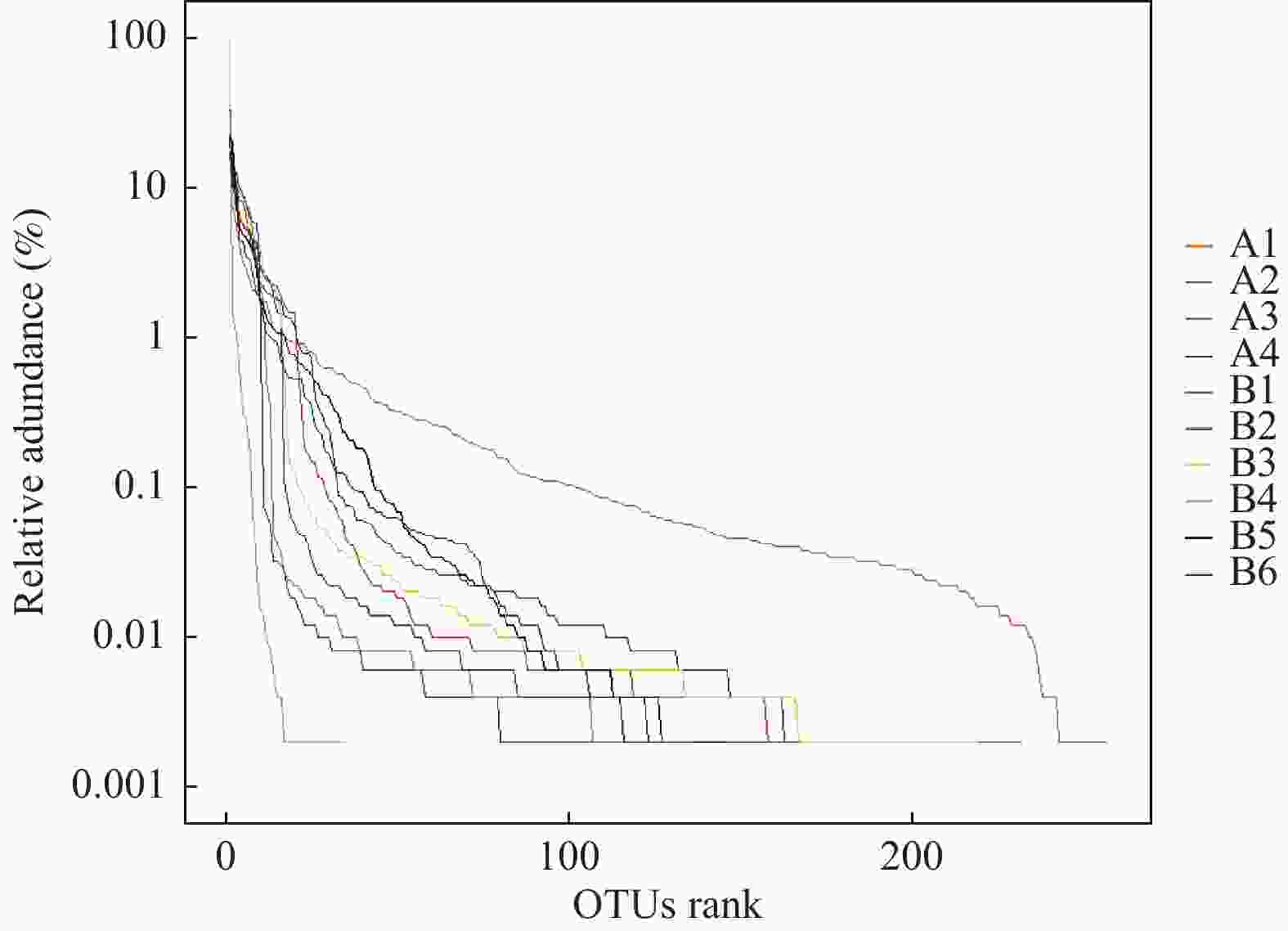
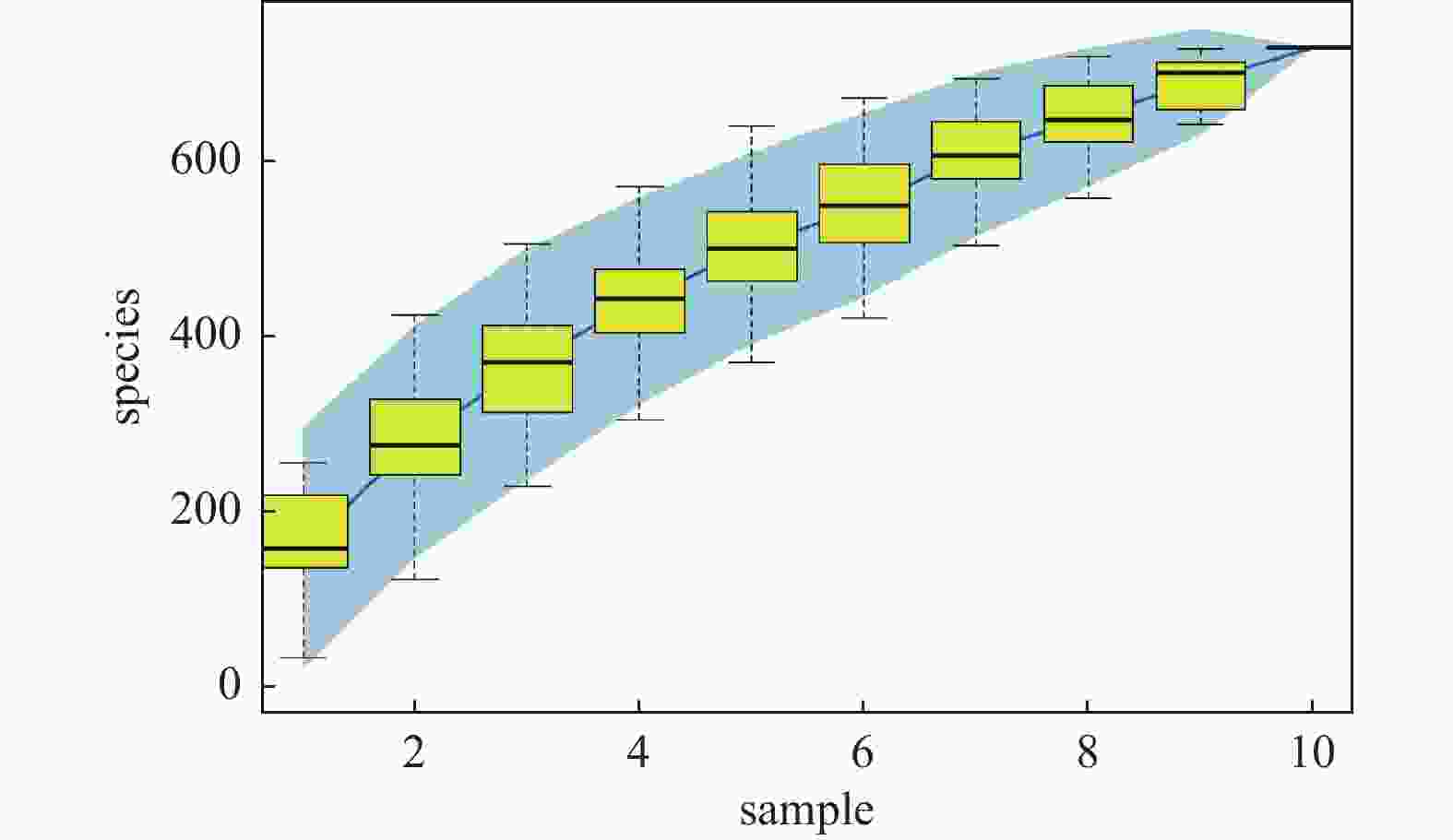
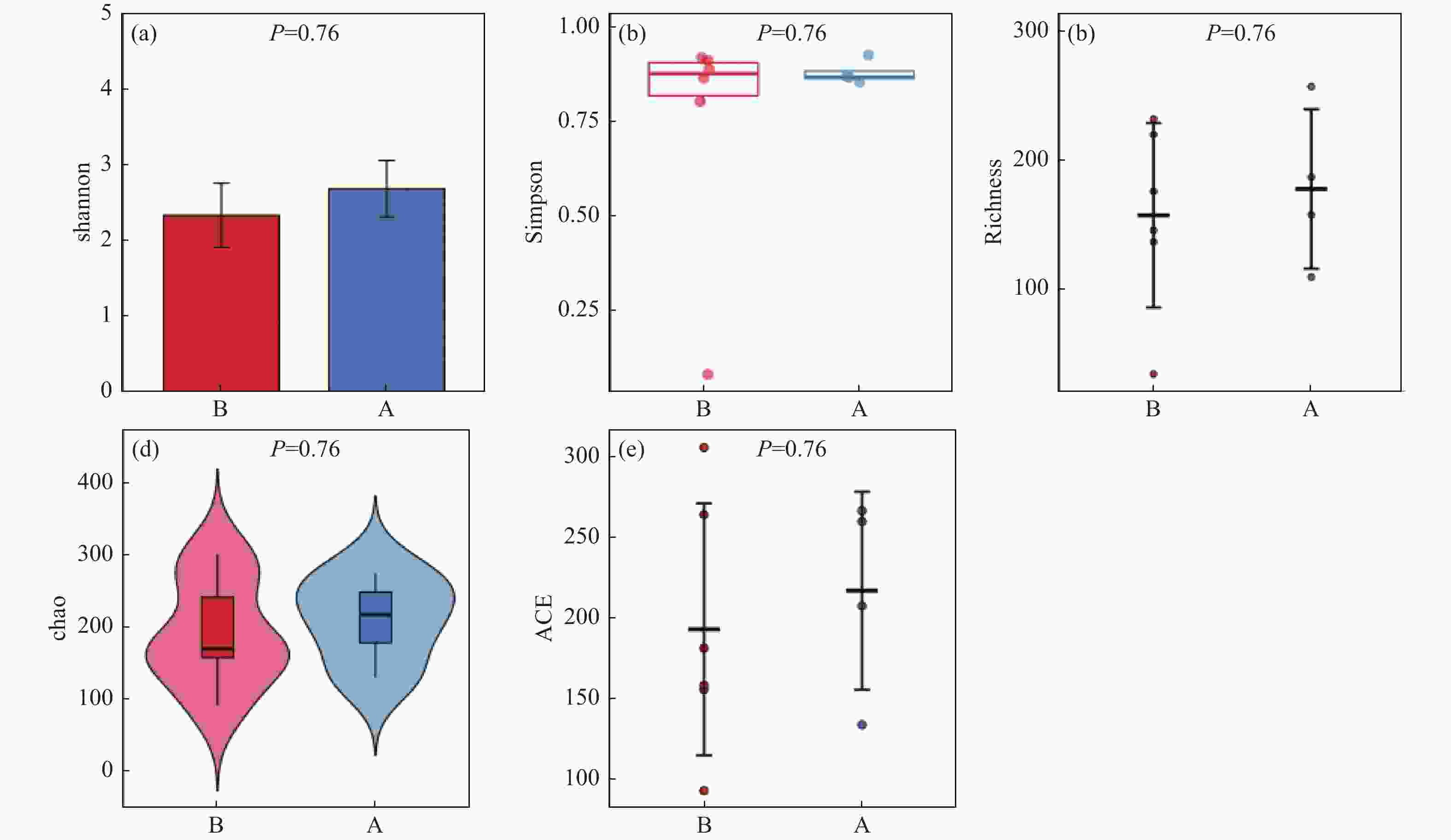
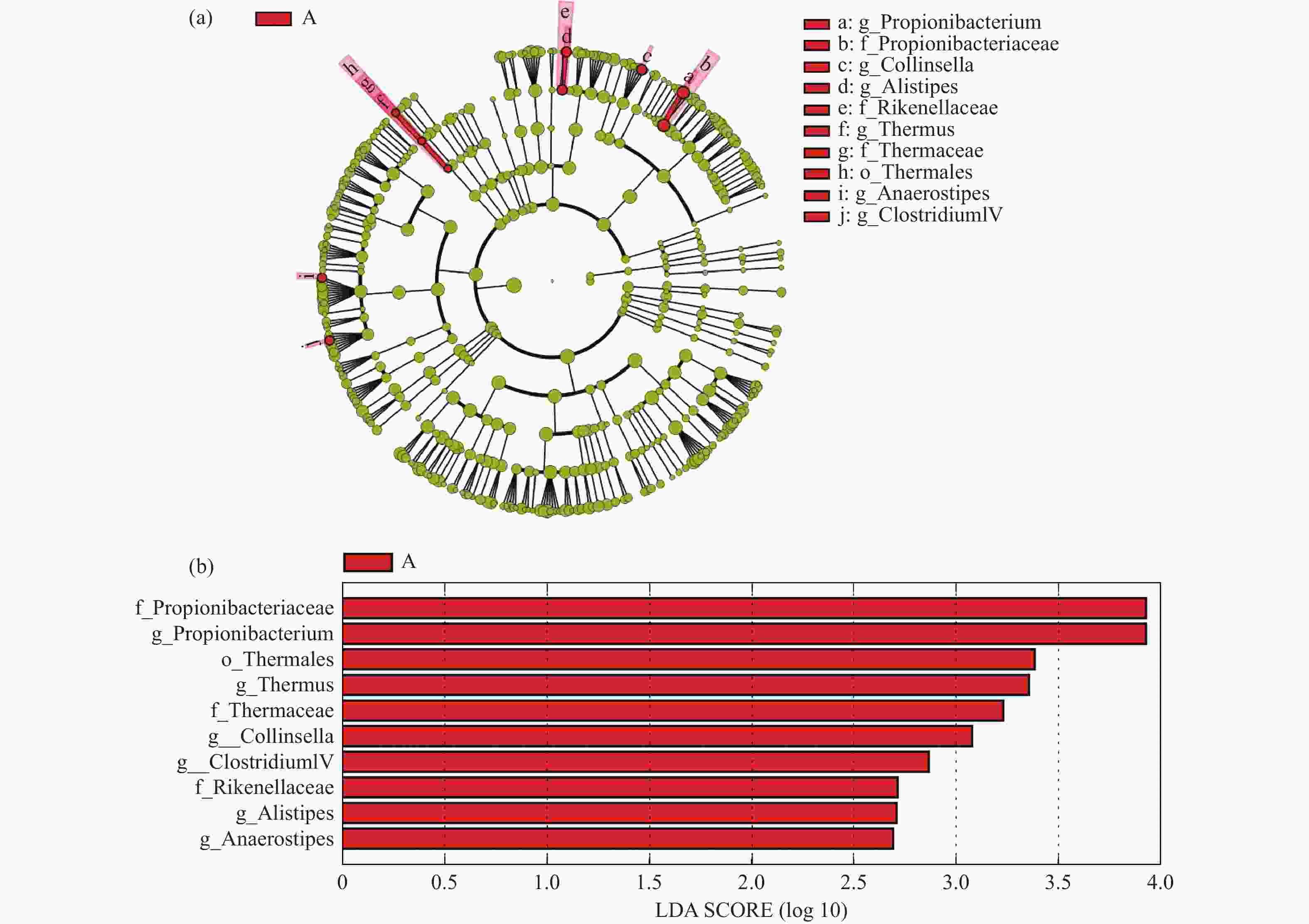
目的 探讨妊娠期糖尿病与正常足月儿母亲胎盘菌群DNA的差异,为今后深入研究提供参考数据。 方法 采集2018年2至9月在昆明医科大学第一附属医院产科分娩的足月儿母亲胎盘组织共30例,按是否伴有妊娠期糖尿病分为妊娠期糖尿病组(A组)与正常足月儿组(B组),通过Illumina MiSeq测序系统对胎盘组织中的细菌DNA进行测序后进行分析,比较2组胎盘菌群DNA的差异。 结果 所测定胎盘组织中都有以变形菌门、放线菌门、厚壁菌门、拟杆菌门等菌门为主的菌群DNA。采用LEfSe分析得出2组胎盘菌群DNA在门、纲水平上差异无统计学意义(P > 0.05),属水平上,丙酸杆菌属、栖热菌属、柯林斯菌属、梭状芽胞杆属IV、另枝菌属、厌氧菌属的相对丰度在妊娠期糖尿病组中显著升高(LDA > 2)。 结论 胎盘组织中可以检测到一定量的细菌DNA,母亲妊娠期糖尿病与正常足月儿其母亲胎盘菌群DNA的组成和丰度存在差异,这种差异可能影响妊娠期糖尿病的发生及预后,值得深入研究。 -
关键词:
- 胎盘菌群DNA /
- 16s rDNA高通量测序 /
- 妊娠期糖尿病 /
- 足月儿
Abstract:Objective To explore the differences of maternal placental microbiota DNA between gestational diabetes mellitus (GDM) and normal full-term infants, and provide reference data for further research. Methods A total of 30 cases of full-term infants’ placental tissue were collected from February to September 2018 at the First Affiliated Hospital of Kunming Medical University. The cases were divided into two groups: the gestational diabetes group (Group A) and the normal full-term infants group (Group B), based on the presence or absence of gestational diabetes. The bacterial DNA in the placental tissue was sequenced using the Illumina MiSeq sequencing system, and the differences in placental microbiota DNA between the two groups were compared. Results The DNA of microbial communities in the placental tissue was mainly composed of phyla such as Proteobacteria, Actinobacteria, Firmicutes, and Bacteroidetes. LEfSe analysis showed no statistically significant differences in the microbial communities at the phylum and class levels between the two groups (P > 0.05). However, at the genus level, the relative abundance of Propionibacterium, Thermus, Collinsella, Clostridium IV, Alistipes and Anaerostipes was significantly higher in the gestational diabetes group (LDA > 2). Conclusion The results of our study indicates that there are a rich microbiome DNA in the maternal placenta and that the composition and abundance of microbiome DNA are different between GDM and normal full-term infants, which may affect the occurrence and prognosis of GDM and deserves further study. -
表 1 A组与B组母婴一般情况比较(
$\bar x \pm s $ )Table 1. Comparison of maternal and infant general conditions between group A and B (
$\bar x \pm s $ )项目 妊娠期糖尿病组(A组,n = 4) 正常足月儿组(B组,n = 6) t P 性别
男/女(n)1/3 1/5 − 0.9991 出生方式
顺产/剖宫产(n)2/2 5/1 − 0.5001 脐动脉pH 7.230 ± 0.116 7.280 ± 0.036 0.834 0.459 脐动脉乳酸
(mmol/L)4.775 ± 3.398 4.550 ± 1.499 0.146 0.888 脐静脉pH 7.283 ± 0.079 7.358 ± 0.040 −1.770 0.151 脐静脉乳酸
(mmol/L)4.450 ± 3.440 4.733 ± 1.435 −0.183 0.859 母亲年龄(岁) 37.000 ± 5.888 28.330 ± 6.532 2.312 0.066 母亲孕前身体质量指数BMI(kg/m2) 25.519 ± 2.536 19.728 ± 1.429 4.671 0.002* 胎龄(d) 268.500 ± 9.256 273.000 ± 8.741 −0.780 0.458 出生体重(g) 2777.50 ± 634.27 3100.000 ± 337.460 −1.060 0.320 身长(cm) 47.500 ± 4.041 50.000 ± 1.789 −1.359 0.211 头围(cm) 32.750 ± 1.500 33.670 ± 1.211 −1.070 0.316 1为Fisher确切概率法计算的P值,*P < 0.05。 -
[1] Giannella L,Grelloni C,Quintili D,et al. Microbiome changes in pregnancy disorders[J]. Antioxidants,2023,12(2):463. doi: 10.3390/antiox12020463 [2] Dominguez-Bello M G,Godoy-Vitorino F,Knight R,et al. Role of the microbiome in human development[J]. Gut,2019,68(6):1108-1114. doi: 10.1136/gutjnl-2018-317503 [3] Tozzo P,Delicati A,Caenazzo L. Human microbiome and microbiota identification for preventing and controlling healthcare-associated infections: A systematic review[J]. Front Public Health,2022,10:989496. doi: 10.3389/fpubh.2022.989496 [4] Yao Y,Cai X,Chen C,et al. The role of microbiomes in pregnant women and offspring: Research progress of recent years[J]. Front Pharmacol,2020,11:643. doi: 10.3389/fphar.2020.00643 [5] Farhat S,Hemmatabadi M,Ejtahed H S,et al. Microbiome alterations in women with gestational diabetes mellitus and their offspring: A systematic review[J]. Frontiers in Endocrinology,2022,13:1060488. doi: 10.3389/fendo.2022.1060488 [6] Tang N,Luo Z C,Zhang L,et al. The association between gestational diabetes and microbiota in placenta and cord blood[J]. Frontiers in Endocrinology,2020,11:550319. doi: 10.3389/fendo.2020.550319 [7] La X,Wang Y,Xiong X,et al. The composition of placental microbiota and its association with adverse pregnancy outcomes[J]. Front Microbiol,2022,13:911852. doi: 10.3389/fmicb.2022.911852 [8] Zheng J,Xiao X,Zhang Q,et al. The placental microbiome varies in association with low birth weight in full-term neonates[J]. Nutrients,2015,7(8):6924-6937. doi: 10.3390/nu7085315 [9] 凌娅. 胎盘、阴道局部菌群改变与胎膜早破相关性研究[D]. 昆明: 昆明医科大学, 2022. [10] 熊晶晶,祁文瑾,胡红卫,等. 正常足月儿母亲胎盘菌群检析[J]. 昆明医科大学学报,2017,38(11):52-57. doi: 10.3969/j.issn.1003-4706.2017.11.013 [11] Wang H,Li N,Chivese T,et al. IDF diabetes atlas: Estimation of global and regional gestational diabetes mellitus prevalence for 2021 by international association of diabetes in pregnancy Study Group’s criteria[J]. Diabetes Research and Clinical Practice,2022,183:109050. doi: 10.1016/j.diabres.2021.109050 [12] Li Y,Ren X,He L,et al. Maternal age and the risk of gestational diabetes mellitus: A systematic review and meta-analysis of over 120 million participants[J]. Diabetes Res Clin Pract,2020,162:108044. doi: 10.1016/j.diabres.2020.108044 [13] Zhang Y,Xiao C M,Zhang Y,ea al. Factors associated with gestational diabetes mellitus: A meta-analysis[J]. J Diabetes Res,2021,2021:6692695. [14] Sun M,Luo M,Wang T,et al. Effect of the interaction between advanced maternal age and pre-pregnancy BMI on pre-eclampsia and GDM in Central China[J]. BMJ Open Diabetes Res Care,2023,11(2):e003324. doi: 10.1136/bmjdrc-2023-003324 [15] Ehlers E,Talton O O,Schust D J,et al. Placental structural abnormalities in gestational diabetes and when they develop: A scoping review[J]. Placenta,2021,116:58-66. doi: 10.1016/j.placenta.2021.04.005 [16] Xie W,Wang Y,Xiao S,et al. Association of gestational diabetes mellitus with overall and type specific cardiovascular and cerebrovascular diseases: Systematic review and meta-analysis[J]. BMJ,2022,378:e070244. [17] Johns E C,Denison F C,Norman J E,et al. Gestational diabetes mellitus: Mechanisms,treatment,and complications[J]. Trends Endocrinol Metab,2018,29(11):743-754. doi: 10.1016/j.tem.2018.09.004 [18] Ye W,Luo C,Huang J,Li C,et al. Gestational diabetes mellitus and adverse pregnancy outcomes: Systematic review and meta-analysis[J]. BMJ,2022,377:e067946. [19] Wu S,Jin J,Hu K L,et al. Prevention of gestational diabetes mellitus and gestational weight gain restriction in overweight/obese pregnant women: A systematic review and network meta-analysis[J]. Nutrients,2022,14(12):2383. doi: 10.3390/nu14122383 [20] Murray S R,Reynolds R M. Short- and long-term outcomes of gestational diabetes and its treatment on fetal development[J]. Prenat Diagn,2020,40(9):1085-1091. doi: 10.1002/pd.5768 [21] Tarry-Adkins J L,Aiken C E,Ozanne S E. Neonatal,infant,and childhood growth following metformin versus insulin treatment for gestational diabetes: A systematic review and meta-analysis[J]. PLoS Med,2019,16(8):e1002848. doi: 10.1371/journal.pmed.1002848 [22] Homayouni A,Bagheri N,Mohammad-Alizadeh-Charandabi S,et al. Prevention of gestational diabetes mellitus (GDM) and probiotics: Mechanism of action: A review[J]. Curr Diabetes Rev,2020,16(6):538-545. [23] Deng Y F,Wu L P,Liu Y P. Probiotics for preventing gestational diabetes in overweight or obese pregnant women: A review[J]. World J Clin Cases,2022,10(36):13189-13199. doi: 10.12998/wjcc.v10.i36.13189 [24] Zhou L,Ding C,Wu J,et al. Probiotics and synbiotics show clinical efficacy in treating gestational diabetes mellitus: A meta-analysis[J]. Prim Care Diabetes,2021,15(6):937-947. doi: 10.1016/j.pcd.2021.08.005 [25] Okesene-Gafa K A,Moore A E,Jordan V,et al. Probiotic treatment for women with gestational diabetes to improve maternal and infant health and well-being[J]. Cochrane Database Syst Rev,2020,6(6):CD012970. [26] Dolatkhah N,Hajifaraji M,Abbasalizadeh F,et al. Is there a value for probiotic supplements in gestational diabetes mellitus? A randomized clinical trial[J]. J Health Popul Nutr,2015,33:25. doi: 10.1186/s41043-015-0034-9 [27] Zakaria Z Z,Al-Rumaihi S,Al-Absi R S,et al. Physiological changes and interactions between microbiome and the host during pregnancy[J]. Front Cell Infect Microbiol,2022,12:824925. doi: 10.3389/fcimb.2022.824925 [28] Davidson S J,Barrett H L,Price S A,et al. Probiotics for preventing gestational diabetes[J]. Cochrane Database Syst Rev,2021,4(4):CD009951. [29] Zheng J,Xiao X,Zhang Q,et al. The placental microbiota is altered among subjects with gestational diabetes mellitus: A pilot study[J]. Front Physiol,2017,8:675. doi: 10.3389/fphys.2017.00675 [30] Bassols J,Serino M,Carreras-Badosa G,et al. Gestational diabetes is associated with changes in placental microbiota and microbiome[J]. Pediatr Res,2016,80(6):777-784. doi: 10.1038/pr.2016.155 [31] Zakis DR,Paulissen E,Kornete L,et al. The evidence for placental microbiome and its composition in healthy pregnancies: A systematic review[J]. J Reprod Immunol,2022,149:103455. doi: 10.1016/j.jri.2021.103455 -





 下载:
下载: