Effect of Pristimerin on Proliferation of Oral Squamous Cell Carcinoma CAL-27 by Regulating Autophagy
-
摘要:
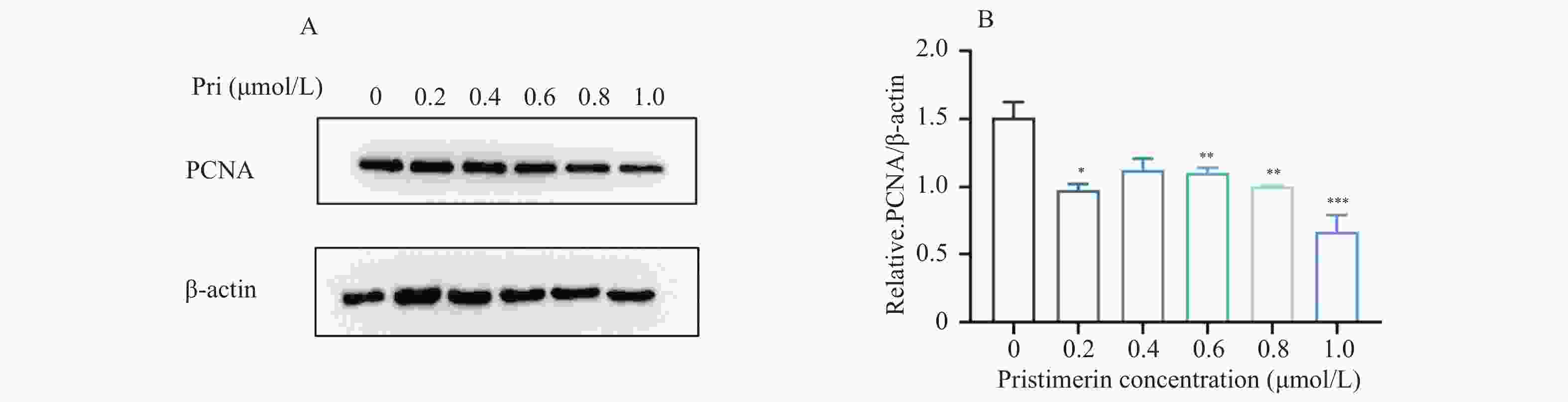
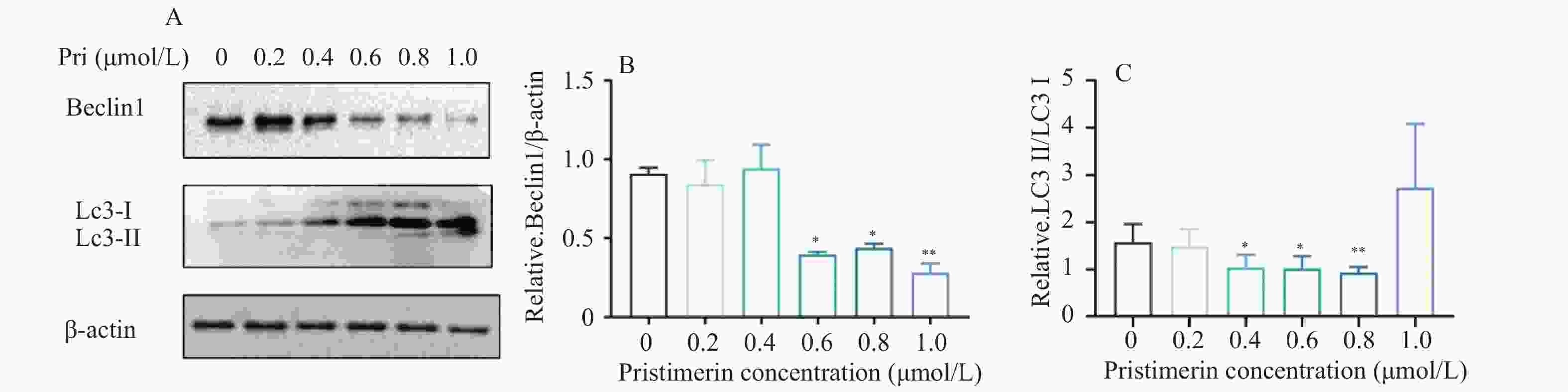
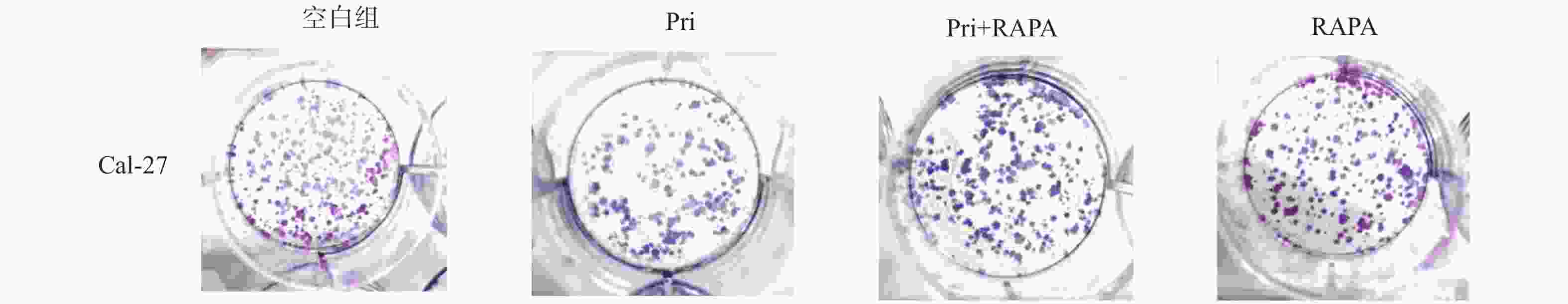
目的 探讨扁塑藤素对人口腔鳞状细胞癌细胞CAL-27增殖能力的影响及其相关作用机制。 方法 CCK8检测不同浓度的扁塑藤素处理CAL-27细胞后的增殖生物活性,计算不同作用时间段所对应的药物浓度水平(IC50);细胞集落形成实验检测CAL-27细胞克隆形成能力;蛋白质印迹法检测细胞增殖指标PCNA以及相关自噬通量BECLIN1、LC3B-II、LC3B-I蛋白表达水平;扁塑藤素联合自噬激动剂雷帕霉素(RAPA)处理CAL-27细胞,蛋白质印迹法检测PCNA以及相关自噬通量BECLIN1、LC3B-II、LC3B-I蛋白表达水平。 结果 较于空白组,各浓度梯度的扁塑藤素可抑制CAL-27细胞活力(P < 0.05),具有浓度-时间依耐性;相较于空白组,经扁塑藤素处理后细胞中PCNA、BECLIN1、LC3B-II/LC3B-I蛋白表达水平都出现明显上调(P < 0.05);扁塑藤素联合自噬激活剂雷帕霉素(RAPA)处理CAL-27细胞相较于仅使用扁塑藤素组细胞活性有所增强(P < 0.05),PCNA、BECLIN1、LC3B-II/LC3B-I蛋白的表达水平均出现明显上调(P < 0.05)。 结论 扁塑藤素在体外能够比较显著抑制口腔鳞状癌系CAL-27细胞的增殖,这可能与其下调自噬相关基因BECLIN1、LC3B-II、LC3B-I的表达相关。 Abstract:Objective To investigate the effect of pristimerin on the proliferation ability of human oral squamous cell carcinoma cells CAL-27 and its related mechanisms. Methods CCK-8 assay was performed to determine the proliferative bioactivity of CAL-27 cells treated with different concentrations of pristimerin, and the IC50 was calculated for different time periods. Colony formation assay was used to detect the cloning ability of CAL-27 cells. Western blotting was used to detect the protein expression levels of the proliferation marker PCNA and the autophagy flux markers BECLIN1, LC3B-II, and LC3B-I. CAL-27 cells were treated with pristimerin in combination with the autophagy inducer rapamycin (RAPA), and Western blotting was used to detect the protein expression levels of PCNA and the autophagy flux markers BECLIN1, LC3B-II, and LC3B-I. Results Compared with the blank group, the pristimerin at various concentration gradients can inhibit the viability of CAL-27 cells (P < 0.05), and it exhibits concentration-time dependence. Compared with the blank group, the expression levels of PCNA, BECLIN1 and LC3B-II/LC3B-I proteins in cells were significantly upregulated after treatment with the pristimerin (P < 0.05). Compared with the group treated with only the pristimerin, the combined treatment of the pristimerin with the autophagy activator rapamycin (RAPA) enhanced the cell activity of CAL-27 cells (P < 0.05), and the expression levels of PCNA, BECLIN1, and LC3B-II/LC3B-I proteins were significantly upregulated (P < 0.05). Conclusion Pristimerin significantly inhibits the proliferation of CAL-27 oral squamous carcinoma cells in vitro, which may be associated with downregulation of autophagy-related genes BECLIN1, LC3B-II, and LC3B-I. -
Key words:
- Pristimerin /
- Oral squamous cell carcinoma /
- Proliferation /
- Autophagy
-
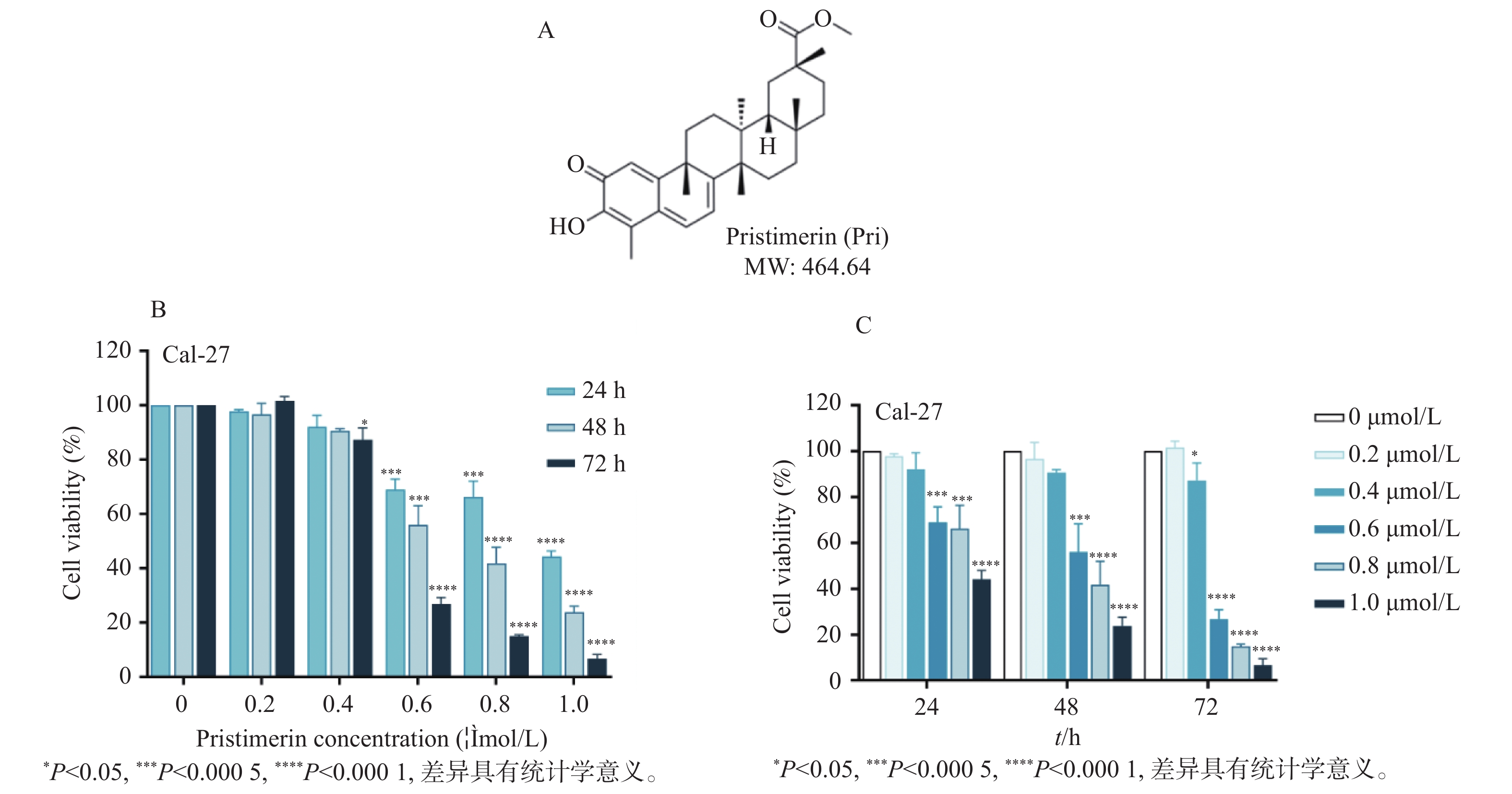
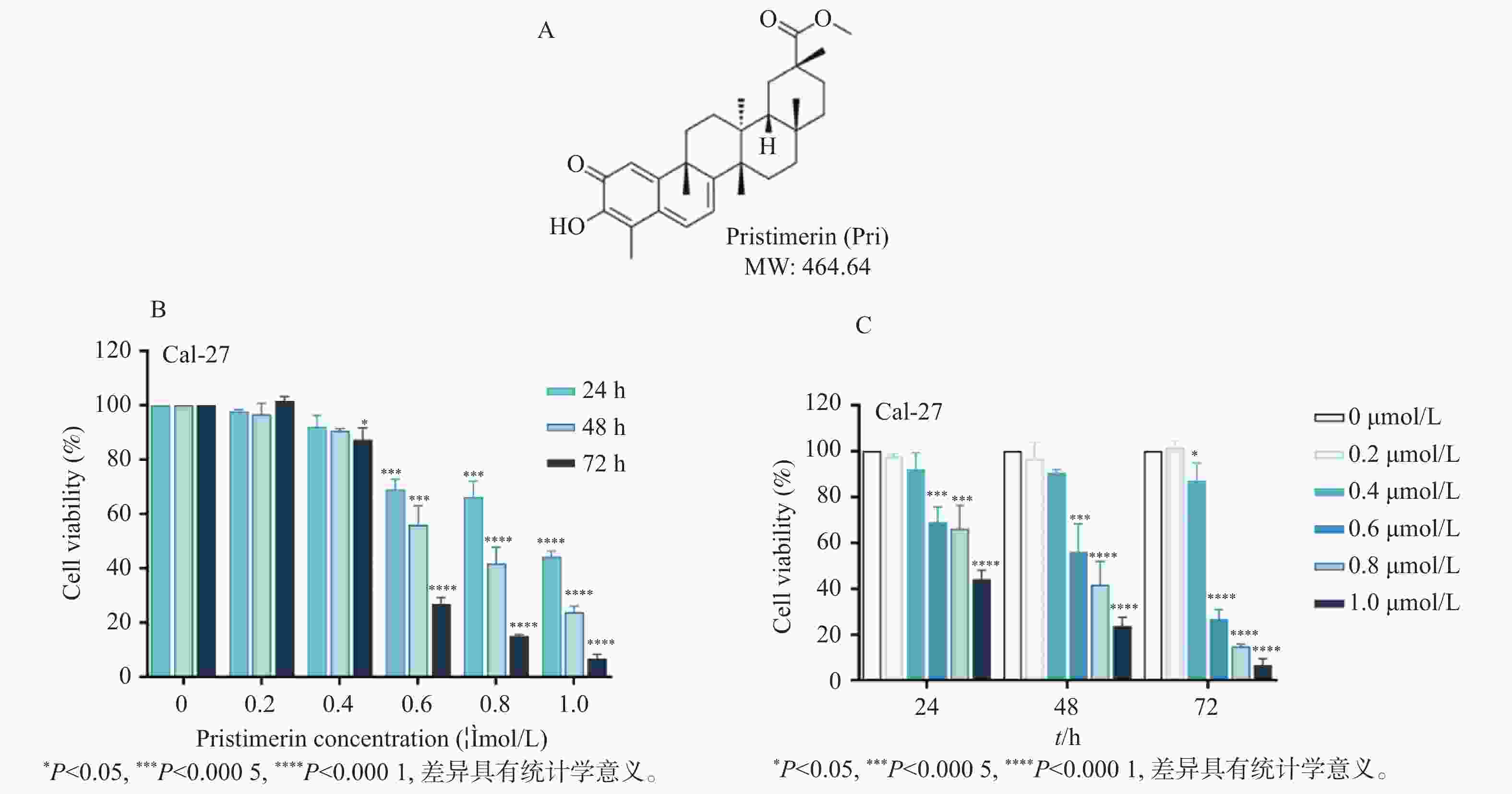
图 1 扁塑藤素抑制口腔鳞状癌Cal-27细胞增殖
A:扁塑藤素化学式和分子结构[17];B:CCK-8测定不同浓度扁塑藤素处理Cal-27细胞对细胞增殖的影响;C:CCK-8定扁塑藤素处理Cal-27细胞24 h、48 h、72 h对细胞增殖的影响。与0 μmol/L组相比,*P < 0.05,***P < 0.0005,****P < 0.0001。
Figure 1. Pristimerin suppresses proliferation of oral squamous cell carcinoma cell
-
[1] Liu J,Jiang X,Zou A,et al. CircIGHG-induced epithelial-to-mesenchymal transition promotes oral squamous cell carcinoma progression via miR-142-5p/igf2bp3 signaling[J]. Cancer Res,2021,81(2):344-355. doi: 10.1158/0008-5472.CAN-20-0554 [2] Sung H,Ferlay J,Siegel R L,et al. Global cancer statistics 2020: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2021,71(3):209-249. doi: 10.3322/caac.21660 [3] Yang Z,Yan G,Zheng L,et al. YKT6,as a potential predictor of prognosis and immunotherapy response for oral squamous cell carcinoma,is related to cell invasion,metastasis,and CD8+ T cell infiltration[J]. Oncoimmunology,2021,10(1):1938890. doi: 10.1080/2162402X.2021.1938890 [4] Ling Z,Cheng B,Tao X. Epithelial-to-mesenchymal transition in oral squamous cell carcinoma: Challenges and opportunities[J]. Int J Cancer,2021,148(7):1548-1561. doi: 10.1002/ijc.33352 [5] Khadela A,Shah Y,Mistry P,et al. Immunomodulatory therapy in head and neck squamous cell carcinoma: Recent advances and clinical prospects[J]. Technol Cancer Res Treat,2023,22:2081074849. [6] Debnath J,Gammoh N,Ryan K M. Autophagy and autophagy-related pathways in cancer[J]. Nat Rev Mol Cell Biol,2023,24(8):560-575. doi: 10.1038/s41580-023-00585-z [7] Cheon S Y,Kim H,Rubinsztein D C,et al. Autophagy,cellular aging and age-related human diseases[J]. Exp Neurobiol,2019,28(6):643-657. doi: 10.5607/en.2019.28.6.643 [8] Lock R,Kenific C M,Leidal A M,et al. Autophagy-dependent production of secreted factors facilitates oncogenic ras-driven invasion[J]. Cancer Discov,2014,4(4):466-479. doi: 10.1158/2159-8290.CD-13-0841 [9] Tompkins K D,Thorburn A. Regulation of apoptosis by autophagy to enhance cancer therapy[J]. Yale J Biol Med,2019,92(4):707-718. [10] Bahrami A,Khazaei M,Hassanian S M,et al. Targeting the tumor microenvironment as a potential therapeutic approach in colorectal cancer: rational and progress[J]. J Cell Physiol,2018,233(4):2928-2936. doi: 10.1002/jcp.26041 [11] Wang Y,Feng W,Wang X,et al. The multifaceted mechanisms of pristimerin in the treatment of tumors state-of-the-art[J]. Biomed Pharmacother,2022,154:113575. doi: 10.1016/j.biopha.2022.113575 [12] Shaaban A A,El-Kashef D H,Hamed M F,et al. Protective effect of pristimerin against lps-induced acute lung injury in mice[J]. Int Immunopharmacol,2018,59:31-39. doi: 10.1016/j.intimp.2018.03.033 [13] Cheng S,Zhang Z,Hu C,et al. Pristimerin suppressed breast cancer progression via mir-542-5p/dub3 axis[J]. Onco Targets Ther,2020,13(1171):6651-6660. [14] Li J,Guo Q,Lei X,et al. Pristimerin induces apoptosis and inhibits proliferation,migration in h1299 lung cancer cells[J]. J Cancer,2020,11(21):6348-6355. doi: 10.7150/jca.44431 [15] Zhao Q,Bi Y,Guo J,et al. Effect of pristimerin on apoptosis through activation of ros/ endoplasmic reticulum (ER) stress-mediated noxa in colorectal cancer[J]. Phytomedicine,2021,80:153399. doi: 10.1016/j.phymed.2020.153399 [16] Zhang Y,Wang J,Hui B,et al. Pristimerin enhances the effect of cisplatin by inhibiting the miR-23a/Akt/GSK3β signaling pathway and suppressing autophagy in lung cancer cells[J]. Int J Mol Med,2019,43(3):1382-1394. [17] Zhao Q,Cheng X,Yu W,et al. Pristimerin induces apoptosis and tumor inhibition of oral squamous cell carcinoma through activating ros-dependent er stress/noxa pathway[J]. Phytomedicine,2021,92(11):153723. [18] Zhao Q,Liu Y,Zhong J,et al. Pristimerin induces apoptosis and autophagy via activation of ros/ask1/jnk pathway in human breast cancer in vitro and in vivo[J]. Cell Death Discov,2019,5(87):125. [19] 石艺,钟燕,刘小虎,等. 扁塑藤素增强顺铂对条件性重编程原代肺癌细胞敏感性的机制[J]. 实用医学杂志,2022,38(7):841-847. doi: 10.3969/j.issn.1006-5725.2022.07.012 [20] 周鑫,杨进,陈林,等. 扁塑藤素对膀胱癌细胞增殖和凋亡的影响及其作用机制[J]. 中国癌症防治杂志,2023,15(1):18-24. [21] Condello M,Pellegrini E,Caraglia M,et al. Targeting autophagy to overcome human diseases[J]. Int J Mol Sci,2019,20(3):725. doi: 10.3390/ijms20030725 [22] Yun C W,Lee S H. The roles of autophagy in cancer[J]. Int J Mol Sci,2018,19(11):725. [23] Rakesh R,PriyaDharshini L C,Sakthivel K M,et al. Role and regulation of autophagy in cancer[J]. Biochim Biophys Acta Mol Basis Dis,2022,1868(7):166400. doi: 10.1016/j.bbadis.2022.166400 [24] Milkovic L,Cipak G A,Cindric M,et al. Short overview of ros as cell function regulators and their implications in therapy concepts[J]. Cells,2019,8(8):793. doi: 10.3390/cells8080793 [25] Nascimbeni A C,Codogno P,Morel E. Local detection of ptdIns3p at autophagosome biogenesis membrane platforms[J]. Autophagy,2017,13(9):1602-1612. doi: 10.1080/15548627.2017.1341465 [26] Ko J H,Yoon S O,Lee H J,et al. Rapamycin regulates macrophage activation by inhibiting nlrp3 inflammasome-p38 mapk-nfκb pathways in autophagy- and p62-dependent manners[J]. Oncotarget,2017,8(25):40817-40831. doi: 10.18632/oncotarget.17256 -





 下载:
下载: