Use of Paroxetine in Outpatients of a Tertiary Psychiatric Hospital in Jiangsu Province
-
摘要:
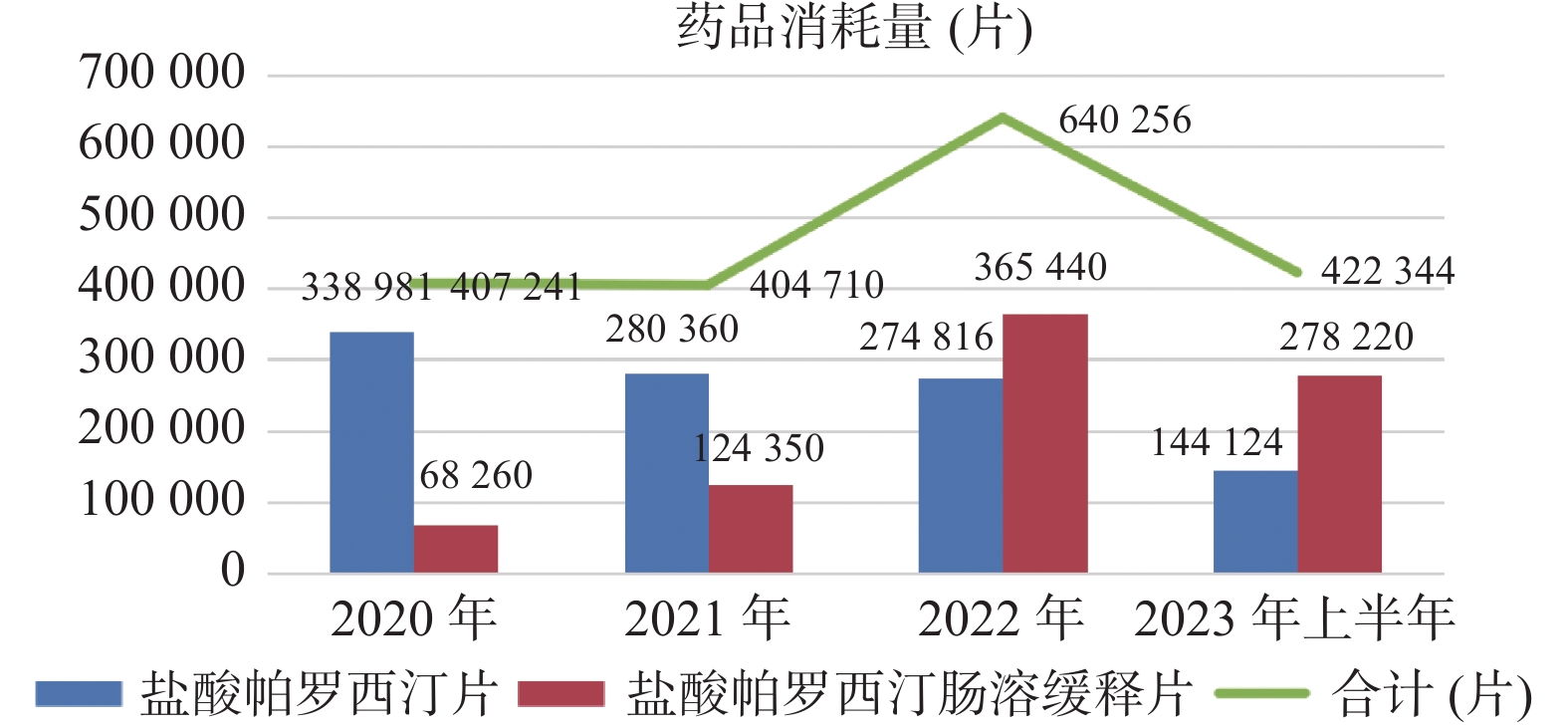
目的 评价门诊患者帕罗西汀的临床应用情况。 方法 采用回顾性分析,收集医院2020年1月1日至2023年6月30日所有使用过帕罗西汀门诊患者的处方信息,分析患者的结构特征及用药量、频率、费用等信息,评估处方的合理性。 结果 共纳入帕罗西汀有效处方28106张,其中男性9257例,女性18849例;盐酸帕罗西汀片的使用量逐年下降,盐酸帕罗西汀肠溶缓释片的使用量逐年上升;患者人均单位剂量的药费金额逐年上升;存在超适应症、剂量不规范、超疗程、儿童和青少年超说明书用药等不合格处方。 结论 帕罗西汀的临床应用存在用药不规范、超说明书用药等不合理情况,需进一步加强帕罗西汀在门诊患者中的用药管理。 Abstract:Objective To evaluate the clinical application of paroxetine in outpatients. Methods A retrospective analysis was used to collect the prescription information of all outpatients who used paroxetine in the hospital from January 1, 2020 to June 30, 2023. The structural characteristics of patients and information on medication dosage, frequency, and cost were analyzed to evaluate the rationality of prescriptions. Results A total of 28, 106 valid prescriptions for paroxetine were included, of which 9257 were male and 18849 were female. The use of paroxetine hydrochloride tablets decreased annually while the use of enteric-coated paroxetine hydrochloride sustained-release tablets increased annually. The annual use of paroxetine hydrochloride tablets decreased, while the annual use of enteric-coated paroxetine hydrochloride sustained-release tablets increased. The average cost of the drug per patient unit dose increased each year. Non-compliant prescriptions included off-label use, improper dosage, excessive treatment duration, and off-label use in children and adolescents. Conclusion The clinical application of paroxetine is not standardized, and there are unreasonable situations such as overuse. It is necessary to further strengthen the medication management of paroxetine in outpatient patients. -
Key words:
- Paroxetine /
- Outpatients /
- Prescription /
- Rational use of drugs
-
表 1 患者基本信息[n(%)]
Table 1. Basic information of patients [n(%)]
年龄段(岁) 性别 P 男 女 ≤17 120(0.43) 192(0.68) < 0.001* 18~64 7136(25.39) 13350(47.50) < 0.001* ≥65 2001(7.12) 5307(18.88) < 0.001* 小计 9257(32.94) 18849(67.06) < 0.001* *P<0.05。 表 2 帕罗西汀的人均单位剂量费用
Table 2. Drug amount per capita for paroxetin
项目 2020年 2021年 2022年 2023年上半年 处方数 6127 4966 10302 6711 人均剂量(mg) 1385.04 1755.12 1420.34 1465.95 人均金额(元) 125.91 176.04 165.32 177.32 单价(元/mg) 0.091 0.100 0.116 0.121 表 3 2020.1.1~2023.6.30帕罗西汀处方诊断前十名排序表
Table 3. The top 10 diagnoses in prescriptions of paroxetine from Jan,1st 2020 to Jun,30th 2023
诊断 例数(n) 百分比(%) 神经症性障碍 5388 19.17 焦虑障碍 4458 15.86 抑郁发作 3997 14.22 抑郁状态 3304 11.76 焦虑状态 2792 9.93 复发性抑郁障碍 1793 6.38 精神分裂症 996 3.54 睡眠障碍 799 2.84 强迫性障碍 583 2.07 非器质性失眠症 495 1.76 小计 24605 87.54 表 4 不合理处方的具体问题情况
Table 4. Specific problems of irrational prescriptions
具体问题 例次(n) 百分比(%) 用药剂量不适宜 379 26.82 用药频次不适宜 326 23.07 超说明书用药 312 22.08 超疗程用药 233 16.49 超适应症用药 148 10.47 重复用药 15 1.06 小计 1413 100.00 -
[1] Kowalska M,Nowaczyk J,Fijałkowski Ł,et al. Paroxetine-overview of the molecular mechanisms of action[J]. Int J Mol Sci,2021,22(4):1662. doi: 10.3390/ijms22041662 [2] Tyrer P,Tyrer H,Yang M. Relationships between treatments received in the nottingham study of neurotic disorder over 30 years and personality status[J]. Personal Ment Health,2022,16(2):99-110. doi: 10.1002/pmh.1535 [3] 中华医学会行为医学分会,中华医学会行为医学分会认知应对治疗学组. 抑郁症治疗与管理的专家推荐意见(2022年)[J]. 中华行为医学与脑科学杂志,2023,32(3):193-202. doi: 10.3760/cma.j.cn371468-20220921-00563 [4] 龚涛,姜思思,马宁,等. 广泛性焦虑障碍基层诊疗指南(2021年)[J]. 中华全科医师杂志,2021,20(12):1232-1241. doi: 10.3760/cma.j.cn114798-20211025-00790 [5] Gao X,Wang Z,Guo L,et al. Consensus on the pharmacological treatment of acute stress disorder in Chinese pilots: A delphi study[J]. BMC Psychiatry,2023,23(1):664. doi: 10.1186/s12888-023-05145-5 [6] Mohseni Rad H,Zahirian Moghadam T,Hosseinkhani A,et al. Comparison of dapoxetine /tadalafil and paroxetine/tadalafil combination therapies for the treatment of the premature ejaculation: A randomized clinical trial[J]. Urol J,2021,19(2):138-143. [7] Önal H T,Yetkin D,Ayaz F. Paroxetine's effect on the proinflammatory cytokine stimulation and intracellular signaling pathways in J774.2 cells[J]. Naunyn Schmiedebergs Arch Pharmacol,2023,396(11):3327-3335. doi: 10.1007/s00210-023-02669-1 [8] Feduccia A A,Jerome L,Yazar-Klosinski B,et al. Breakthrough for trauma treatment: Safety and efficacy of MDMA-assisted psychotherapy compared to paroxetine and sertraline[J]. Focus (Am Psychiatr Publ),2023,21(3):306-314. [9] 李湘. 丁螺环酮联合帕罗西汀治疗焦虑症患者的效果[J]. 国际精神病学杂志,2023,50(1):82-85. doi: 10.13479/j.cnki.jip.2023.01.034 [10] 中华人民共和国药典. 临床用药须知·化学药和生物制品卷 [M]. 2020年版. 北京: 中国医药科技出版社, 2020: 228-229. [11] 中华医学会,中华医学会杂志社,中华医学会全科医学分会等. 抑郁症基层诊疗指南(2021年)[J]. 中华全科医师杂志,2021,20(12):1249-1260. doi: 10.3760/cma.j.cn114798-20211020-00778 [12] 浙江华海药业股份有限公司. 盐酸帕罗西汀片说明书[DB/OL]. https://yp.120ask.com/manual/47053.html , 2023-08-10. [13] 司天梅,王振,李凌江. 抗抑郁药品临床综合评价专家共识[J]. 中国药房,2023,34(13):1547-1554. doi: 10.6039/j.issn.1001-0408.2023.13.02 [14] 邱宏,顾文洁,刘帅,等. 基于真实世界数据的抑郁症知识图谱构建[J]. 中国卫生信息管理杂志,2023,20(2):278-284. [15] 陈松,裴莹子,杨少杰,等. 盐酸帕罗西汀肠溶缓释片在中国健康受试者中的生物等效性研究[J]. 中国临床药理学杂志,2022,38(24):3025-3030. [16] Jiang L L,Wu Y L,Mo Y,et al. The effects of paroxetine therapy on depressive symptom and motor function in the treatment of depression with Parkinson's disease: A meta-analysis[J]. Medicine (Baltimore),2023,102(34):e34687. [17] 刘晓华,彭代辉,王韵,等. 伴焦虑痛苦特征抑郁症的临床诊治专家共识[J]. 精神医学杂志,2021,34(1):74-78. -






 下载:
下载: