Correlation of Preoperative Anemia Types with Pathological Features and Prognosis in Patients with Colorectal Cancer
-
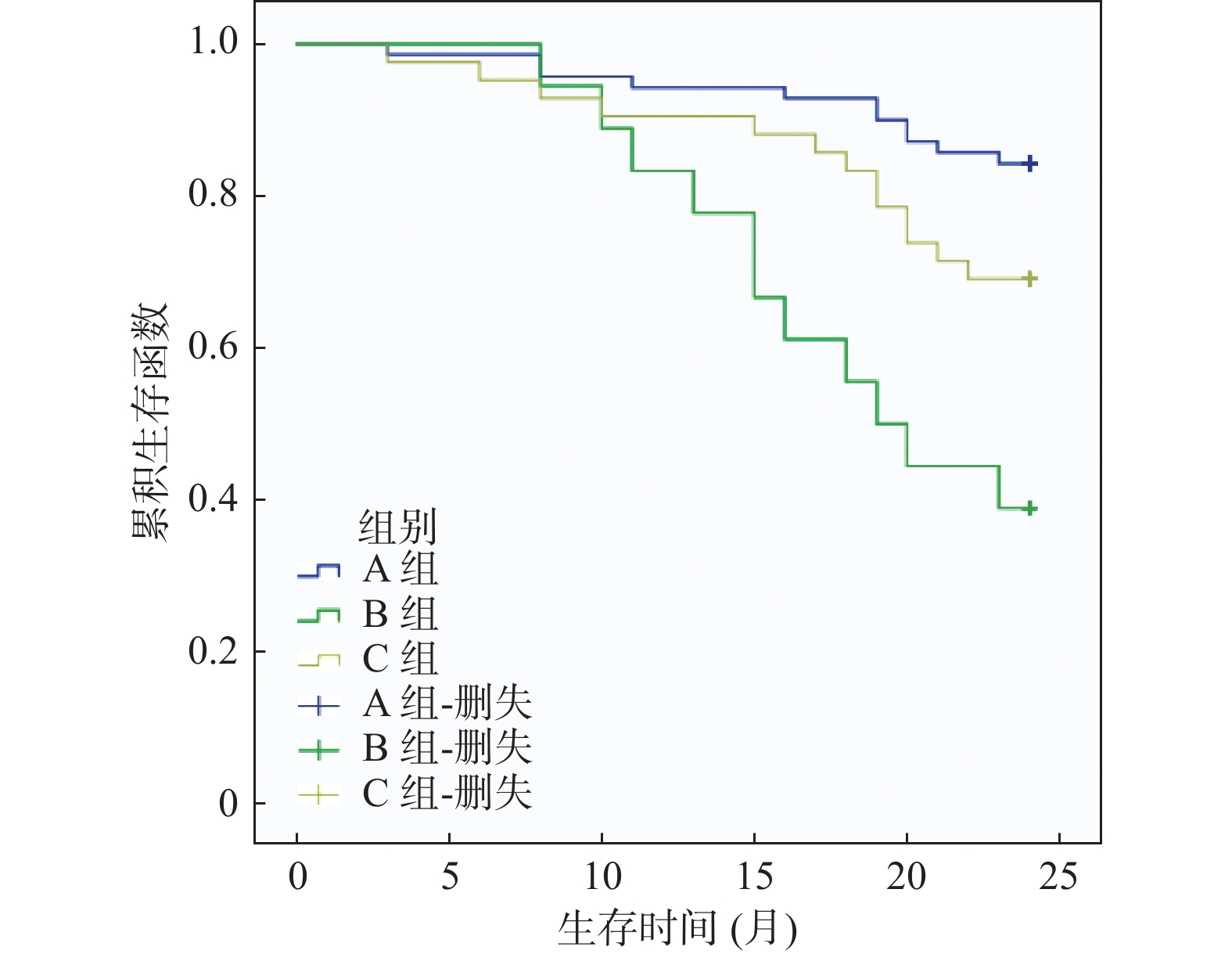
摘要:
目的 分析术前不同贫血类型(小细胞性贫血、正常细胞性贫血)与结直肠癌患者病理特征及预后的相关性。 方法 回顾性分析2018年3月至2021年2月于右江民族医学院附属医院接受根治手术的130例结直肠癌患者临床资料,根据红细胞形态学将患者分为A组(无贫血,70例)、B组(小细胞性贫血,18例)、C组(正常细胞性贫血,42例)。对比3组病理特征、术后2 a生存率,经Phi系数检验分析术前贫血类型与结直肠癌病理特征相关性,绘制Kaplan-Meier生存曲线对比3组生存率。 结果 3组性别、肿瘤部位、肿瘤直径、TNM分期分布相比,差异有统计学意义(P < 0.05);经Phi系数检验发现,术前贫血类型与性别、肿瘤部位、肿瘤直径、TNM分期相关(r = 0.238、0.255、0.266、0.331,P = 0.025、0.015、0.010、0.001);经多因素Logistic回归分析发现,肿瘤直径≥5 cm、TNM分期为Ⅲ~Ⅳ期、远处转移、淋巴结转移、术前小细胞性贫血、术前正常细胞性贫血是影响结直肠癌根治术后预后的危险因素(OR > 1,P < 0.05);术后2a总生存率A组 > C组 > B组(P < 0.05);经Log-rank检验,3组术后生存率相比,差异有统计学意义(P < 0.05)。 结论 术前贫血类型与结直肠癌患者肿瘤部位、肿瘤直径、TNM分期等病理特征及术后生存时间相关,其中术前小细胞性贫血患者的生存率最低。 Abstract:Objective To analyze the correlation between different types of anemia(small cell anemia and normal cell anemia) before operation and pathological features and prognosis of colorectal cancer patients. Methods The clinical data of 130 patients with colorectal cancer who underwent radical surgery in our hospital from March 2018 to February 2021 were retrospectively analyzed. According to the morphology of red blood cells, the patients were divided into group A(70 cases without anemia), group B(18 cases with small cell anemia) and group C(42 cases with normal cell anemia). Pathological features and postoperative 2 a survival rate of the 3 groups were compared. The correlation between preoperative anemia types and pathological features of colorectal cancer was analyzed by Phi coefficient test, and Kaplan-Meier survival curve was drawn to compare the survival rate of the 3 groups. Results There were significant differences in gender, tumor site, tumor diameter and TNM stage distribution among the three groups(P < 0.05). The Phi coefficient test showed that preoperative anemia type was correlated with gender, tumor site, tumor diameter, and TNM stage(r = 0.238, 0.255, 0.266, 0.331, P = 0.025, 0.015, 0.010, 0.001). Multivariate Logistic regression analysis showed that tumor diameter ≥5 cm, TNM stage Ⅲ-Ⅳ, distant metastasis, lymph node metastasis, preoperative small cell anemia, preoperative normal cell anemia were the risk factors for the prognosis of colorectal cancer after radical surgery(OR > 1, P < 0.05). The overall survival rate of 2a in group A was higher than that in group C > that in group B(P < 0.05). Log-rank test showed that the postoperative survival rate of the three groups was significantly different(P < 0.05). Conclusion Preoperative anemia types were correlated with tumor site, tumor diameter, TNM stage and postoperative survival time of colorectal cancer patients, among which preoperative small-cell anemia patients had the lowest survival rate. -
表 1 术前不同贫血类型的结直肠癌患者病理特征对比[n(%)]
Table 1. Comparison of pathological characteristics of colorectal cancer patients with different anemia types before surgery [n(%)]
病理特征 A组(n=70) B组(n=18) C组(n=42) χ2 P 性别 男(n=70) 45(64.29) 6(33.33) 19(45.24) 7.370 0.025* 女(n=60) 25(35.71) 12(66.67) 23(38.33) 年龄(岁) <60(n=48) 24(34.29) 7(38.89) 17(35.42) 0.467 0.792 ≥60(n=82) 46(65.71) 11(61.11) 25(59.52) 肿瘤部位 结肠(n=78) 34(48.57) 14(77.78) 30(71.43) 8.466 0.015* 直肠(n=52) 36(51.43) 4(22.22) 12(28.57) 肿瘤直径(cm) < 5(n=75) 32(45.71) 12(66.67) 31(73.81) 9.178 0.010* ≥5(n=55) 38(54.29) 6(33.33) 11(26.19) 有无脉管癌栓 有(n=30) 16(22.86) 4(22.22) 10(24.43) 0.022 0.989 无(n=100) 54(77.14) 14(77.78) 32(76.19) 有无神经侵犯 有(n=18) 10(14.29) 2(11.11) 6(14.29) 0.131 0.937 无(n=112) 60(85.71) 16(88.89) 36(85.71) 肿瘤分化程度 低分化(n=32) 17(24.29) 4(22.22) 11(26.19) 0.116 0.944 中高分化(n=98) 53(75.71) 14(77.78) 31(74.43) TNM分期 Ⅰ~Ⅱ期(n=60) 43(61.43) 5(27.78) 12(28.57) 42.387 < 0.001* Ⅲ~Ⅳ期(n=70) 27(38.57) 13(72.22) 30(71.43) 有无远处转移 有(n=28) 15(21.43) 3(16.67) 10(23.81) 0.381 0.826 无(n=102) 55(78.57) 15(83.33) 32(76.19) 有无淋巴结转移 有(n=34) 18(25.71) 4(22.22) 12(28.57) 0.278 0.870 无(n=96) 52(74.29) 14(77.78) 30(71.43) *P < 0.05。 表 2 术前贫血类型与结直肠癌病理特征的相关性分析
Table 2. Correlation analysis of preoperative anemia types and pathological characteristics of colorectal cancer
系数 性别 肿瘤部位 肿瘤直径 TNM分期 r 0.238 0.255 0.266 0.331 P 0.025* 0.015* 0.010* 0.001* *P < 0.05。 表 3 结直肠癌根治术后预后影响因素的单因素分析[n(%)]
Table 3. Univariate analysis of outcome factors after radical colorectal cancer [n (%)]
病理特征 生存组(n=95) 死亡组(n=35) χ2 P 性别 男(n=70) 53(55.79) 17(48.57) 0.536 0.464 女(n=60) 42(44.21) 18(51.43) 年龄(岁) <60(n=48) 38(40.00) 10(28.57) 1.434 0.231 ≥60(n=82) 57(60.00) 25(71.43) 肿瘤部位 结肠(n=78) 59(62.11) 19(54.29) 0.652 0.420 直肠(n=52) 36(37.89) 16(45.71) 肿瘤直径(cm) <5(n=75) 64(67.37) 11(31.43) 13.563 <0.001* ≥5(n=55) 31(32.63) 24(68.57) 有无脉管癌栓 有(n=30) 22(23.16) 8(22.86) 0.001 0.971 无(n=100) 73(76.84) 27(77.14) 有无神经侵犯 有(n=18) 14(14.74) 4(11.43) 0.039 0.843 无(n=112) 81(85.26) 31(88.57) 肿瘤分化程度 低分化(n=32) 26(27.37) 6(17.14) 1.441 0.230 中高分化(n=98) 69(72.63) 29(82.86) TNM分期 Ⅰ~Ⅱ期(n=60) 50(52.63) 10(28.57) 6.135 0.013* Ⅲ~Ⅳ期(n=70) 45(47.37) 25(71.43) 有无远处转移 有(n=28) 13(13.68) 15(42.86) 11.812 0.001* 无(n=102) 82(86.32) 20(57.14) 有无淋巴结转移 有(n=34) 15(15.79) 19(54.29) 16.278 <0.001* 无(n=96) 80(84.21) 16(45.71) 术前贫血类型 A(n=70) 59(62.11) 11(31.43) 14.532 0.001* B(n=18) 7(11.86) 11(31.43) C(n=42) 29(30.53) 13(37.14) A为无贫血,B为小细胞性贫血,C为正常细胞性贫血,*P < 0.05。 表 4 结直肠癌根治术后预后影响因素的多因素Logistic分析
Table 4. Multivariate Logistic-analysis of outcome factors after radical resection of colorectal cancer
影响因素 B SE Wald P OR 95%CI 肿瘤直径(≥5 cm) 1.505 0.425 12.552 0.000* 4.504 1.959~10.357 TNM分期(Ⅲ~Ⅳ期) 1.022 0.427 5.728 0.017* 2.778 1.203~6.413 远处转移 1.554 0.454 11.736 0.001* 4.731 1.944~11.510 淋巴结转移 1.846 0.441 17.535 0.000* 6.333 2.669~15.026 术前贫血类型(小细胞性贫血) 2.132 0.584 13.301 0.000* 8.429 2.681~26.501 术前贫血类型(正常细胞性贫血) 1.254 0.588 4.558 0.033* 3.505 1.108~11.088 *P < 0.05。 表 5 术前不同贫血类型的结直肠癌患者术后2 a生存率对比[n(%)]
Table 5. Comparison of 2-year survival of colorectal cancer patients with different anemia types n[n(%)]
组别 n 术后6个月 术后1 a 术后2 a A组 70 69(98.57) 67(95.71) 59(84.29) B组 18 18(100.00) 15(83.33) 7(38.89) C组 42 41(97.62) 39(92.86) 29(69.05) χ2 0.484 3.319 14.532 P 0.785 0.163 0.001* *P < 0.05。 -
[1] Huang H,Lin F,Cen L,et al. Cancer-related anemia is a risk factor for medium-term postoperative cognitive dysfunction in laparoscopic surgery patients: An observational prospective study[J]. Neural Plast,2020,2020:4847520. [2] Shi X Q,Zhu Z H,Yue S J,et al. Studies on blood enrichment and anti-tumor effects of combined Danggui Buxue Decoction,Fe and rhEPO based on colon cancer-related anemia model and gut microbiota modulation[J]. Chin J Nat Med,2021,19(6):422-431. [3] 宋正波,罗素霞,张沂平,等. 中国肿瘤相关性贫血发生率及治疗现状的流行病学调查研究[J]. 中国肿瘤,2019,28(9):718-722. [4] 张文明,陆春雷,李科军,等. 胃癌患者术前贫血与术后并发症及预后的相关性[J]. 现代肿瘤医学,2021,29(7):1183-1187. [5] Egenvall M,Morner M,Martling A,et al. Prediction of outcome after curative surgery for colorectal cancer: Preoperativehaemoglobin,C-reactive protein and albumin[J]. Coloreetal Disease,2018,20(1):26-34. doi: 10.1111/codi.13807 [6] Gergal Gopalkrishna Rao S R,Bugazia S,Dhandapani T P M,et al. Efficacy and cardiovascular adverse effects of erythropoiesis stimulating agents in the treatment of cancer-related anemia: A systematic review of randomized controlled trials[J]. Cureus,2021,13(9):e17835. [7] 中华医学会肿瘤学分会早诊早治学组. 中国结直肠癌早诊早治专家共识[J]. 中华医学杂志,2020,100(22):1691-1698. doi: 10.3760/cma.j.cn112137-20190924-02103 [8] 葛均波, 徐永健. 内科学[M]. 8版. 北京: 人民卫生出版社, 2014: 543. [9] 张之南, 沈悌. 血液病诊断及疗效标准[M]. 3版. 北京: 科学出版社, 2007: 116-121. [10] Moncur A,Chowdhary M,Chu Y,et al. Impact and outcomes of postoperative anaemia in colorectal cancer patients: A systematic review[J]. Colorectal Dis,2021,23(4):776-786. doi: 10.1111/codi.15461 [11] McSorley S T,Tham A,Steele C W,et al. Quantitative data on red cell measures of iron status and their relation to the magnitude of the systemic inflammatory response and survival in patients with colorectal cancer[J]. Eur J Surg Oncol,2019,45(7):1205-1211. doi: 10.1016/j.ejso.2019.02.027 [12] 程玉,谭诗云,李明,等. 胃癌,结直肠癌患者以慢性贫血为首发表现的危险因素分析[J]. 临床消化病杂志,2020,32(2):78-83. [13] Wilson M J,van Haaren M,Harlaar J J,et al. Long-term prognostic value of preoperative anemia in patients with colorectal cancer: A systematic review and meta-analysis[J]. Surg Oncol,2017,26(1):96-104. doi: 10.1016/j.suronc.2017.01.005 [14] McGrane J M,Humes D J,Acheson A G,et al. Significance of anemia in outcomes after neoadjuvant chemoradiotherapy for locally advanced rectal cancer[J]. Clin Colo Cancer,2017,16(4):381-385. [15] Tamini N,Gianotti L,Darwish S,et al. Do preoperative transfusions impact prognosis in moderate to severe anaemic surgical patients with colon cancer?[J]. Curr Oncol,2021,28(6):4634-4644. doi: 10.3390/curroncol28060391 [16] Deng Y,Weng M,Zhang J. Preoperative anemia and long-term survival in patients undergoing colorectal cancer surgery: A retrospective cohort study[J]. World J Surg Oncol,2023,21(1):122. doi: 10.1186/s12957-023-03005-w [17] McSorley S T,Johnstone M,Steele C W,et al. Normocytic anaemia is associated with systemic inflammation and poorer survival in patients with colorectal cancer treated with curative intent[J]. Int J Colorectal Dis,2019,34(3):401-408. doi: 10.1007/s00384-018-3211-7 [18] Buchrits S,Itzhaki O,Avni T,et al. Intravenous iron supplementation for the treatment of chemotherapy-induced anemia: A systematic review and meta-analysis of randomized controlled trials[J]. J Clin Med,2022,11(14):4156. doi: 10.3390/jcm11144156 [19] Jocić M,Arsenijević N,Gajović N,et al. Anemia of inflammation in patients with colorectal cancer: Correlation with interleukin-1,interleukin-33 and galectin-1[J]. J Med Biochem,2022,41(1):79-90. doi: 10.5937/jomb0-30135 [20] Tokunaga R,Nakagawa S,Miyamoto Y,et al. The impact of preoperative anaemia and anaemic subtype on patient outcome in colorectal cancer[J]. Colorectal Dis,2019,21(1):100-109. doi: 10.1111/codi.14425 [21] Adams A,Scheckel B,Habsaoui A,et al. Intravenous iron versus oral iron versus no iron with or without erythropoiesis- stimulating agents (ESA) for cancer patients with anaemia: A systematic review and network meta-analysis[J]. Cochrane Database Syst Rev,2022,6(6):CD012633. [22] 梁立莉,赵迎喜,黄丹,等. 红细胞寿命在肿瘤相关性贫血诊断中的特点及临床应用[J]. 重庆医学,2022,51(2):264-266. -






 下载:
下载: