Effects of Ferroptosis Inhibitor KIF20A on Biological Behavior and Ferroptosis of Esophageal Carcinoma Cells
-
摘要:
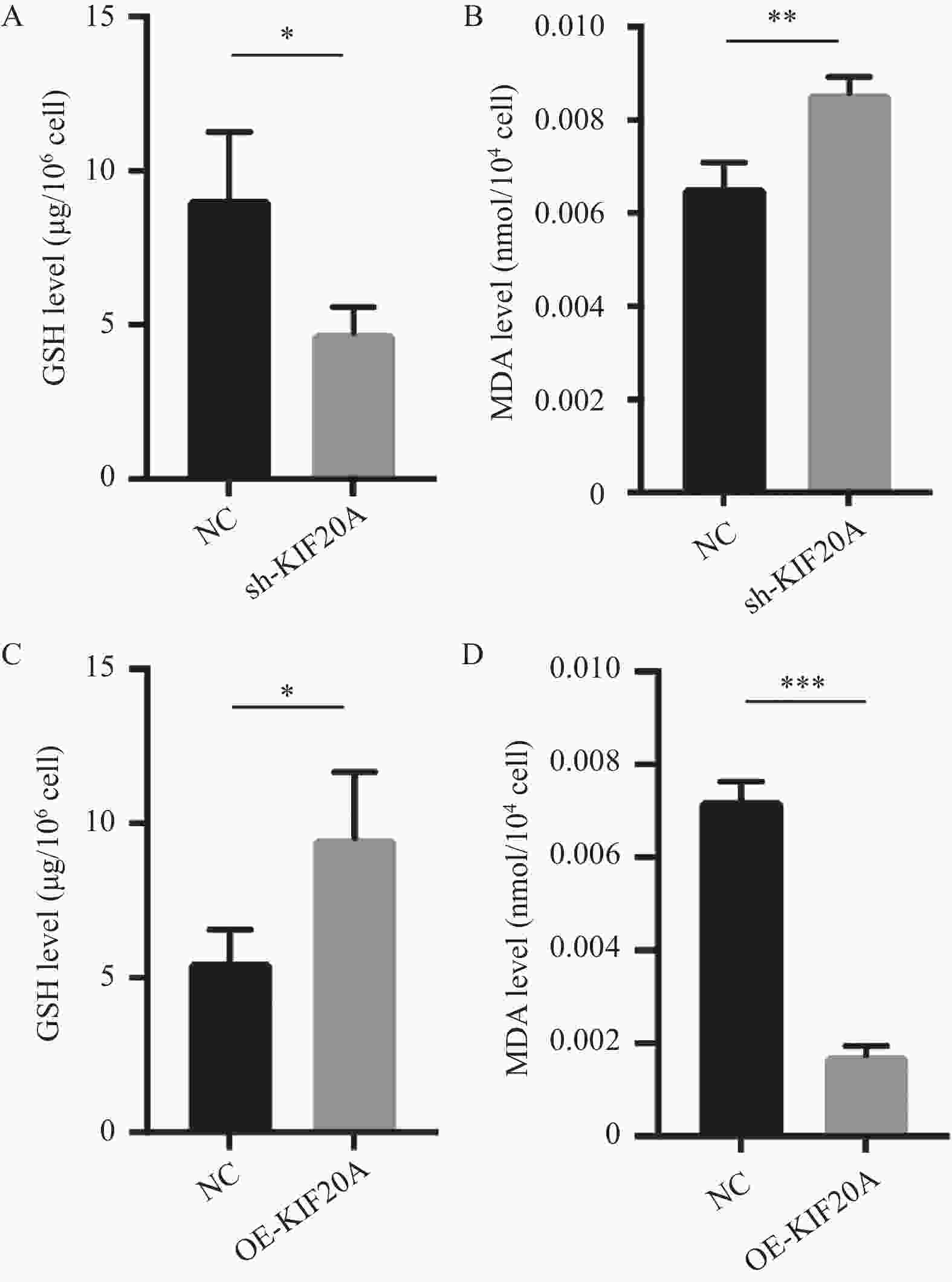
目的 探讨驱动蛋白家族成员20A(KIF20A)在食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)中的表达及对Eca109细胞生物学行为和铁死亡的影响。 方法 通过生物信息学分析预测KIF20A在ESCC中的表达。构建KIF20A敲低/过表达Eca109细胞系,实验分组:对照组,KIF20A敲低组,KIF20A过表达组。通过CCK-8法,Transwell侵袭实验,细胞划痕实验检测KIF20A对Eca109细胞增殖,迁移能力的影响。采用RAS选择性致死化合物3(RSL3)诱导建立铁死亡应激模型,检测谷胱甘肽(glutathione,GSH),丙二醛(malondialdehyde,MDA)含量。 结果 和对照组比较,KIF20A敲低组细胞增殖活力降低(P < 0.05),KIF20A过表达组细胞增殖活力增加(P < 0.05)。与对照组比较,KIF20A敲低组细胞侵袭及迁移能力降低(P < 0.05),KIF20过表达组细胞侵袭及迁移能力增加(P < 0.05)。RSL3诱导处理后,KIF20A敲低组细胞裂解液中GSH含量低于对照组(P < 0.05),MDA含量高于对照组(P < 0.05);KIF20A过表达组细胞结果与之相反。 结论 KIF20A在ESCC中高表达,其在Eca109细胞中发挥着促进增殖、侵袭、迁移及抑制铁死亡的作用。 -
关键词:
- 铁死亡 /
- 驱动蛋白家族成员20A /
- 食管鳞状细胞癌 /
- RAS选择性致死化合物3
Abstract:Objective To investigate the expression of KIF20A in ESCC and its effect on Eca109 cell biological behavior and ferroptosis. Methods The expression of KIF20A in ESCC was predicted by bioinformatics analysis. KIF20A knockdown /overexpression Eca109 cell line was constructed, Experimental groups: control group, KIF20A knockdown group, KIF20A overexpression group, and the effects of KIF20A on the proliferation, invasion, and migration of Eca109 cells were detected by CCK-8, Transwell invasion assay and cell scratch assay. On this basis, the ferroptosis model induced by RSL3 was established, and GSH and MDA contents were detected. Results Compared with the control group, the cell proliferation activity of the KIF20A knockdown group was significantly decreased (P < 0.05), and that of the KIF20A overexpression group was significantly increased (P < 0.05). Compared with the control group, the invasion and migration ability of the KIF20A knockdown group was decreased (P < 0.05), and the invasion and migration ability of the KIF20A overexpression group was increased (P < 0.05). After RSL3 induction, the GSH content in the cell lysate of the KIF20A knockdown group was lower than that of the control group (P < 0.05), and the MDA content was higher than that of the control group (P < 0.05). Conclusion KIF20A is highly expressed in ESCC and plays a role in promoting proliferation, invasion, migration and inhibiting ferroptosis in Eca109 cells. -
Key words:
- Ferroptosis /
- KIF20A /
- ESCC /
- RSL3
-
图 3 CCK-8法检测KIF20A敲低/过表达组细胞增殖能力[($\bar x \pm s$),n=3]
A:KIF20A敲低/对照组细胞生长曲线;B:KIF20A敲低/对照组细胞增殖能力统计分析柱状图;C:KIF20A过表达/对照组细胞生长曲线;D:KIF20A过表达/对照组细胞增殖能力统计分析柱状图;*P < 0.05,**P < 0.01,***P < 0.001。
Figure 3. The proliferation ability of KIF20A knockdown/overexpression group was detected by CCK-8 assay [($\bar x \pm s$),n=3]
图 4 Transwell侵袭实验检测KIF20A敲低/过表达组细胞侵袭能力[($\bar x \pm s$),n=3]
A:KIF20A敲低/对照组侵袭细胞染色图;B:KIF20A敲低/对照组细胞侵袭能力统计分析柱状图;C:KIF20A过表达/对照组侵袭细胞染色图;D:KIF20A过表达/对照组细胞侵袭能力统计分析柱状图;*P < 0.05,**P < 0.01,***P < 0.001。
Figure 4. The invasion ability of KIF20A knockdown/overexpression group was detected by Transwell invasion assay [($\bar x \pm s$),n=3]
图 5 细胞划痕实验检测KIF20A敲低/过表达组细胞迁移能力[($\bar x \pm s$),n=3]
A:KIF20A敲低/对照组细胞迁移面积;B:KIF20A敲低/对照组细胞迁移率统计分析柱状图C:KIF20A过表达/对照组细胞迁移面积;D:KIF20A过表达/对照组细胞迁移率统计分析柱状图;*P < 0.05,**P < 0.01,***P < 0.001。
Figure 5. Cell migration ability of KIF20A knockdown/overexpression group was detected by cell scratch assay[($\bar x \pm s$),n=3]
-
[1] 刘宇英,魏君丽,江柔,等. 食管癌的流行病学及筛查研究进展[J]. 中华疾病控制杂,2022,26(7):839-844. [2] Arnold M,Soerjomataram I,Ferlay J,et al. Global incidence of oesophageal cancer by histological subtype in 2012[J]. Gut,2015,64(3):381-387. doi: 10.1136/gutjnl-2014-308124 [3] 李化龙. 食管癌的治疗进展[J]. 四川生理科学杂志,2020,42(4):522-526. [4] Dixon S J,Lemberg K M,Lamprecht M R,et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell,2012,149(5):1060-1072. doi: 10.1016/j.cell.2012.03.042 [5] Jamar N H,Kritsiligkou P,Grant C M. The non-stop decay mRNA surveillance pathway is required for oxidative stress tolerance[J]. Nucleic Acids Res,2017,45(11):6881-6893. doi: 10.1093/nar/gkx306 [6] Yang C,Zhang Y,Lin S,et al. Suppressing the KIF20A/NUAK1/Nrf2/GPX4 signaling pathway induces ferroptosis and enhances the sensitivity of colorectal cancer to oxaliplatin[J]. Aging (Albany NY),2021,13(10):13515-13534. doi: 10.18632/aging.202774 [7] Jin Z,Peng F,Zhang C,et al. Expression,regulating mechanism and therapeutic target of KIF20A in multiple cancer[J]. Heliyon,2023,9(2):e13195. doi: 10.1016/j.heliyon.2023.e13195 [8] Chandrashekar D S,Karthikeyan S K,Korla P K,et al. UALCAN: An update to the integrated cancer data analysis platform[J]. Neoplasia,2022,25:18-27. doi: 10.1016/j.neo.2022.01.001 [9] Chen X,Kang R,Kroemer G,et al. Ferroptosis in infection,inflammation,and immunity[J]. J Exp Med,2021,218(6):e20210518. doi: 10.1084/jem.20210518 [10] Sehitogulları A,Aslan M,Sayır F,et al. Serum paraoxonase-1 enzyme activities and oxidative stress levels in patients with esophageal squamous cell carcinoma[J]. Redox Rep,2014,19(5):199-205. doi: 10.1179/1351000214Y.0000000091 [11] Jiang B,Zhao Y,Shi M,et al. DNAJB6 promotes ferroptosis in esophageal squamous cell carcinoma[J]. Dig Dis Sci,2020,65(7):1999-2008. doi: 10.1007/s10620-019-05929-4 [12] 张雪莲,杨如意,王宏斌,等. 铁死亡通路激活在雄黄抑制食管癌增殖和转移中的作用[J]. 药学学报,2022,57(11):3322-3330. [13] Zhang J,Wang N,Zhou Y,et al. Oridonin induces ferroptosis by inhibiting gamma-glutamyl cycle in TE1 cells[J]. Phytother Res,2021,35(1):494-503. doi: 10.1002/ptr.6829 [14] Shishido Y,Amisaki M,Matsumi Y,et al. Antitumor effect of 5-aminolevulinic acid through ferroptosis in esophageal squamous cell carcinoma[J]. Ann Surg Oncol,2021,28(7):3996-4006. doi: 10.1245/s10434-020-09334-4 [15] Li Y,Guo H,Wang Z,et al. Cyclin F and KIF20A,FOXM1 target genes,increase proliferation and invasion of ovarian cancer cells[J]. Exp Cell Res,2020,395(2):112212. doi: 10.1016/j.yexcr.2020.112212 [16] Wu C,Qi X,Qiu Z,et al. Low expression of KIF20A suppresses cell proliferation,promotes chemosensitivity and is associated with better prognosis in HCC[J]. Aging (Albany NY),2021,13(18):22148-22163. doi: 10.18632/aging.203494 -





 下载:
下载: