Value of SHOX2 and RASSF1A Gene Methylation in Alveolar Lavage Fluid in Patients with Pulmonary Nodules or Masses in the Diagnosis of Lung Cancer
-
摘要:
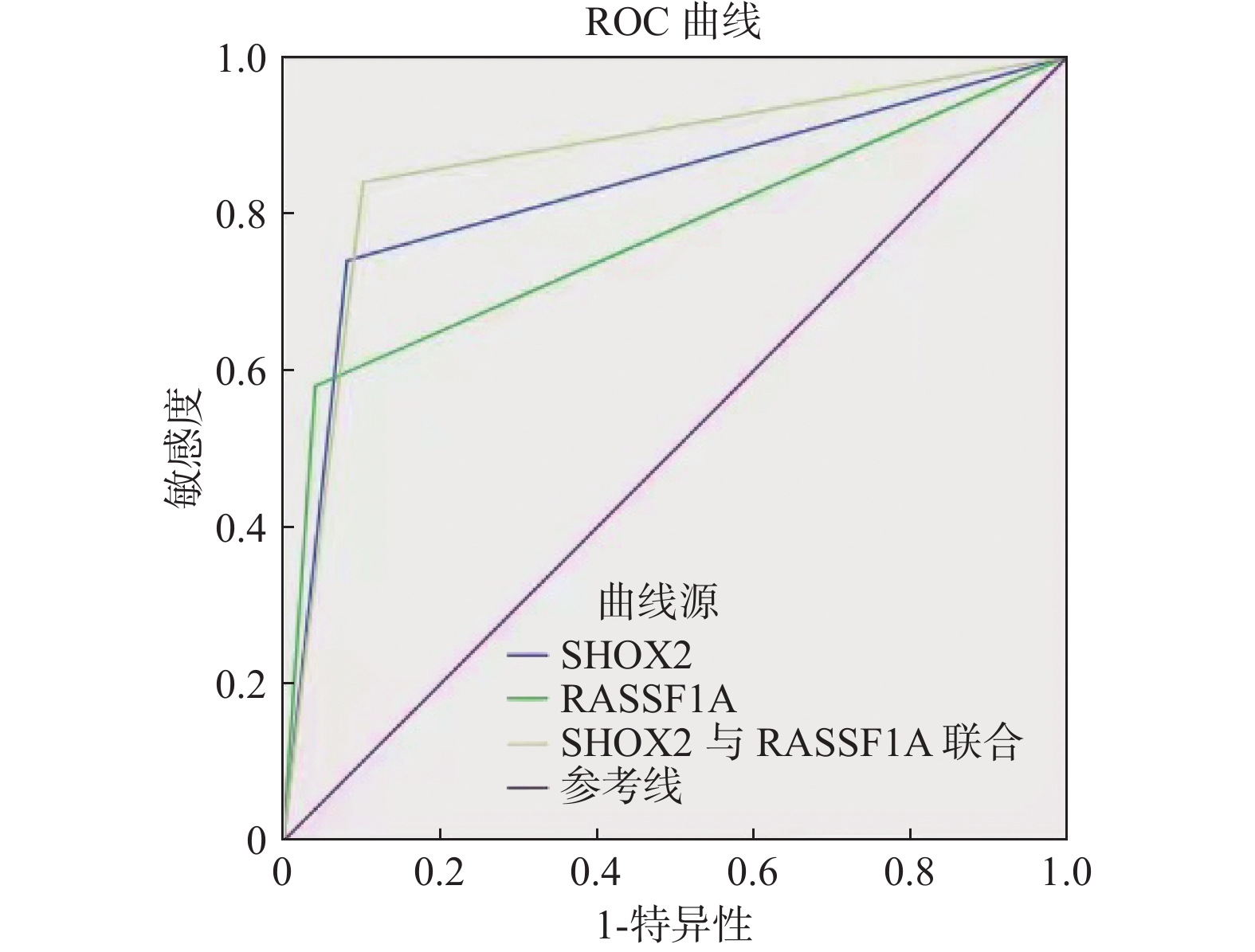
目的 通过肺组织活检或手术后病检结果来验证两基因甲基化指标检验肺部良、恶性结节诊断效能。 方法 进行前瞻性研究,收集2019年3月至2020年3月在云南省第三人民医院99例诊断为肺部结节、肿块的患者,行支气管镜检查收集支气管肺泡灌洗液(BALF)样本后,进行定期随访、肺穿刺活检、手术后病检。 结果 收集的99例肺部结节、肿块患者,经病理诊断后分为肺癌组(n = 50)和良性肺疾病组(n = 49)。肺癌组年龄(62.64±9.71)岁,良性肺疾病组年龄(60.48±13.69)岁,2组指标差异具有统计学意义(P = 0.032);在肺癌的诊断过程中,发现SHOX2和RASSF1A基因任一阳性诊断肺癌的灵敏度分别为72%和58%,特异度分别为92.3%和95.9%。而这2个基因的联合检测在肺癌的诊断中表现出了更高的灵敏度,为0.84,远高于良性疾病组的0.102 (P < 0.001)。ROC曲线分析显示2个基因甲基化联合时灵敏度可提高至84%。 结论 肺泡灌洗液SHOX2和RASS1A基因甲基化检验对存在肺部结节或肿块影像表现的肺癌患者诊断具有良好的预测价值,在影像学和组织学诊断不明时,SHOX2和RASSF1A联合检验可以作为肺癌早期诊断的一个重要补充工具。 Abstract:Objective The diagnostic efficacy of the two gene methylation indexes was verified by lung biopsy or postoperative disease examination results. Methods A prospective study was conducted to collect 99 patients diagnosed with pulmonary nodules and masses in the Third People's Hospital of Yunnan Province from March 2019 to March 2020. After bronchoscopy and BALF samples were collected, regular follow-up, lung puncture biopsy and post-operative disease examination were performed. Results Ninety-nine patients with pulmonary nodules and masses were divided into lung cancer group(n = 50) and benign lung disease group(n = 49) after pathological diagnosis. The age of patients in the lung cancer group was(62.64±9.71) years, and that of the benign lung disease group was(60.48±13.69) years, and there was a statistical difference between the two groups(P = 0.032). In the diagnosis of lung cancer, the sensitivity and specificity of SHOX2 and RASSF1A genes alone were found to be 72% and 58%, respectively, and 92.3% and 95.9%, respectively. The combined test of the two genes showed a higher sensitivity in the diagnosis of lung cancer, 0.84, compared to 0.102 in the benign disease group(P < 0.001). ROC curve analysis showed that the sensitivity of the two genes could be increased to 84% when methylation was combined. Conclusion The methylation test of SHOX2 and RASS1A gene in alveolar lavage fluid has a good value in the diagnosis of lung cancer patients with pulmonary nodules and masses and SHOX2 combined with RASSF1A can be an important supplementary tool for early diagnosis of lung cancer when imaging and histological diagnosis are unclear. -
Key words:
- DNA methylation /
- SHOX2 /
- RASSF1A /
- Alveolar lavage fluid
-
表 1 临床病例特征[(n)%/($\bar x \pm s $)]
Table 1. Clinical case characteristics[(n)%/($\bar x \pm s $)]
组别 总数(n=99) 肺癌组(n=50) 良性疾病组(n=49) χ2/t P 性别 男 56(57.00) 32(64.00) 24(49.00) 2.273 0.132 女 43(43.00) 18(36.00) 25(51.00) 年龄(岁) 61.79 ± 11.16 62.64 ± 9.71 60.48 ± 13.69 3.554 0.032* 吸烟 是 59(59.60) 39(78.00) 20(40.82) 14.210 < 0.001* 否 40(40.40) 11(22.00) 29(49.18) 结节大小(cm) 最大直径 3.714 ± 2.67 4.01 ± 2.33 3.14 ± 3.09 1.332 0.177 最小直径 2.90 ± 2.16 2.97 ± 1.65 2.26 ± 2.06 1.878 0.065 *P < 0.05。 表 2 2组SHOX2和RASSF1A基因组甲基化PCR检测结果 [n(%)]
Table 2. PCR results of SHOX2 and RASSF1A genome methylation in two groups [n(%)]
组别 n SHOX2 RASSF1A SHOX2、RASSF1A双阳性 SHOX2、RASSF1A任意阳性 肺癌组 50 37(74.00) 29(58.00) 24(48.00) 42(84.00) 良性疾病组 49 4(8.16) 2(4.08) 1(2.04) 5(10.20) χ2 44.211 33.451 27.693 54.046 P < 0.001* < 0.001* < 0.001* < 0.001* *P < 0.05。 表 3 不同类型肺癌患者基因甲基化检测 [n(%)]
Table 3. Gene methylation in patients with different types of lung cancer [n(%)]
项目 n SHOX2 RASSF1A 二者均
阳性任一
阳性肺腺癌 23 19(82.60) 16(69.57) 13(56.52) 21(91.30) 肺鳞癌 14 10(71.43) 7(50.00) 5(35.71) 12(85.71) 大细胞癌 1 1(100.00) 1(100.00) 1(100.00) 1(100.00) 小细胞癌 1 1(100.00) 1(100.00) 1(100.00) 1(100.00) 腺鳞癌 2 1(50.00) 1(50.00) 1(50.00) 1(50.00) 其它类型癌 9 5(55.56) 3(33.33) 3(33.33) 6(66.67) 表 4 多因素Logistics回归分析
Table 4. Multi-factor Logistics regression analysis
因素 B S.E Wald P OR 95% CI SHOX2 2.906 0.054 6.922 0.009* 12.675 2.146~20.451 RASSF1A 2.293 0.120 6.014 0.014* 3.644 1.245~8.245 吸烟 1.055 0.245 3.155 0.035* 1.354 1.1245~3.564 年龄 0.019 0.578 0.525 0.469 1.019 0.969~1.072 *P < 0.05。 表 5 单一指标和双指标联合检测结果
Table 5. Combined detection results of single index and double index
指标 AUC 95%CI 灵敏度 特异度 约登指数 SHOX2 0.829 0.743~0.915 0.723 0.923 0.658 RASSF1A 0.770 0.674~0.886 0.580 0.959 0.539 SHOX2+
RASSF1A0.869 0.792~0.946 0.84 0.898 0.738 -
[1] 赵俊松,崔利,何江波,等. 上海22351例无症状体检者低剂量CT肺癌筛查及随访结果初步分析[J]. 诊断学理论与实践,2019,18(2):183-188. [2] Dor Y,Cedar H. Principles of DNA methylation and their implications for biology and medicine[J]. Lancet,2018,392(10149):777-786. doi: 10.1016/S0140-6736(18)31268-6 [3] 刘莹,王圆圆,贾文青,等. 肺癌患者血清p16、FHIT、APC基因甲基化检测[J]. 郑州大学学报(医学版),2017,52(1):51-54. [4] 林列坤,卢春生,郑义,等. 支气管肺泡灌洗液SHOX2和RASSF1A基因甲基化检测在临床肺癌诊断中的应用[J]. 中国实用医药,2019,14(18):1-3. [5] 周清华,范亚光,王颖,等. 中国肺部结节分类、诊断与治疗指南(2016年版)[J]. 中国肺癌杂志,2016,19(12):793. [6] Du Rand I A,Blaikley J,Booton R,et al. Summary of the British Thoracic Society guideline for diagnostic flexible bronchoscopy in adults[J]. Thorax,2013,68(8):786-787. doi: 10.1136/thoraxjnl-2013-203629 [7] Walter J E,Heuvelmans M A,De Jong P A,et al. Occurrence and lung cancer probability of new solid nodules at incidence screening with low-dose CT: Analysis of data from the randomised,controlled NELSON trial[J]. Lancet Oncol,2016,17(7):907-916. doi: 10.1016/S1470-2045(16)30069-9 [8] Miller K D,Goding Sauer A,Ortiz A P,et al. Cancer statistics for hispanics/latinos,2018[J]. CA Cancer J Clin,2018,68(6):425-445. doi: 10.3322/caac.21494 [9] 赫捷, 赵平, 陈万青. 2012中国肿瘤登记年报[M]. 北京: 军事医学科学出版社, 2012: 1-3. [10] Aberle D R,Adams A M,Berg C D,et al. Reduced lung-cancer mortality with low-dose computed tomographic screening[J]. N Engl J Med,2011,365(5):395-409. doi: 10.1056/NEJMoa1102873 [11] 中华医学会放射学分会心胸学组. 低剂量螺旋CT肺癌筛查专家共识[J]. 中华放射学杂志,2015,49(5):328-335. [12] 邱小明,乔艳洁,刘斌,等. DNA甲基化在肺癌早期诊断中的研究进展[J]. 中国肺癌杂志,2012,15(4):234-241. doi: 10.3779/j.issn.1009-3419.2012.04.08 [13] Zeng H,Zheng R,Guo Y,et al. Cancer survival in China,2003-2005: A population-based study[J]. Int J Cancer,2015,136(8):1921-1930. doi: 10.1002/ijc.29227 [14] Koch A,Joosten S C,Feng Z,et al. Analysis of DNA methylation in cancer: Location revisited[J]. Nat Rev Clin Oncol,2018,15(7):459-466. doi: 10.1038/s41571-018-0004-4 [15] Shi J,Chen X,Zhang L,et al. Performance evaluation of SHOX2 and RASSF1A methylation for the aid in diagnosis of lung cancer based on the analysis of FFPE specimen[J]. Front Oncol,2020,10:565780. doi: 10.3389/fonc.2020.565780 [16] Song L,Yu H,Li Y. Diagnosis of lung cancer by SHOX2 gene methylation assay[J]. Mol Diagn Ther,2015,19(3):159-167. doi: 10.1007/s40291-015-0144-5 [17] Schmidt B,Liebenaerg V,Dietrich D,et al. SHOX2 DNA methylation is a biomarker for the diagnosis of lung cancer based on bronchial aspirates[J]. BMC Cancer,2010,10:600. doi: 10.1186/1471-2407-10-600 [18] Tomizawa Y,Iijima H,Nomoto T,et al. Clinicopathological significance of aberrant methylation of RARbeta2 at 3p24,RASSF1A at 3p21.3,and FHIT at 3p14.2 in patients with non-small cell lung cancer[J]. Lung Cancer,2004,46(3):305-312. doi: 10.1016/j.lungcan.2004.05.003 -






 下载:
下载: