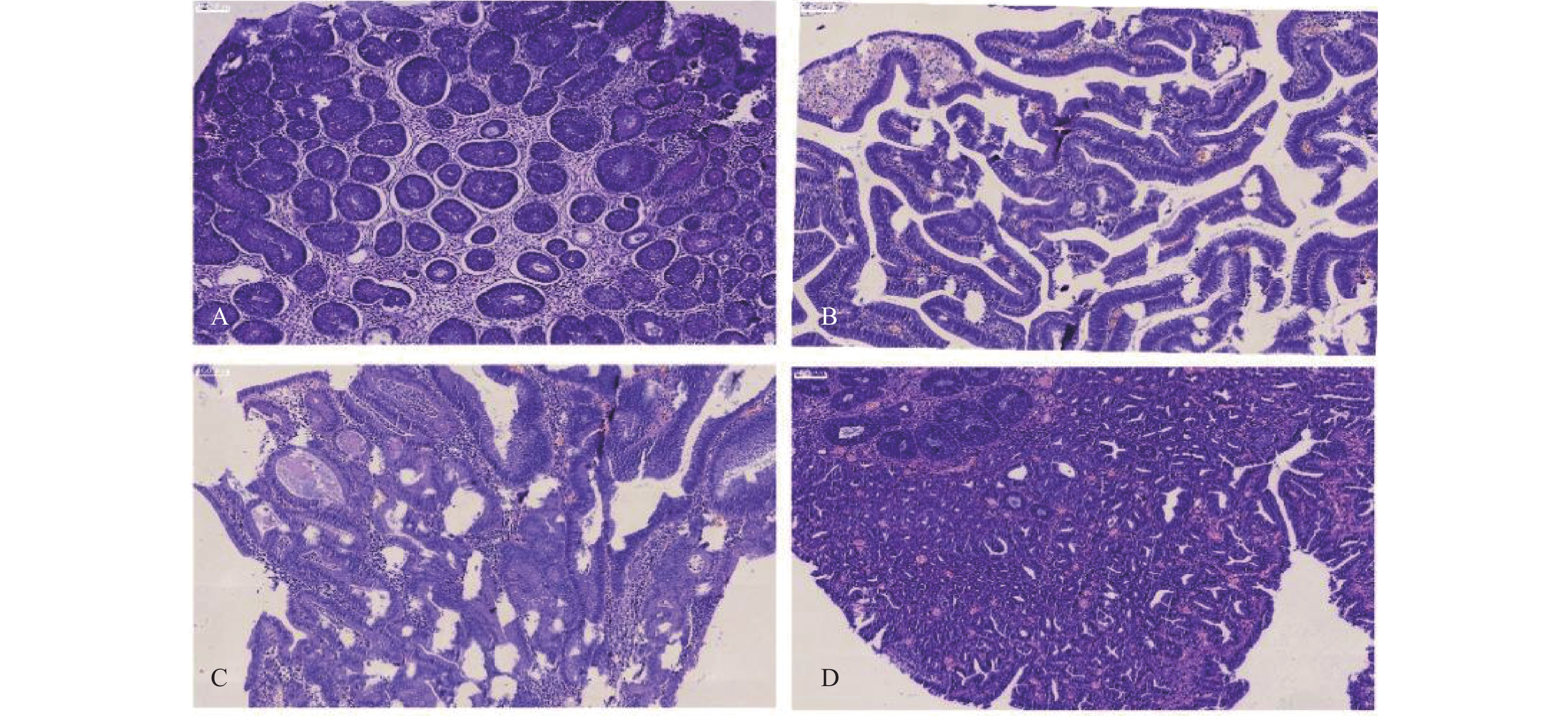
|
[1]
|
Wild C P, Weiderpass E, Stewart B W. World cancer report: Cancer research for cancer prevention [EB/OL]. (2020-06-20). https://publications.iarc.fr/586
|
|
[2]
|
E S Lander. Comprehensive molecular characterization of human colon and rectal cancer[J]. Nature,2012,487(7407):330-337. doi: 10.1038/nature11252
|
|
[3]
|
黄丹 朱雄增 盛伟琪. 2019版《WHO消化系统肿瘤分类》胃肠上皮性肿瘤部分解读[J]. 2020, 49(3): 209-213.
|
|
[4]
|
Sun J,Zheng M Y,Li Y W,et al. Structure and function of Septin 9 and its role in human malignant tumors[J]. World J Gastrointest Oncol,2020,12(6):619-631. doi: 10.4251/wjgo.v12.i6.619
|
|
[5]
|
Kang Q,Jin P,Yang L,et al. Significance of Septin9 gene methylation detection of plasma circulation DNA in colorectal cancer screening[J]. Zhonghua Yi Xue Za Zhi,2014,94(48):3839-3841.
|
|
[6]
|
Loomans-kropp H A,Song Y,Gala M,et al. Methylated septin9 (mSEPT9): A promising blood-based biomarker for the detection and screening of early-onset colorectal cancer[J]. Cancer Res Commun,2022,2(2):90-98. doi: 10.1158/2767-9764.CRC-21-0142
|
|
[7]
|
Lu D C,Zhang Q F,Li L,et al. Methylated Septin9 has moderate diagnostic value in colorectal cancer detection in Chinese population: A multicenter study[J]. BMC Gastroenterol,2022,22(1):232. doi: 10.1186/s12876-022-02313-x
|
|
[8]
|
Warren J D, XiongW, Bunker A M, et al. Septin 9 methylated DNA is a sensitive and specific blood test for colorectal cancer [J]. BMC Med, 2011, 14: 9: 133.
|
|
[9]
|
Church T R,Wandell M,Lofton-day C,et al. Prospective evaluation of methylated SEPT9 in plasma for detection of asymptomatic colorectal cancer[J]. Gut,2014,63(2):317-325. doi: 10.1136/gutjnl-2012-304149
|
|
[10]
|
吴东,杨红. 外周血甲基化Septin9基因联合粪便免疫化学试验对专科门诊患者结直肠癌和腺瘤的筛查[J]. 中华消化杂志,2016,36(2):107-112. doi: 10.3760/cma.j.issn.0254-1432.2016.02.007
|
|
[11]
|
Ma Z Y,Chan C S Y,Lau K S,et al. Application of droplet digital polymerase chain reaction of plasma methylated septin 9 on detection and early monitoring of colorectal cancer[J]. Sci Rep,2021,11(1):23446. doi: 10.1038/s41598-021-02879-8
|
|
[12]
|
Zhang L,Yang X Y,Zhang T L,et al. Noninvasive detection of esophageal cancer by the combination of mSEPT9 and SNCG[J]. Genet Test Mol Biomarkers,2022,26(1):8-16. doi: 10.1089/gtmb.2021.0089
|
|
[13]
|
Liang Q,Huang Z,Xu Q,et al. A newly developed Septin9 gene methylation assay dectecting double DNA strands for screening of colorectal cancer[J]. Cancer Res,2018,78(13):3329.
|
|
[14]
|
Xu F,Yu S S,Han J Y,et al. Detection of circulating tumor DNA methylation in diagnosis of colorectal cancer[J]. Clin Transl Gastroenterol,2021,12(8):e00386. doi: 10.14309/ctg.0000000000000386
|
|
[15]
|
Mo S B,Wang H,Han L Y,et al. Fecal multidimensional assay for non-invasive detection of colorectal cancer: Fecal immunochemical test,stool DNA mutation,methylation,and intestinal bacteria analysis[J]. Front Oncol,2021,36(2):643136. doi: 10.3389/fonc.2021.643136
|






 下载:
下载: