Expressions of ROR1 in Lung Adenocarcinoma and Its Relationship with Spread Through Air Apace
-
摘要:
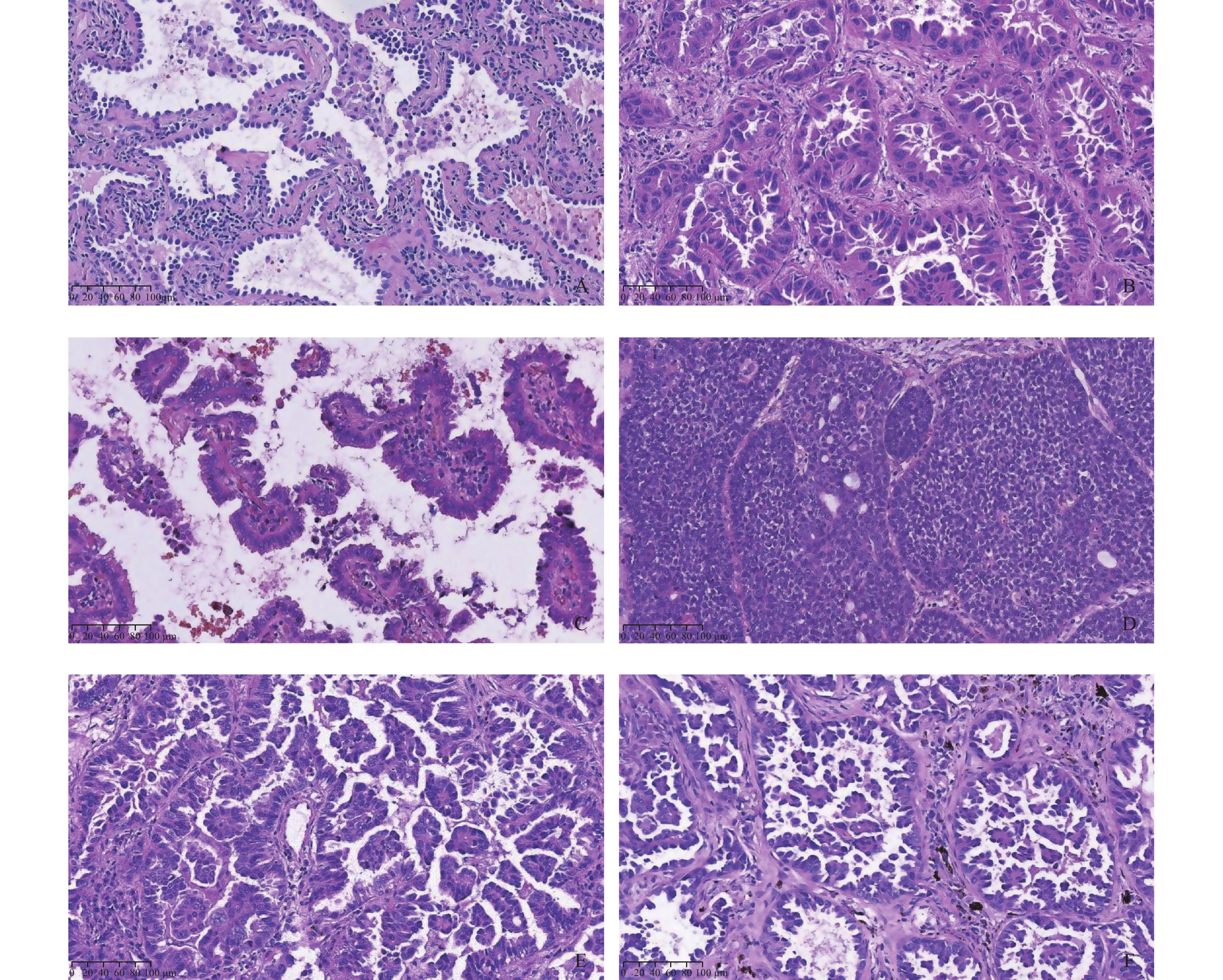
目的 研究受体酪氨酸激酶样孤儿受体1(receptor tyrosine kinase-like orphan rectetpor 1,ROR1)在不同病理亚型肺腺癌组织中的表达与气腔播散(spread through air space,STAS)发生的关系。 方法 收集昆明医科大学第一附属医院病理科2017年6月至2022年1月,肺腺癌组织蜡块标本618例,采用HE染色切片判断病理亚型与病理特征,记数STAS数量并分级,免疫组化染色,半定量判读ROR1表达水平,统计分析ROR1表达与STAS数量及与病理亚型的关系。 结果 ROR1在微乳头型与实体型肺腺癌(低分化)中的表达高于其它亚型肺腺癌,差异有统计学意义(P < 0.001);ROR1在低STAS、高STAS组中表达率分别为88.0%、94.1%,高于无STAS组且差异有统计学意义(P < 0.001)。 结论 ROR1高表达于低分化肺腺癌并提示更高的STAS发生率。ROR1有望成为新的肺腺癌诊断生物标志物用于指导临床治疗及辅助预后判断,并可能成为STAS阳性肺腺癌的潜在治疗靶点。 Abstract:Objective To study the relationship between the expression of receptor tyrosine kinase-like orphan receptor 1 (ROR1) and spread through air space (STAS) in lung adenocarcinoma tissues. Methods We collected 618 cases of lung adenocarcinoma from June 2017 to January 2, 2022, HE staining section was used to determine pathological subtypes and pathological characteristics, count STAS number and grade. The expression of ROR1 was detected by immunohistochemistry staining in different pathological subtypes of lung adenocarcinoma and the relationship with STAS quantity was analyzed. Results ROR1 expressions were higher in micropapillary and solid lung adenocarcinoma (poorly differentiated) (P < 0.001); ROR1 expression rates were 88.0%, 94.1% in low STAS and high STAS groups, significantly higher than no STAS group (P < 0.001). Conclusions ROR1 is highly expressed in poorly differentiated lung adenocarcinoma and suggests a higher incidence of STAS. ROR1 is expected to be a new diagnostic biomarker of lung adenocarcinoma for guiding clinical treatment and assisting prognostic judgment, and may be a potential therapeutic target for STAS-positive lung adenocarcinoma. -
Key words:
- Lung adenocarcinoma /
- ROR1 /
- Spread through air space /
- Pathological subtypes /
- Immunohistochemistry
-
表 1 STAS与肺腺癌临床病理学特征的关系 [n(%)]
Table 1. Relationship between STAS and clinicopathological features of lung adenocarcinoma[n(%)]
临床病理学参数 n STAS χ2 P + − 性别 1.305 0.253 男 242 82(33.9) 160(66.1) 女 376 111(29.5) 265(70.5) 年龄(岁) 3.388 0.066 < 65 280 98(35.0) 182(65.0) ≥65 338 95(28.1) 243(71.9) 吸烟史 25.262 < 0.001* 无 431 108(25.1) 323(74.9) 有 187 85(45.5) 102(54.5) 肿瘤直径(cm) 191.946 < 0.001* ≤2.5 442 66(14.9) 376(85.1) > 2.5 176 127(72.2) 49(27.8) 组织学形态 123.404 < 0.001* 贴壁型 95 0(0.0) 95(100.0) 腺泡型 255 68(26.7) 187(73.3) 乳头型 148 43(29.1) 105(70.9) 微乳头型 69 49(71.0) 20(29.0) 实体型 51 33(64.7) 18(35.3) 淋巴结转移 139.614 < 0.001* 无 529 108(20.4) 421(79.6) 有 89 73(82.0) 16(18.0) 神经侵犯 30.739 < 0.001* 无 595 169(28.4) 426(71.6) 有 23 19(82.6) 4(17.4) 脉管侵犯 145.165 < 0.001* 无 517 124(24.0) 393(76.0) 有 101 87(86.1) 14(13.9) 胸膜侵犯 225.090 < 0.001* 无 443 83(18.7) 360(81.3) 有 175 146(83.4) 29(16.6) *P < 0.05。 表 2 ROR1在不同亚型肺腺癌中的表达 [n(%)]
Table 2. Expression of ROR1 in different subtypes of lung adenocarcinoma[n(%)]
肺腺癌病理亚型 n ROR1 χ2 P + − 贴壁型(高分化) 95 9(9.5) 86(90.5) 腺泡型(中分化) 255 73(28.6) 182(71.4) 乳头型(中分化) 148 49(33.1) 99(66.9) 135.093 < 0.001* 微乳头型(低分化) 69 55(79.7) 14(20.3) 实体型(低分化) 51 41(80.4) 10(19.6) *P < 0.05。 表 3 ROR1在不同STAS分组中的表达 [n(%)]
Table 3. ROR1 expression in different STAS groups[n(%)]
STAS分组 n ROR1 χ2 P + − 无STAS组 425 45(10.6) 380(89.4) 低STAS组 109 96(88.0) 13(12.0) 372.047 < 0.001* 高STAS组 84 79(94.1) 5(5.9) *P < 0.05。 -
[1] Sung H,Ferlay J,Siegel R L,et al. Global cancer statistics 2020:GLOBOCAN estimatesof incidence and mortality world wide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2021,71(3):209-249. doi: 10.3322/caac.21660 [2] Siegel R L,Miller K D,Jemal A. Cancer statistics,2020[J]. CA Cancer J Clin,2020,70(1):7-30. doi: 10.3322/caac.21590 [3] Travis W D,Brambilla E,Noguchi M,et al. Interna-tional association for the study of lung cancer/American Thoracic Society/European Respiratory Society international multidiscipli-nary classification of lung adenocarcinoma[J]. J Thorac Oncol,2011,6(2):244-285. doi: 10.1097/JTO.0b013e318206a221 [4] Travis W D,Brambilla E,Nicholson A G,et al. The 2015 World Health Organization classification of lung tumors:impact of genetic,clinical and radiologic advancessince the 2004 classification[J]. J Thorac Oncol,2015,10(9):1243-1260. doi: 10.1097/JTO.0000000000000630 [5] Vaghjiani R G,Takahashi Y,Eguchi T,et al. Tumor spread through air spaces (STAS)is predictor of occult lymphnodeme-tastasis in clinical stage IA lung adenocarcinoma[J]. J Thorac Oncol,2020,15(5):792-802. doi: 10.1016/j.jtho.2020.01.008 [6] Masiakowski P,Carroll R D. A novel family of cell surface receptors with tyrosine kinase-like domain[J]. J Biol Chem,1992,267(36):26181-26190. doi: 10.1016/S0021-9258(18)35733-8 [7] Borcherding N,Kusner D,Liu G H,et al. ROR1,an embryonic protein with an emerg-ing role in cancer biology[J]. Protein Cell,2014,5(7):496-502. doi: 10.1007/s13238-014-0059-7 [8] Kipps T J. ROR1:An orphan becomes apparent[J]. Blood,2022,140(14):1583-1591. doi: 10.1182/blood.2021014760 [9] Green J L, Kuntz S G, Sternberg P W. Ror receptor tyrosine kinases: orphans no more[J]. Trends Cell Biol, 2008, 18(11): 536-544. [10] Chiang C L,Goswami S,Frissora F,et al. ROR1-targeted delivery of miR-29b induces cell cycle arrest and therapeutic benefit in vivo in CLL mouse model[J]. Blood,2019,134(5):432-444. doi: 10.1182/blood.2018882290 [11] Zhang S,Cui B,Lai H,et al. Ovarian cancer stem cells express ROR1,which can be targeted for anti-cancer-stem-cell therapy[J]. Proc Natl Acad Sci USA,2014,111(48):17266-17271. doi: 10.1073/pnas.1419599111 [12] Rich B E,Hojjat-Farsangi M,Ghaemimanesh F,et al. Inhibition of the receptor tyrosine kinase ROR1 by anti-ROR1 monoclonal antibodies and siRNA induced apoptosis of melanoma cells[J]. PLoS One,2013,8(4):e61167. doi: 10.1371/journal.pone.0061167 [13] Zhang S P,Chen L G,Cui B,et al. ROR1 is expressed in human breast cancer and associated with enhanced tumor-cell growth[J]. PLoS One,2012,7(3):e31127. doi: 10.1371/journal.pone.0031127 [14] Villalbalj A,Shih A R,Sayo T M S,et al. Accuracy andreproducibility of intraop-erative assessment on tumor spread through air spaces(STAS)in stage l lung adenocarcinomas[J]. J Thorac Oncol,2021,16(4):619-629. doi: 10.1016/j.jtho.2020.12.005 [15] Kadota K,Nitadori J I,Sima C S,et al. Tumor spread through air spaces is an important pattern of invasion and impacts the frequency and location of recurrences after limited resection for small stage I lung adenocarcinomas[J]. J Thorac Oncol,2015,10(5):806-814. [16] Uruga H,Fujii T,Fujimori S,et al. Semiquantitative assessment of tumor spread through air spaces (STAS) in early-stage lung adenocarcinomas[J]. Journal of Thoracic Oncology,2017,12(7):1046-1051. doi: 10.1016/j.jtho.2017.03.019 [17] Toyokawa G,Yamada Y,Tagawa T,et al. Significance of spread through air spaces in resected pathological stage I lung adenocarcinoma[J]. Ann Thorac Surg,2018,105(6):1655-1663. doi: 10.1016/j.athoracsur.2018.01.037 [18] Alvarez Moreno J C,Aljamal A A,Bahmad H F,et al. Correlation between spread through air spaces (STAS) and other clinicopathological parameters in lung cancer[J]. Pathol Res Pract,2021,220(4):153376. doi: 10.1016/j.prp.2021.153376.Epub2021Feb16 [19] 王作刚,冯彦,于亮,等. ROR1对人肺癌A549细胞上皮-间质转化的影响[J]. 肿瘤防治研究,2018,45(7):458-462. [20] Gentile A,Lazzari L,Benvenuti S,et al. The ROR1 pseudokinase diversifies signaling outputs in MET-addicted cancer cells[J]. Int J Cancer,2014,135(10):2305-2316. doi: 10.1002/ijc.28879 [21] Cui B,Zhang S,Chen L,et al. Targeting RORI inhibits epithelial-mesenchymal transition and metastasis[J]. Cancer Res,2013,73(12):3649-3660. doi: 10.1158/0008-5472.CAN-12-3832 [22] 马文琦,何鑫,张红丽,等. 下调结直肠癌细胞受体酪氨酸激酶样孤儿受体抑制细胞生长并促进其凋亡[J]. 细胞与分子免疫学杂志,2016,32(5):655-659,665. doi: 10.13423/j.cnki.cjcmi.007760 [23] Tomoya,Yamaguchi,Can Lu,et al. ROR1 sustains caveolae and survival signalling as a scaffold of cavin-1 and caveolin-1[J]. Nature Communications,2016,7(4):10060. doi: 10.1038/ncomms10060 [24] Zheng Y Z,Ma R,Zhou J,et al. ROR1 is a novel prognostic biomarker in patients with lung adenocarcinoma[J]. Scientific Reports,2016,6(10):36447. [25] Onozato Y,Nakajima T,Yokota H,et al. Radiomics is feasible for prediction of spread through air spaces in patients with nonsmall cell lung cancer[J]. Scientific Reports,2021,11(1):13526. doi: 10.1038/s41598-021-93002-4 [26] Han Y B,Kim H,Mino-Kenudson M,et al. Tumor spread through air spaces (STAS):prognostic significance of grading in non-small cell lung cancer[J]. Mod Pathol,2021,34(3):549-561. doi: 10.1038/s41379-020-00709-2 [27] Chae M,Jeon J H,Chung J H,et al. Prognostic significance of tumor spread through air spaces in patients with stage IA part-solid lung adenocarcinoma after sublobar resection[J]. Lung Cancer,2021,152(2):21-26. -






 下载:
下载: