Application of Contrast-enhanced CT and MRI in Preoperative TNM Staging of Pancreatic Cancer
-
摘要:
目的 探讨增强CT及MRI检查在胰腺癌术前TNM分期中的临床应用价值。 方法 回顾性分析昆明医科大学第一附属医院2019年1月至2021年12月经手术病理确诊的胰腺癌患者62例,分析患者术前的增强CT及MRI图像、手术情况及术后病理结果。由2名高年资放射科医师采用双盲法对患者术前影像图像进行分期,将2种检查方法的术前TNM分期与手术病理结果进行比较。 结果 增强CT和MRI检查对胰腺癌术前TNM分期判断的准确率分别为:T分期86.96%(40/46)和89.13%(41/46)、N分期78.57%(33/42)和73.81%(31/42)、M分期96.77%(60/62)和98.39%(61/62),2种检查方法与手术病理结果比较T分期具有较强的一致性、N分期具有中等强度一致性、M分期具有强一致性,且2种检查方法评估的准确性差异无统计学意义(P > 0.05)。 结论 增强CT及MRI检查对胰腺癌术前TNM分期评估与手术病理结果对照具有良好的相关性,可为临床医师提供术前评估参考及指导治疗决策,具有良好的临床应用价值。 Abstract:Objective To investigate the clinical value of contrast-enhanced CT and MRI in preoperative TNM staging of pancreatic cancer. Methods A retrospective analysis was performed on 62 pancreatic cancer patients diagnosed by surgical pathology from January 2019 to December 2021 in the First Affiliated Hospital of Kunming Medical University. The preoperative enhanced CT and MRI images, operation status and postoperative pathological results were analyzed. All the findings were reviewed by two senior radiologists separately for preoperative imaging staging. The preoperative TNM staging of the two methods were compared with the surgical and pathological results. Results The overall accuracy of contrast-enhanced CT and MRI in TNM staging of pancreatic cancer were 86.96% (40/46)and 89.13% (41/46)in T stages, 78.57% (33/42)and 73.81% (31/42) in N stages, 96.77% (60/62) and 98.39% (61/62)in M stages, both had good consistency in T stages, moderate consistency in N stages and strong consistency in M stages compared with surgical and pathological results. There was no significant difference between the two methods in the accuracy of preoperative TNM staging (P > 0. 05). Conclusion Enhanced CT and MRI have a good correlation between preoperative TNM staging evaluation and surgical pathological results of pancreatic cancer, which can provide a reference for preoperative evaluation and guide treatment decision making for clinicians, and have good clinical application value. -
Key words:
- Pancreatic cancer /
- Tomography /
- X-ray computer /
- Magnetic resonance imaging /
- TNM staging
-
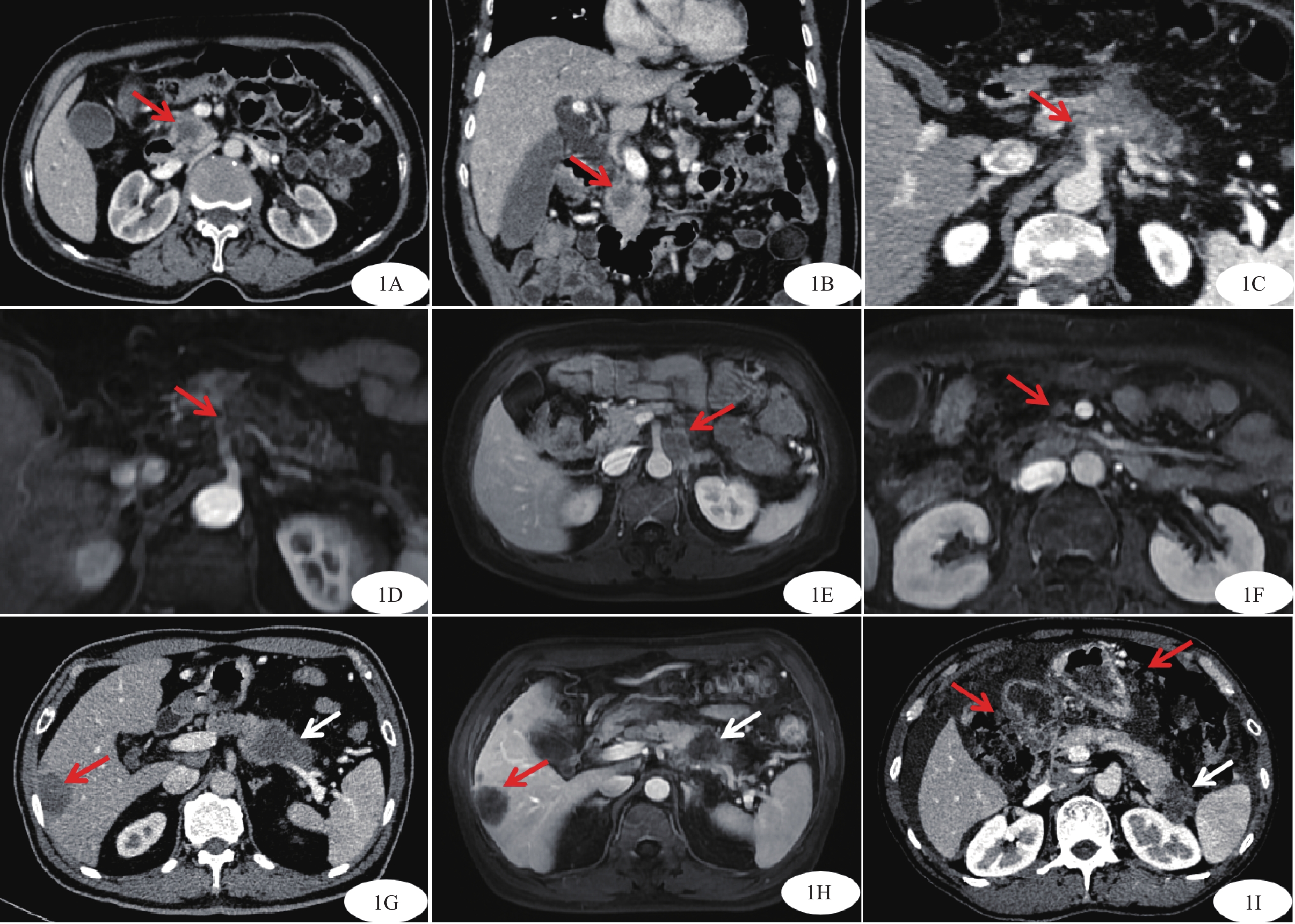
图 1 胰腺癌增强扫描图像
胰头部见一不规则稍低强化结节,轴位测量(图1A,红箭)肿瘤最大径约2.2 cm,冠状位测量(图1B,红箭)肿瘤最大径约1.6 cm,最终CT测量肿瘤最大径取2.2 cm;MRI测量胰腺癌肿瘤最大径方法同前。图1C~D T4期胰腺癌增强扫描图像;轴位CT(图1C,红箭)及轴位MRI(图1D,红箭)示肿瘤与腹腔干分界不清,腹腔干受累包绕,管腔粗细不均。图1E~F 胰腺癌转移淋巴结MRI增强扫描图像;腹主动脉旁左侧1枚肿大淋巴结,短径大于10 mm,增强后呈环形强化、内部强化不均(图1E,红箭);肠系膜上动脉右侧1枚稍大淋巴结,短径约7 mm,形态不规则、增强强化欠均(图1F,红箭)。图1G~I 胰腺癌转移瘤增强扫描图像;轴位CT(图1G,红箭)及轴位MRI(图1H,红箭)示肝右叶多个低强化结节,强化程度与胰腺癌病灶相仿(白箭),提示肝转移瘤。网膜不规则增厚并多个稍低强化结节(图1I,红箭),强化程度与胰腺癌病灶相近(白箭),伴有腹水,提示网膜多发转移。
Figure 1. Enhanced scan images of pancreatic cancer
表 1 增强CT及MRI评估胰腺癌术前T分期与病理对照(n)
Table 1. Enhanced CT and MRI in preoperative T staging of pancreatic cancer compared with pathology (n)
检查
方法病理诊断T分期 合计 准确率(%) 灵敏度(%) 特异度(%) T1 T2 T3 T4 增强CT T1 5 0 0 0 5 100.00 71.43 100.00 T2 2 23 2 1 28 82.14 95.83 77.27 T3 0 1 9 0 10 90.00 81.82 97.14 T4 0 0 0 3 3 100.00 75.00 100.00 合计 7 24 11 4 46 86.96 增强MRI T1 7 0 0 0 7 100.00 100.00 100.00 T2 0 23 2 1 26 88.46 95.83 86.36 T3 0 1 9 1 11 81.81 81.82 94.29 T4 0 0 0 2 2 100.00 50.00 100.00 合计 7 24 11 4 46 89.13 表 2 增强CT及MRI评估胰腺癌术前N分期与病理对照(n)
Table 2. Enhanced CT and MRI in preoperative N staging of pancreatic cancer compared with pathology (n)
检查方法 分期 病理诊断N分期 合计 准确率(%) 灵敏度(%) 特异度(%) N0 N1 N2 增强CT N0 24 5 1 30 80.00 92.31 62.50 N1 2 8 1 11 72.73 61.54 89.65 N2 0 0 1 1 100.00 33.33 100.00 合计 26 13 3 42 78.57 增强MRI N0 24 7 1 32 75.00 92.31 50.00 N1 2 6 1 9 66.67 46.15 89.65 N2 0 0 1 1 100.00 33.33 100.00 合计 26 13 3 42 73.81 表 3 增强CT及MRI评估胰腺癌术前M分期与病理对照(n)
Table 3. Enhanced CT and MRI in preoperative M staging of pancreatic cancer compared with pathology (n)
检查方法 分期 病理诊断M分期 合计 准确率(%) 灵敏度(%) 特异度(%) M0 M1 增强CT M0 46 2 48 95.83 100.00 87.50 M1 0 14 14 100 87.50 100.00 合计 46 16 62 96.77 增强MRI M0 46 1 47 97.87 100.00 93.75 M1 0 15 15 100 93.75 100.00 合计 46 16 62 98.39 -
[1] Zheng R S,Zhang S W,Zeng H M,et al. Cancer incidence and mortality in China,2016[J]. JNCC,2022,2(1):1-9. [2] Bae J S,Kim J H,Kang H J,et al. Prediction of residual tumor and overall survival after first-line surgery in patients with pancreatic ductal adenocarcinoma using preoperative magnetic resonance imaging findings[J]. Acta Radiol,2022,63(4):435-446. doi: 10.1177/0284185121999998 [3] Noda Y,Goshima S,Takai Y,et al. Detection of pancreatic ductal adenocarcinoma and liver metastases: comparison of Gd-EOB-DTPA-enhanced MR imaging vs. extracellular contrast material[J]. Abdom Radiol (NY),2020,45(8):2459-2468. doi: 10.1007/s00261-020-02511-9 [4] 中华医学会外科学分会胰腺外科学组. 中国胰腺癌诊治指南(2021)[J]. 中华外科杂志,2021,59(7):561-577. doi: 10.3760/cma.j.cn112139-20210416-00171 [5] Chu L C,Goggins M G,Fishman E K. Diagnosis and detection of pancreatic cancer[J]. The Cancer Journal,2017,23(6):333-342. doi: 10.1097/PPO.0000000000000290 [6] Noda Y,Tomita H,Ishihara T,et al. Prediction of overall survival in patients with pancreatic ductal adenocarcinoma:Histogram analysis of ADC value and correlation with pathological intratumoral necrosis[J]. BMC Med Imaging,2022,22(1):23. doi: 10.1186/s12880-022-00751-3 [7] 李斌,陆风旗,陈昉铭,等. 基于第8版AJCC胰腺癌TNM分期的CT、MRI检查比较[J]. 中华肝胆外科杂志,2020,26(9):661-665. doi: 10.3760/cma.j.cn113884-20191129-00395 [8] Soloff E V,Zaheer A,Meier J,et al. Staging of pancreatic cancer: resectable,borderline resectable,and unresectable disease[J]. Abdominal Radiology,2018,43(2):301-313. doi: 10.1007/s00261-017-1410-2 [9] Lee J H,Han S S,Hong E K,et al. Predicting lymph node metastasis in pancreatobiliary cancer with magnetic resonance imaging: A prospective analysis[J]. Eur J Radiol,2019,116:1-7. doi: 10.1016/j.ejrad.2019.04.007 [10] Nguyen A H,Melstrom L G. Use of imaging as staging and surgical planning for pancreatic surgery[J]. Hepatobiliary Surg Nutr,2020,9(5):603-614. doi: 10.21037/hbsn.2019.05.04 [11] 李佶松,田孝东,高红桥,等. 胰腺癌术后预后因素分析及AJCC第8版TNM分期意义评价(附143例报告)[J]. 中国实用外科杂志,2018,38(7):786-791. doi: 10.19538/j.cjps.issn1005-2208.2018.07.22 [12] 潘瑶,余日胜,白雪莉,等. 第8版《美国癌症联合会肿瘤分期手册》胰腺癌分期更新要点的影像学解读[J]. 中华消化外科杂志,2017,16(4):336-340. doi: 10.3760/cma.j.issn.1673-9752.2017.04.004 [13] Allen P J,Kuk D,Castillo C F,et al. Multi-institutional Validation Study of the American Joint Commission on Cancer (8th Edition) Changes for T and N Staging in Patients With Pancreatic Adenocarcinoma[J]. Ann Surg,2017,265(1):185-191. doi: 10.1097/SLA.0000000000001763 [14] Masuda T,Dann A M,Elliott I A,et al. A comprehensive assessment of accurate lymph node staging and preoperative detection in resected pancreatic cancer[J]. J Gastrointest Surg,2018,22(2):295-302. doi: 10.1007/s11605-017-3607-7 [15] 冯广龙,姜慧杰,李金平,等. 多层螺旋CT增强扫描在胰腺癌术前诊断中的价值[J]. 中华医学杂志,2017,97(11):838-842. doi: 10.3760/cma.j.issn.0376-2491.2017.11.009 [16] Deng Y,Ming B,Wu J L,et al. Magnetic resonance imaging for preoperative staging of pancreatic cancer based on the 8th edition of AJCC guidelines[J]. J Gastrointest Oncol,2020,11(2):329-336. doi: 10.21037/jgo.2020.03.06 -






 下载:
下载: