CircRNA EZH2 Promotes Proliferation and Migration of Prostate Cancer Cells by Regulating miR-30c-5p
-
摘要:
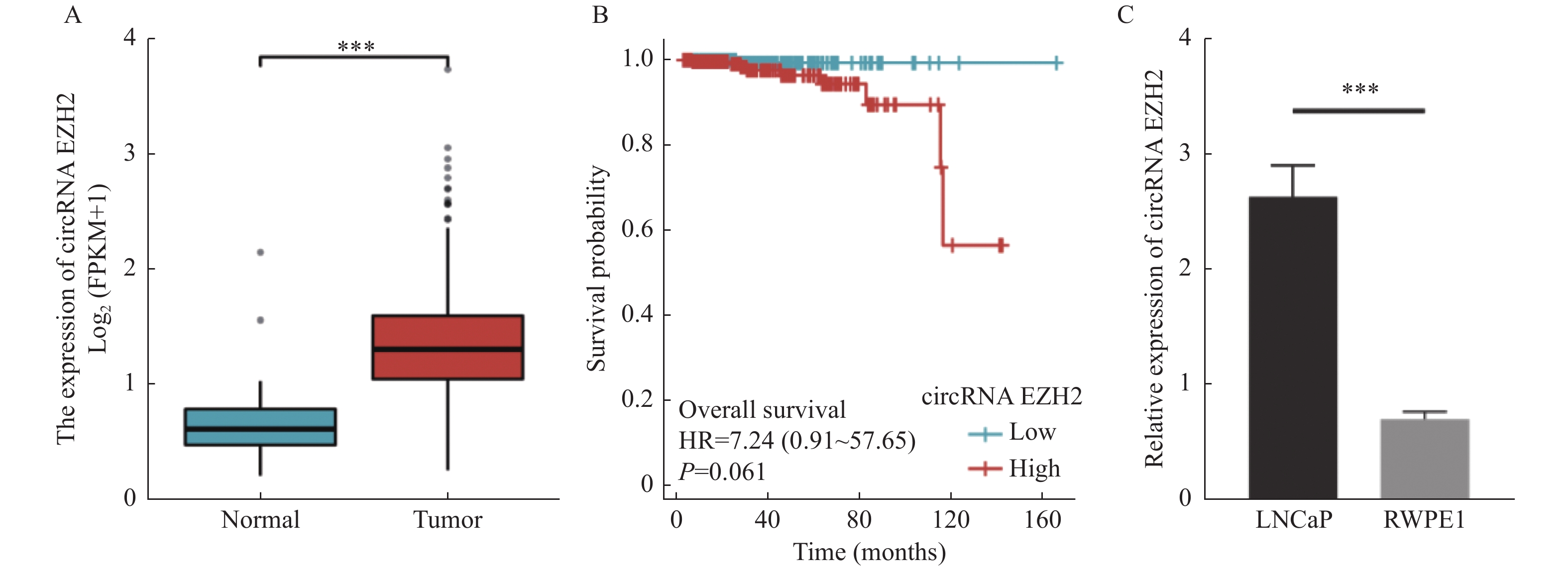
目的 探究circRNA EZH2通过调控miR-30c-5p对前列腺癌细胞的增殖和迁移的影响及其相关作用机制。 方法 通过TCGA数据库分析circRNA EZH2在前列腺癌组织中的表达差异及生存曲线;转染siRNA敲降前列腺癌LNCaP细胞中的circRNA EZH2表达后,CCK-8实验和划痕实验观察LNCaP细胞增殖和迁移,RT-qPCR和Western blot法测定miR-30c-5p、JAK1和PI3K蛋白的表达。 结果 在前列腺癌组织中circRNA EZH2的表达显著上调(P < 0.0001),且高表达circRNA EZH2的患者生存率降低;沉默circRNA EZH2的LNCaP细胞较正常LNCaP细胞的增殖和迁移能力下降(P < 0.0001),miR-30c-5p表达增高(P < 0.0001),JAK1表达降低(P < 0.0001),PI3K信号受抑制。 结论 EZH2在前列腺癌中高表达,通过调控miR-30c-5p激活PI3K信号通路促进前列腺癌LNCaP细胞的增殖和迁移。 -
关键词:
- 前列腺癌 /
- 环状RNA-EZH2 /
- miR-30c-5p /
- 增殖 /
- 迁移
Abstract:Objective To investigate the effect and related mechanism of circRNA EZH2 on proliferation and migration of prostate cancer cells through miR-30c-5p. Methods The expression difference and survival probability of EZH2 in prostate cancer were analyzed according to TCGA database. SiRNA were transfected to silence EZH2 in prostate cancer LNCaP cells, and proliferation and migration of LNCaP cells were detected by CCK-8 assay and wound healing assay, and the expression of miR-30c-5p, JAK1 and PI3K proteins were determined by RT-qPCR and western blot. Results The expression of EZH2 was up-regulated in prostate cancer tissues, and the survival rate of patients with high expression of EZH2 decreased. Compare with normal LNCaP cells, the proliferation and migration of EZH2-silenced LNCaP cells were decreased, miR-30c-5p expression was increased, JAK1 expression was decreased, and PI3K signal was inhibited. Conclusion EZH2 is highly expressed in prostate cancer and can promote the proliferation and migration of LNCaP cells by regulating miR-30c-5p/JAK1 axis and acting on PI3K signaling pathway. -
Key words:
- Prostate cancer /
- CircRNA EZH2 /
- miR-30c-5p /
- Proliferation /
- Migration
-
图 4 CircRNA EZH2靶向miR-30c-5p
A:circRNA EZH2和miR-30c-5p的配对序列;B:双荧光素酶报告基因检测WT/MUT-circRNA EZH2插入的报告基因和miR-30c-5p mimic及其阴性对照共转染LNCaP细胞后的荧光素酶活性;C:RT-qPCR实验检测miR-30c-5p抑制剂的干扰效果;D:miR-30c-5p的RT-qPCR结果分析;E:circRNA EZH2的RT-qPCR结果分析。**P < 0.01;***P < 0.001;****P < 0.0001。
Figure 4. CircRNA EZH2 targeted miR-30c-5p
表 1 RT-qPCR所需引物序列
Table 1. Primer sequences
基因 引物序列(5′-3′) circRNA EZH2 Forward Primer:GGACCACAGTGTTACCAGCAT Reversed Primer:GTGGGGTCTTTATCCGCTCAG miR-30c-5p Forward Primer:GCAGTGTAAACATCCTACACTCT Reversed Primer:TCCAGTTTTTTTTTTTTTTTGCTGA JAK1 Forward Primer:ATGTCCTTGTTGAGAGTGA Reversed Primer:CATCCTTGACGGTGTAATAC GAPDH Forward Primer:TGTGGGCATCAATGGATTTGG Reversed Primer:ACACCATGTATTCCGGGTCAAT U6 Forward Primer:GCTTCGGCAGCACATATACTAAAAT Reversed Primer:CGCTTCACGAATTTGCGTGTCAT -
[1] Rebello R J,Oing C,Knudsen K E,et al. Prostate cancer[J]. Nat Rev Dis Primers,2021,7(1):9. [2] Swami U,McFarland T R,Nussenzveig R,et al. Advanced prostate cancer:Treatment advances and future directions[J]. Trends Cancer,2020,6(8):702-715. [3] Rebbeck,T R. Prostate cancer genetics:Variation by race,ethnicity,and geography[J]. Semin Radiat Oncol,2017,27(1):3-10. [4] Wang C,Tan S,Li J,et al. CircRNAs in lung cancer - Biogenesis,function and clinical implication[J]. Cancer Lett,2020,492:106-115. [5] Liu Y,Chen S,Zong Z H,et al. CircRNA WHSC1 targets the miR-646/NPM1 pathway to promote the development of endometrial cancer[J]. J Cell Mol Med,2020,24(12):6898-6907. [6] Huang,G,Liang M,Liu H,et al. CircRNA hsa_circRNA_104348 promotes hepatocellular carcinoma progression through modulating miR-187-3p/RTKN2 axis and activating Wnt/β-catenin pathway[J]. Cell Death Dis,2020,11(12):1065. [7] Wen J,Li X,Ding Y,et al. Lidocaine inhibits glioma cell proliferation,migration and invasion by modulating the circEZH2/miR-181b-5p pathway[J]. Neuroreport,2021,32(1):52-60. [8] Zhou Y,Shi H,Du Y,et al. lncRNA DLEU2 modulates cell proliferation and invasion of non-small cell lung cancer by regulating miR-30c-5p/SOX9 axis[J]. Aging (Albany NY),2019,11(18):7386-7401. [9] Herichova I,Reis R,Hasakova K,et al. Downregulation of miR-30c-5p expression in colorectal cancer tissue is sex-dependent[J]. Physiol Res,2020,69(Suppl 3):S479-S487. [10] Tanaka T,Okada R,Hozaka Y,et al. Molecular pathogenesis of pancreatic ductal adenocarcinoma:impact of miR-30c-5p and miR-30c-2-3p regulation on oncogenic genes[J]. Cancers (Basel),2020,12(10):2731. [11] Liu J,Lichtenberg T,Hoadley K A,et al. An integrated TCGA Pan-Cancer clinical data resource to drive high-quality survival outcome analytics[J]. Cell,2018,173(2):400-416. [12] Chen B,Lai J,Dai D,et al. JAK1 as a prognostic marker and its correlation with immune infiltrates in breast cancer[J]. Aging (Albany NY),2019,11(23):11124-11135. [13] Ma X,Zhao X,Zhang Z,et al. Differentially expressed non-coding RNAs induced by transmissible gastroenteritis virus potentially regulate inflammation and NF-κB pathway in porcine intestinal epithelial cell line[J]. BMC Genomics,2018,19(1):747. [14] Gao F,Du Y,Zhang Y,et al. Circ-EZH2 knockdown reverses DDAH1 and CBX3-mediated cell growth and invasion in glioma through miR-1265 sponge activity[J]. Gene,2020,726:144196. [15] Yang J,Nie J,Ma X,et al. Targeting PI3K in cancer:mechanisms and advances in clinical trials[J]. Mol Cancer,2019,18(1):26. [16] Taylor B S,Schultz N,Hieronymus H,et al. Integrative genomic profiling of human prostate cancer[J]. Cancer Cell,2010,18(1):11-22. [17] Tang Y,Pan J,Huang S,et al. Downregulation of miR-133a-3p promotes prostate cancer bone metastasis via activating PI3K/AKT signaling[J]. J Exp Clin Cancer Res,2018,37(1):160. [18] Liu J M,Yu C P,Chuang H C,et al. Androgen deprivation therapy for prostate cancer and the risk of autoimmune diseases[J]. Prostate Cancer Prostatic Dis,2019,22(3):475-482. [19] Edlind M P,Hsieh A C. PI3K-AKT-mTOR signaling in prostate cancer progression and androgen deprivation therapy resistance[J]. Asian J Androl,2014,16(3):378-386. -






 下载:
下载: