Transplantation of Nurr1 Gene-modified Embryo Midbrain Neural Stem Cells for Treatment of Parkinson’s Rats
-
摘要:
目的 探讨移植Nurr1基因修饰胚胎中脑神经干细胞对帕金森大鼠的治疗效果。 方法 (1)建立SD大鼠帕金森病模型;(2)原代培养SD大鼠胚胎中脑神经干细胞,并于神经干细胞过表达Nurr1;(3)移植治疗分组:假手术组(A组),移植神经干细胞组(B组),移植Nurr1修饰神经干细胞组(C组);(4)在移植后3周、6周、9周和12周分别对各组大鼠进行行为学测试,观察各组症状改善情况;(5)移植12周后,分别检测各组中Nurr1、TH蛋白表达情况和Nurr1荧光情况。 结果 (1)原代培养大鼠胚胎中脑神经干细胞,并于神经干细胞成功过表达Nurr1基因。(2)免疫荧光、Western Blot证实过表达Nurr1可以促进神经干细胞向多巴胺能神经元转化(P < 0.05)。(3)移植Nurr1修饰神经干细胞可以有效的改善帕金森大鼠的症状(P < 0.05),Western Blot证实小胶质细胞可显著促进移植后的神经干细胞在分化为多巴胺能神经元(P < 0.05)。(4)移植后Nurr1能促进神经干细胞向多巴胺能神经元转化,提高移植神经干细胞的存活,达到更好治疗效果。 结论 Nurr1基因可以促进神经干细胞向多巴胺能神经元转化;移植修饰Nurr1神经干细胞可以有效治疗帕金森大鼠。 Abstract:Objective To investigate the therapeutic effect of transplantedNurr1 gene-modified Embryo Midbrain neural stem cells on Parkinson’ s rats. Methods 1. Establishment of Parkinson’ s disease model in SD rats.2. Primary culture Embryo Midbrain neural stem cells (NCSs) and Nurr1 gene-modified neural stem cells.3. Transplantation treatment group: sham operation group (sham group), Transplanted neural stem cell group (NCS group), transplanted Nurr1 gene-modified neural stem cells group (NNCS group). 4. At 3 weeks, 6 weeks, 9 weeks, and 12 weeks after the combined transplantation, the behavioral tests of rats in each group were performed to observe the improvement of symptoms in each group. 5. After 12 weeks of transplantation, the expression of Nurr1, TH protein and Nurr1 fluorescence were detected in each group. Results 1. Primary cultured neural stem cells, and successfully overexpressed Nurr1 in neural stem cells. 2. Immunofluorescence and Western Blot confirmed that overexpression of Nurr1 could promote the transformation of neural stem cells into dopaminergic neurons (P < 0.05). 3. Transplantation of NNCS can effectively improve the symptoms of Parkinson’ s rats (P < 0.05). 4. After transplantation, Nurr1 can promote the transformation of neural stem cells into dopaminergic neurons, greatly improve the survival of transplanted neural stem cells and achieve better therapeutic effect. Conclusion Nurr1 can advance the transformation of neural stem cells into dopaminergic neurons. Transplantation of overexpression of Nurr1 neural stem cells can effectively treat Parkinson’ s rats. -
Key words:
- Nurr1 /
- Neural stem cells /
- Parkinson Disease
-
帕金森病(parkinson’ s disease,PD)是一种隐匿起病,缓慢进展的中枢神经系统退行性病变,其神经病理改变主要是以黑质纹状体多巴胺能神经元选择性变性、缺失进而表现出一系列的认知障碍、平衡障碍等临床症状[1]。对于PD治疗多采用口服补充外源性多巴胺前体方法,但长期药物治疗会产生一些运动系统并发症[2]。目前利用外源性的多能干细胞重建脑内的多巴胺能系统是目前移植治疗PD的方法之一[3-4]。神经干细胞(neural stem cells,NCSs)是一种具有自我更新和多分化潜能的细胞,并在一定因素诱导下具有向神经细胞分化的特点[5-6],然而神经干细胞移植存活率低,定向分化性差等问题仍需要进一步解决[7]。因此,如何促进移植神经干细胞长期存活,并且定向分化为多巴胺能神经元是当下神经干细胞移植成败的关键。
核受体相关因子1(nuclear receptor- -related factor 1 Nurr1)是核受体超家族中一员,在促进多巴胺能神经元分化、成熟的中发挥关键影响。实验表明Nurr1在体外可以有效的促进神经干细胞向多巴胺能神经元分化[8]。并且体内证实可以通过下调CCL2发挥神经保护和抗炎作用[9-10]。这表明,Nurr1可能促进神经干细胞分化为多巴胺能神经元,在重建多巴胺能系统中发挥积极作用。为此本研究拟通过在体内移植Nurr1修饰后的神经干细胞,在促进神经干细胞分化为多巴胺能神经元的同时改善移植微环境,探究对治疗帕金森大鼠的效果的影响。
1. 材料与方法
1.1 主要实验试剂和设备
细胞培养箱(Thermo)、荧光显微镜(Olympus)、凝胶成像系统(Bio-rad)、PCR扩增仪(eppendrof)、胎牛血清(FBS)购自BI公司、DMEM/F12、DMEM/high glucose购自HyClone山羊血清和RIPA裂解液购自Beyotime公司、Alexa Fluor 594山羊抗兔IgG、兔抗CDllb/c IgG、兔抗TH、兔抗Nestin IgG均购自Abcam公司、逆转录试剂盒购自Fermentas公司、含DAPI封片剂购自Sigma公司。
1.2 大鼠胚胎中脑神经干细胞原代培养
SD大鼠均购自昆明医科大学实验动物中心。取孕12.5~14.5 d的SD大鼠,处死后快速消毒取胚胎鼠,于无菌培养皿取胚胎中脑腹侧组织,并去除脑膜、血管,预冷干细胞培养基中剪碎并吹打混匀,200 µm滤网过滤,1000 r/min离心5 min,弃上清,按1×105/mL密度接种于细胞培养瓶后37 ℃、5%CO2孵箱培养,视细胞生长状态半量更换培养基。神经干细胞完全培养基(34.4 mL的DMEM/F12,37%葡萄糖0.8 mL,20 ng/mL的EGF、20 ng/mL的bFGF、2%B27、1%L-谷氨酰胺,1%青链双抗)。
1.3 原代神经干细胞鉴定
取20个神经球接种于置有细胞爬片的24孔板中,待贴壁后进行鉴定:吸去孔板中培养基,PBS清洗3次,4%多聚甲醛固定30 min,0.3% Triton透膜15 min,PBS清洗3次,10%山羊血清封闭,加入一抗Nestin(1∶100)过夜,次日早上PBS清洗3次,加入二抗(Alexa Fluor594,1∶500)2 h,PBS清洗3次,DAPI(5 µg/mL)染核,荧光显微镜观察并拍照。
1.4 慢病毒载体及Nurr1修饰基因神经干细胞鉴定
慢病毒载体plenO-DCE-Nurr1携带GFP报告基因由本课题组前期构建。取Nurr1基因修饰神经干细胞分化培养基分化培养7 d后神经干细胞以5×105个接种于置有爬片的24孔板中,待贴壁后鉴定:清洗、固定、透膜、封闭、加入一抗TH(1∶200)过夜、清洗、二抗(Alexa Fluor594,1∶500)2 h,清洗、DAPI封片。荧光显微镜观察并拍照。
1.5 RT -PCR和Western Blot检测
提取神经干细胞和脑组织总RNA,primer5软件设计Nurr1(710 bp)(forward 5′ -AAGCCACCTTGCTTGTA- -CCAAA-3′ ,reverse 5′ -CTTGTAGTAAACCG ACCCGCTG-3′ );TH(843 bp)(forward 5′ -CAGGGCT- -GCTG- -TCTTCCTAC-3′ ,reverse 5′ -GGGCT GTCCAGTACGTCAAT-3′ );GAPDH(forward 5′ -TGCCTCCTGCACCACCAA CT-3′ ,reverse 5′ -CCCGTTCAGCTCAGGGAT- -GA-3′ )基因引物,逆转录(Fermentas)扩增后行1%琼脂糖凝胶电泳,收集并分析数据。(PCR设置参数为:94 ℃ 3 min、35个循环为94 ℃ 45 s、5 ℃ 45 s、72 ℃ 60 s、72 ℃ 10 min使用GAPDH为内参,ImageJ分析实验结果)。RAPI裂解液(Solarbio)提取细胞总蛋白,BCA法测定蛋白浓度并定量,8%SDS-PAGE凝胶电泳,转膜后5%脱脂牛奶封闭1.5 h,分别加入Nurr1、TH后4 ℃过夜,TBST清洗3此后加入HRP标记的二抗孵育1.5 h,TBST清洗3次后使用凝胶成像系统进行ECL化学发光。收集并用ImageJ分析实验结果。
1.6 SD大鼠帕金森病模型制备、行为学评估
10%水合氯醛腹腔注射麻醉大鼠,固定于立体定位仪,参照大鼠立体定位图谱,于右侧前脑内侧束(A/P:-3.6 mm;L:+2.0 mm;V:-9.0 mm)及腹侧被盖区(A/P:-6.0 mm;L:+0.5 mm;V:-8.0 mm)分别立体定向注入12 µg的6 OHDA(3 µg/µL),注射速度为1 µL/min,注射完毕后原位留针5 min,之后缓慢退针(约2 min)。术后3周开始行为学评估,腹腔注射阿扑吗啡(0.25 mg/kg)诱发大鼠旋转,注射后10 min后计数在30 min内旋转次数,取平均向健侧旋转速度 > 7 r/min大鼠为建模成功大鼠。
1.7 移植细胞悬液制备
收集转染Nurr1后48 h神经干细胞混合成约5 µL的细胞混合液,细胞总量为4.5×105个。选用同一批次造模成功PD大鼠,分组如下:假手术组(A组),移植神经干细胞组(B组),移植Nurr1修饰神经干细胞组(C组)。缓慢注射进手术侧纹状体,并停留5 min后缓慢撤出注射针。假手术注射等量的生理盐水。并于移植后3、6、9、12周腹腔注射阿扑吗啡进行行为学测试。
1.8 统计学处理
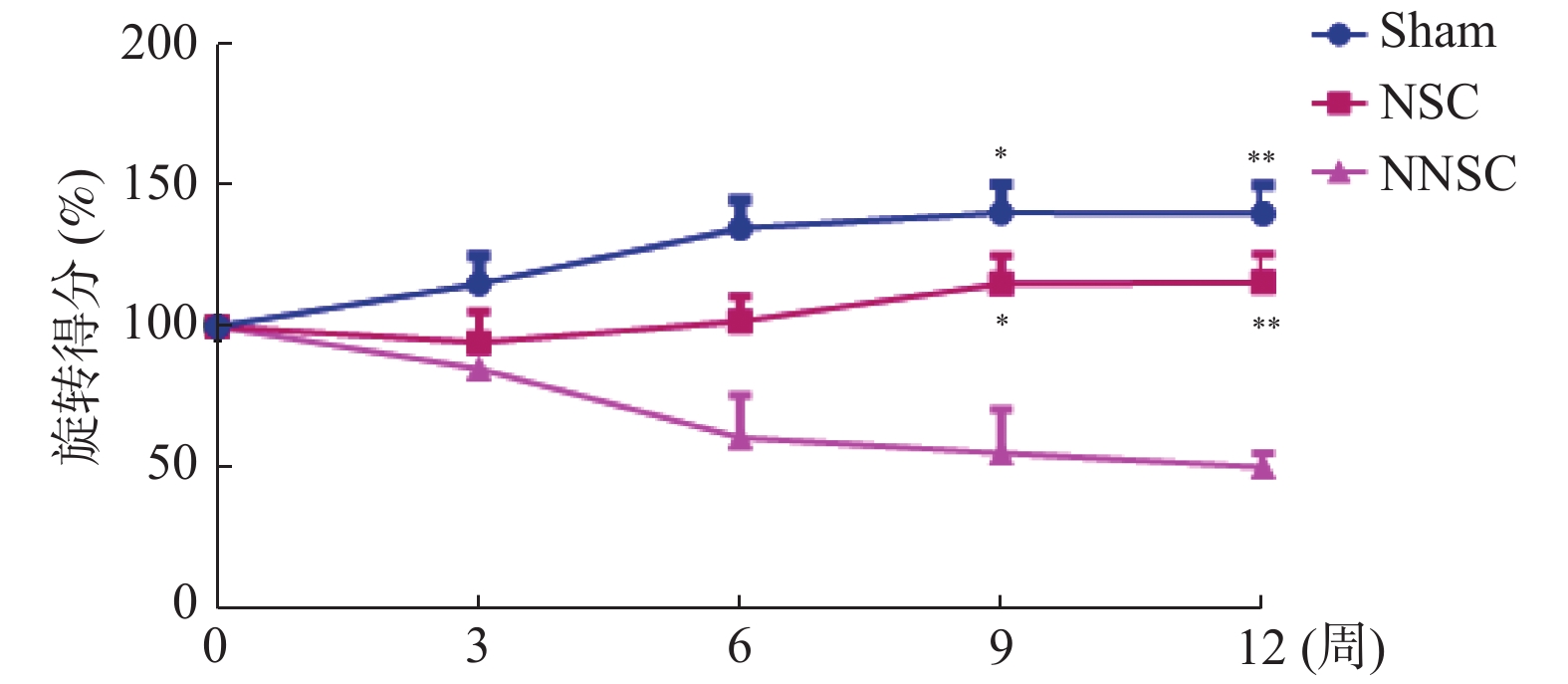
使用SPSS 21.0统计软件处理数据,正态分布的计量资料以均数±标准差(
$\bar x \pm s$ )表示,2组正态计量资料的差异比较采用两独立样本t检验,3组或3组以上正态计量资料的差异对比采用方差分析。P < 0.05为差异具有统计学意义。2. 结果
2.1 大鼠原代神经干细胞培养及鉴定结果
大鼠原代神经干细胞培养至第7天,观察发现细胞呈悬浮生长并聚集成神经球,见图1A;免疫荧光染神经干细胞特异性标志物Nestin蛋白阳性,见图1B、图C。
2.2 检测Nurr1过表达和对神经干细胞分化的影响
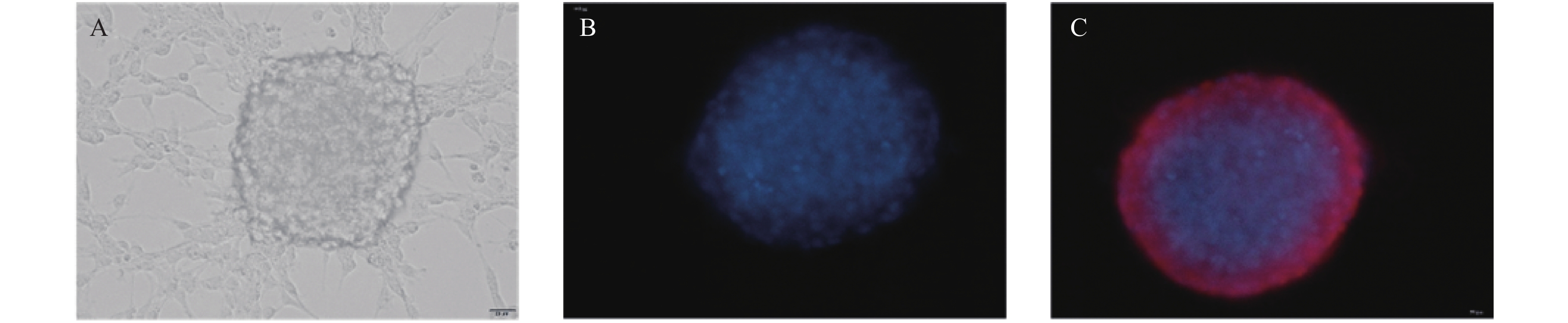
原代神经干细胞培养第7天,慢病毒转染神经干细胞过表达Nurr1-GFP基因(MOI = 200)。72 h后荧光显微镜观察神经干球均表达绿色荧光,见图2A。RT-PCR检测对照组、空载体组和过表达Nurr1组(DEC-Nurr1)Nurr1基因mRNA表达水平。发现DCE-Nurr1组较其他2组明显高表达Nurr1,差异具有统计学意义(t = 18.982 P < 0.001),空载体组和对照组表达差异无统计学意义(t = 0.095 P > 0.05),见图2B、2C。过表达培养7 d后,更换神经干细胞分化培养基(DMEM/F12,1%FBS)。分化培养7 d后荧光检测TH阳性,并且大部分细胞已贴壁分化,见图2D。同时Western检测Nurr1和TH表达情况。结果证实DCE-Nurr1组的Nurr1和TH表达水平均明显上调,具有显著统计学差异(t = 23.169 P < 0.001),空载体组和对照组差异无统计学意义(t = 3.797 P > 0.05),见图2E、F、G。提示过表达Nurr1基因可促进神经干细胞向多巴胺能神经元分化。
2.3 移植过表达Nurr1的神经干细胞有效改善帕金森大鼠症状
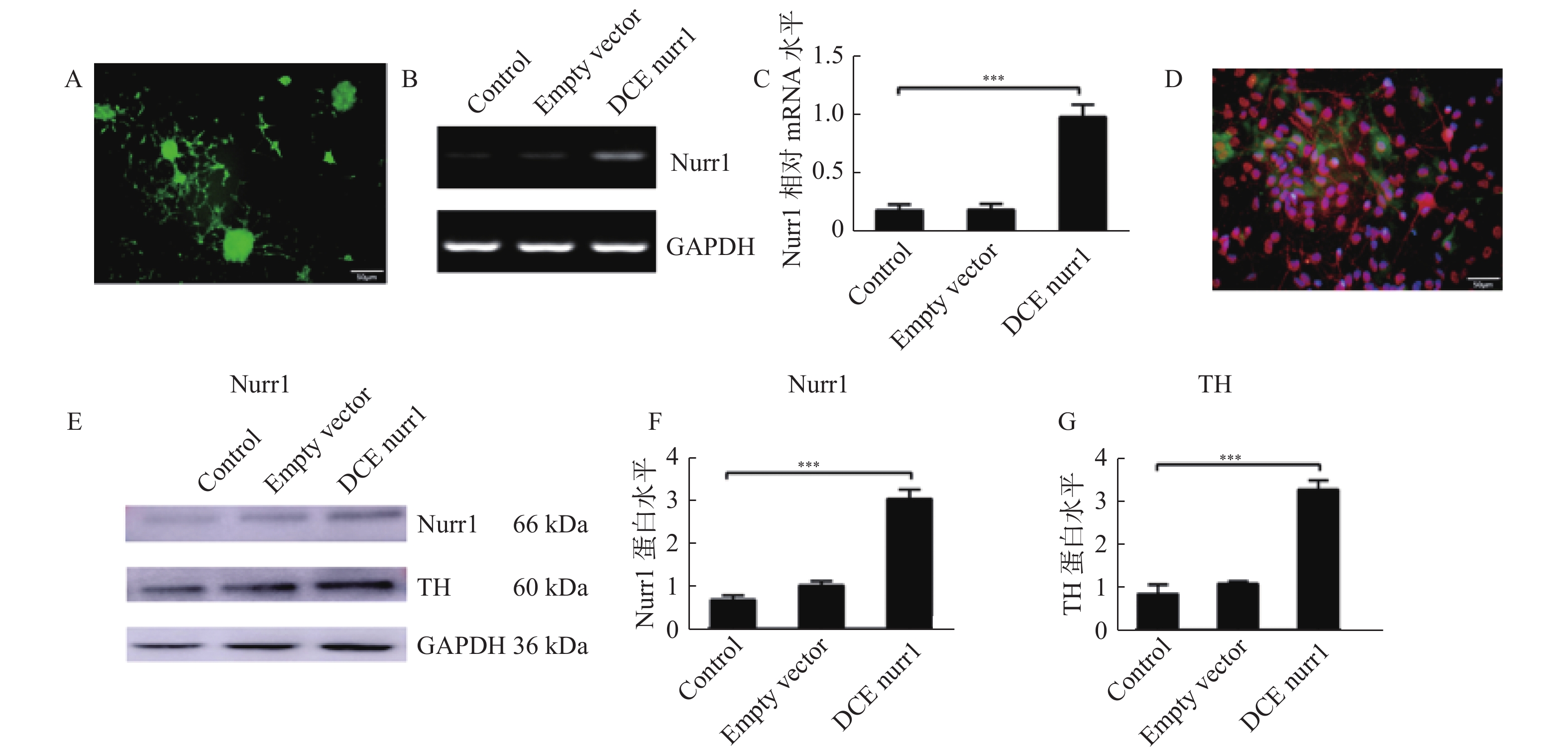
基于上述研究证实过表达Nurr1基因可以促进神经干细胞向多巴胺能神经元转化。因此,笔者联合过表达Nurr1的神经干细胞和小胶质细胞移植治疗帕金森大鼠,实验如前所述。并且在移植后3、6、9、12周分别检测大鼠旋转行为。结果如下:C组在移植后直到12周,一直呈现明显改善症状的趋势。C组较A组(t = 20.683 P < 0.001)、B组(t = 14.816 P < 0.001)在移植后各周均有明显改善,差异具有统计学意义。见图3。
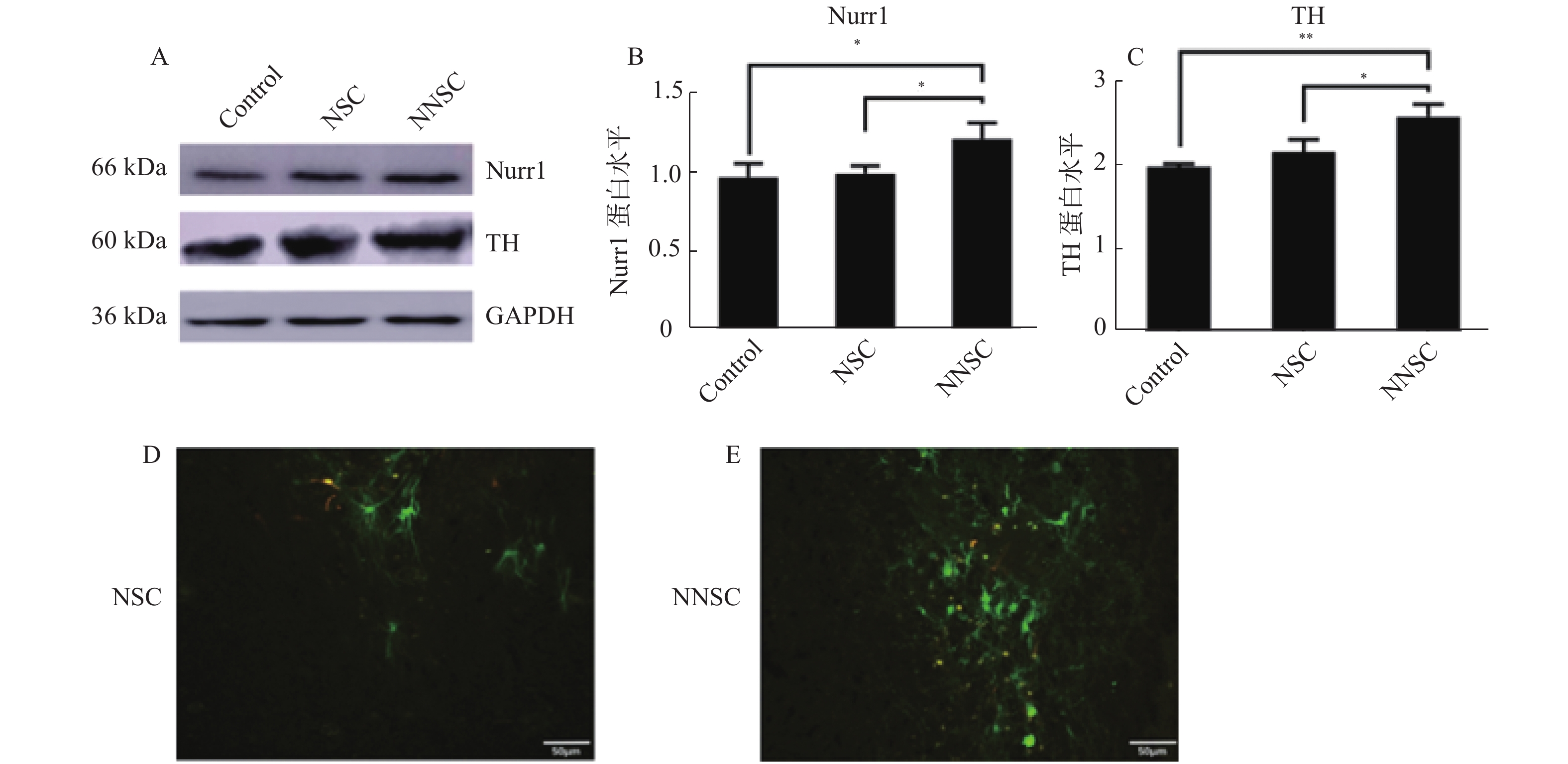
2.4 在移植后Nurr1促进神经干细胞向多巴胺能神经元转化
移植治疗12周后提取各组脑组织的总蛋白,western检测各组Nurr1、TH的表达水平。结果显示C组Nurr1表达水平较A组(t = 6.642 P < 0.001)、B组(t = 3.397 P < 0.05)相比差异具有统计学意义。并且各组TH的表达于A组(t = 6.642 P < 0.001)、B组(t = 3.397 P < 0.05)相比差异具有统计学意义,见图4A、B、C。在移植治疗12周后检测移植区Nurr1绿色荧光表达情况,可见在联合移植NNCS + MG组中外源性移植神经干细胞细胞数量明显高于单独移植NNCS组。以上结果均证实成功移植过表达Nurr1的神经干细胞,此外小胶质细胞可以促进移植神经干细胞的存活,并且在体内验证了过表达Nurr1基因可以持续发挥促进神经干细胞向多巴胺能神经元转化的效果,有效的改善了帕金森鼠的症状。
3. 讨论
帕金森病是好发于中老年的慢性神经变性疾病,其主要病理改变为黑质纹状体多巴胺能神经元变性、缺失伴随着路易小体形成。疾病后期常因平衡障碍、认知功能障碍等导致生活质量严重下降。目前关于帕金森病的药物治疗主要是补充外源性多巴胺来处理对症治疗,但是不能延迟或者阻止疾病的进展[11]。甚至长期治疗可以降低了脑内神经干细胞的数量[12]。神经干细胞是一种具有分化潜能的神经细胞,是目前干细胞移植治疗帕金森的最具前景方法之一。但是如何解决外源性神经干细胞的生存能力差,分化效率低等问题仍是目前面临的主要挑战[13]。
Nurr1(又称NR4A2)是核受体超家族NR4A亚群的成员。有许多研究表明,Nurr1在维持中脑多巴胺能神经元的发育、分化、维持和存活中起着至关重要的作用[14]。可以促进骨髓间充质干细胞、脐血干细胞等向多巴胺能神经元分化[15]。一项研究表面成年小鼠中Nurr1低表达的会导致mDA神经元的逐步丧失[16]。相反,使用病毒载体过表达Nurr1可通过恢复胶质细胞源性神经营养因子(glial cell derived neurotrophic factor,GDNF)的水平来保护多巴胺能神经元免受α-突触核蛋白的毒性[16]。多项研究表明,Nurr1在神经炎症中具有抗炎作用而神经炎症被认为是PD发生的危险因素[17-18]。但是关于PD治疗中过表达nurr1神经干细胞细胞对神经元的影响目前仍不清楚。在本实验中,笔者拟通过探究Nurr1对神经干细胞向多巴胺能神经元分化的影响,进而探究移植过表达Nurr1神经干细胞对帕金森大鼠的治疗效果。首先证实了Nurr1可以明显的促进神经干细胞向多巴胺能神经元分化;进一步通过分别移植NCS、NNCS来观察帕金森大鼠症状改善情况,发现移植NNCS组大鼠症状改善效果最好;并且在移植12周后分别检测各组Nurr1、TH表达水平证实移植组中TH表达量最高。此外,12周后检测B组(单独NCS组)和C组(过表达NURR1+NCS组)中Nurr1荧光表达情况,证实移植过表达C组大鼠外源性移植神经干细胞较单独B组存活率明显增加。其原因可能是过表达Nurr1通过发挥抗炎和神经保护作用为神经干细胞向多巴胺能神经元转化和存活提供了一个良好的微环境,促进其存活和分化。尽管移植后无法完全恢复到造模前,但是移植后使得脑内的多巴胺能神经元的数量得到了显著的增加,在一定程度上重建了多巴胺能系统,可以有效的改善帕金森大鼠症状。
综上所述,本实验得出以下结论:转基因Nurr1可以促进神经干细胞向多巴胺能神经元转化;移植Nurr1 + NCS可以有效的改善帕金森大鼠症状,为促进移植后多巴胺能神经元分化和存活提供了一个良好的微环境。为神经干细胞移植治疗PD提供了一种新的策略。
-
-
[1] Balestrino R,Schapira A H V. Parkinson disease[J]. Eur J Neurol,2020,27(1):27-42. doi: 10.1111/ene.14108 [2] 陈彪. 左旋多巴在帕金森病治疗中的地位及进展[J]. 中国临床神经科学,2017,25(05):546-550. doi: 10.3969/j.issn.1008-0678.2017.05.012 [3] Zhu B,Caldwell M,Song B. Development of stem cell-based therapies for Parkinson's disease[J]. Int J Neurosci,2016,126(11):955-962. doi: 10.3109/00207454.2016.1148034 [4] Zhang Q,Chen W,Tan S,et al. Stem Cells for Modeling and Therapy of Parkinson's Disease[J]. Hum Gene Ther,2017,28(1):85-98. doi: 10.1089/hum.2016.116 [5] 刘罡,吴毅,贾杰,等. 神经干细胞体外分化抗原表达的研究[J]. 中国运动医学杂志,2009,28(01):55-59. [6] Li K,Li J,Zheng J,Qin S. Reactive Astrocytes in Neurodegenerative Diseases[J]. Aging Dis,2019,10(3):664-675. doi: 10.14336/AD.2018.0720 [7] Barker R A,Drouin Ooellet J,Parmar M. Cell-based therapies for Parkinson disease-past insights and future potential[J]. Nat Rev Neurol,2015,11(9):492-503. doi: 10.1038/nrneurol.2015.123 [8] 徐蛟天,陈孝祥,王威,等. Nurr1对小胶质细胞联合神经干细胞共培养促进神经干细胞向多巴胺神经元分化作用研究[J]. 国际神经病学神经外科学杂志,2018,45(1):52-57. [9] Liu W,Gao Y,Chang N. Nurr1 overexpression exerts neuroprotective and anti-inflammatory roles via down-regulating CCL2 expression in both in vivo and in vitro Parkinson's disease models[J]. Biochem Biophys Res Commun,2017,482(4):1312-1319. doi: 10.1016/j.bbrc.2016.12.034 [10] Kadkhodaei B,Ito T,Joodmardi E,et al. Nurr1 is required for maintenance of maturing and adult midbrain dopamine neurons[J]. J Neurosci,2009,29(50):15923-15932. doi: 10.1523/JNEUROSCI.3910-09.2009 [11] Radad K,Moldzio R,AL-Shraim M,et al. Recent Advances on the Role of Neurogenesis in the Adult Brain:Therapeutic Potential in Parkinson's and Alzheimer's Diseases[J]. CNS Neurol Disord Drug Targets,2017,16(7):740-748. [12] O'sullivan S S,Johnson M,Williams D R,et al. The effect of drug treatment on neurogenesis in Parkinson's disease[J]. Mov Disord,2011,26(1):45-50. doi: 10.1002/mds.23340 [13] Madhavan L,Daley B F,Paumier K L,et al. Transplantation of subventricular zone neural precursors induces an endogenous precursor cell response in a rat model of Parkinson's disease[J]. J Comp Neurol,2009,515(1):102-115. doi: 10.1002/cne.22033 [14] Dong J,Liu X,Wang Y,et al. Nurr1(Cd11bcre)conditional knockout mice display inflammatory injury to nigrostriatal dopaminergic neurons[J]. Glia,2020,68(10):2057-2069. doi: 10.1002/glia.23826 [15] Wang X,Zhuang W,Fu W,et al. The lentiviral-mediated Nurr1 genetic engineering mesenchymal stem cells protect dopaminergic neurons in a rat model of Parkinson's disease[J]. Am J Transl Res,2018,10(6):1583-1599. [16] Smith G A,Rocha E M,Rooney T,et al. A Nurr1 agonist causes neuroprotection in a Parkinson's disease lesion model primed with the toll-like receptor 3 dsRNA inflammatory stimulant poly(I:C)[J]. PLoS One,2015,10(3):e0121072. doi: 10.1371/journal.pone.0121072 [17] Ahmed A,Isaksen T J,Yamashita T. Protocol for mouse adult neural stem cell isolation and culture[J]. STAR Protoc,2021,2(2):100522. doi: 10.1016/j.xpro.2021.100522 [18] Raina A,Mahajani S,Bahr M,et al. Neuronal Trans-differentiation by TraNCSription Factors Ascl1 and Nurr1:Induction of a Dopaminergic Neurotransmitter Phenotype in Cortical GABAergic Neurons[J]. Mol Neurobiol,2020,57(1):249-260. doi: 10.1007/s12035-019-01701-x -






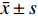
 下载:
下载:
 下载:
下载:

