The Expression of PD-L1, BRAFV600E, CD68 Protein and the Significance of Tumor Infiltrating Lymphocytes in the Diagnosis of Malignant Melanoma
-
摘要:
目的 分析PD-L1、BRAFV600E、CD68蛋白和肿瘤浸润淋巴细胞(TIL)在恶性黑色素瘤诊断中的意义。 方法 应用高通量组织芯片技术及免疫组化方法,检测60例原发性恶性黑色素瘤组织中PD-L1、BRAFV600E、CD68蛋白表达;分析PD-L1、BRAFV600E、CD68蛋白以及TIL与患者的临床病理特征及预后关系。 结果 (1)恶性黑色素瘤组织中CD68蛋白表达与肿瘤T分期之间,差异有统计学意义(P = 0.018),而与肿瘤大小、肿瘤浸润深度、淋巴结转移和溃疡形成之间,差异均无统计学意义(P > 0.05);(2)PD-L1、BRAFV600E和TIL与肿瘤T分期、肿瘤大小、肿瘤浸润深度、淋巴结转移和溃疡形成之间,差异均无统计学意义(P > 0.05);(3)皮肤黑色素瘤BRAFV600E突变率约36.67%(22/60),其中,肢端型黑色素瘤BRAFV600E突变率约68.18%(15/22);黏膜黑色素瘤BRAFV600E突变率约23.33%(14/60);(4)Cox回归生存分析结果显示肿瘤淋巴结转移是影响恶性黑色素瘤患者预后的因素。 结论 (1)CD68蛋白表达在判定患者预后方面可能有一定作用;(2)皮肤部位的黑色素瘤建议行BRAFV600E免疫组化检测;(3)患者存在淋巴结转移可作为恶性黑色素瘤预后判断的参考指标。 Abstract:Objective To analyze the significance of PD-L1, BRAFV600E, CD68 protein expressions and tumor infiltrating lymphocytes (TIL) in the diagnosis of malignant melanoma. Methods High-throughput tissue microarray technology and immunohistochemical methods were used to detect the expressions of PD-L1, BRAFV600E and CD68 in 60 primary malignant melanoma tissues. The relationship between PD-L1, BRAFV600E, CD68 expressions, TIL and the clinicopathological characteristics and prognosis of patients was analyzed. Results (1) There was a statistically significant difference between CD68 expression in malignant melanoma tissue and tumor T stage (P = 0.018), but no statistical difference between tumor size, tumor invasion depth, lymph node metastasis and ulceration (P > 0.05). (2) There was no significant difference between PD-L1, BRAFV600E, TIL and tumor T stage, tumor size, tumor invasion depth, lymph node metastasis and ulceration (P > 0.05). (3) The mutation rate of BRAFV600E in cutaneous melanoma was about 36.67% (22/60). The mutation rate of BRAFV600E in cutaneous acral melanoma was about 68.18%. (15/22). The mutation rate of BRAFV600E in mucosal melanoma was about 23.33% (14/60). (4) Cox regression analysis showed that lymph node metastasis was the prognostic factor of malignant melanoma patients. Conclusion (1) The expression of CD68 protein may play a role in determining the prognosis of patients. (2) BRAFV600E immunohistochemical detection is recommended for melanoma in the skin. (3) The presence of lymph node metastasis in patients can be used as a reference index for the prognosis of malignant melanoma. -
Key words:
- Malignant Melanoma /
- PD-L1 /
- BRAFV600E /
- CD68 /
- TIL /
- Immunohistochemistry
-
据Rebecca等[1]报告恶性黑色素瘤(malignant melanoma,MM)新发病率持续攀升,发病人数每年以3%~5%的速度增长。中国虽属于恶黑低发地区,但发病率也在不断上升,每年新发恶黑患者超过8 000,约百万分之八,而在我国,恶黑患者的5 a生存率仅为65%。
由于早期病变不明显,造成多数患者就诊时已错失手术最佳时机,部分患者甚至已发生局部组织侵袭或转移,晚期或手术无法切除的MM患者生存率低。鉴于晚期MM的5 a生存率低,缺乏较为有效的治疗方法,故分析MM的发生发展机制、了解有效的早期诊断和预后评价指标,以帮助患者选择有效的诊断和治疗方法、延长MM患者生存时间,具有较重要的临床意义。
本文在高通量组织芯片技术基础上利用免疫组化方法观察程序性死亡配体-1(programmed death ligand-1,PD-L1)、BRAFV600E、CD68在MM组织中的表达情况,分析其与患者病理临床特征及在预后评估中的价值,同时光镜下观察肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)百分比,分析其与临床病理各参数的关系,希望从中筛选出影响预后的因素,为临床医生正确估计患者的预后以及延长患者生存时间提供一定的依据。
1. 资料与方法
1.1 一般资料
1.1.1 样本来源
收集中国医学科学院肿瘤医院病理科2007年1月至2011年12月期间进行手术切除的60例原发性MM组织样本(18例有淋巴结转移,42例无淋巴结转移,术前均未进行放化疗)。所有病例的病理切片均由两位病理学专家复阅,按照第七版AJCC恶性黑色素瘤组织学标准[2]进行分期,诊断意见统一。
所有患者以临床病例查询、电话及回院复查的方式进行随访,随访日期自病理报告确诊日期算起,至2022年7月,并严格记录随访情况。共随访到35例恶性黑色素瘤患者,失访25例;随访结局定义为死亡。
1.1.2 主要试剂
鼠抗人单克隆抗体PD-L1购自美国R&D,鼠抗人单克隆抗体BRAFV600E(VE1)和通用型二抗-HRP购自美国罗氏公司,抗体稀释液、过氧化物酶封闭液和Tris-EDTA缓冲液购自美国Dako公司,鼠抗人单克隆抗体浓缩型CD68和DAB显色液购自福州迈新生物技术开发有限公司,0.01M磷酸盐缓冲液、0.01M柠檬酸盐缓冲液等购自中杉金桥。
1.2 研究方法
1.2.1 组织芯片构建
光镜下选择切片上无退变、坏死以及不同分化程度的肿瘤区域进行打孔靶位的定位标记,每个病例在受体蜡块上设计2个靶位,60例样本设计成4块受体蜡块。
1.2.2 免疫组化染色
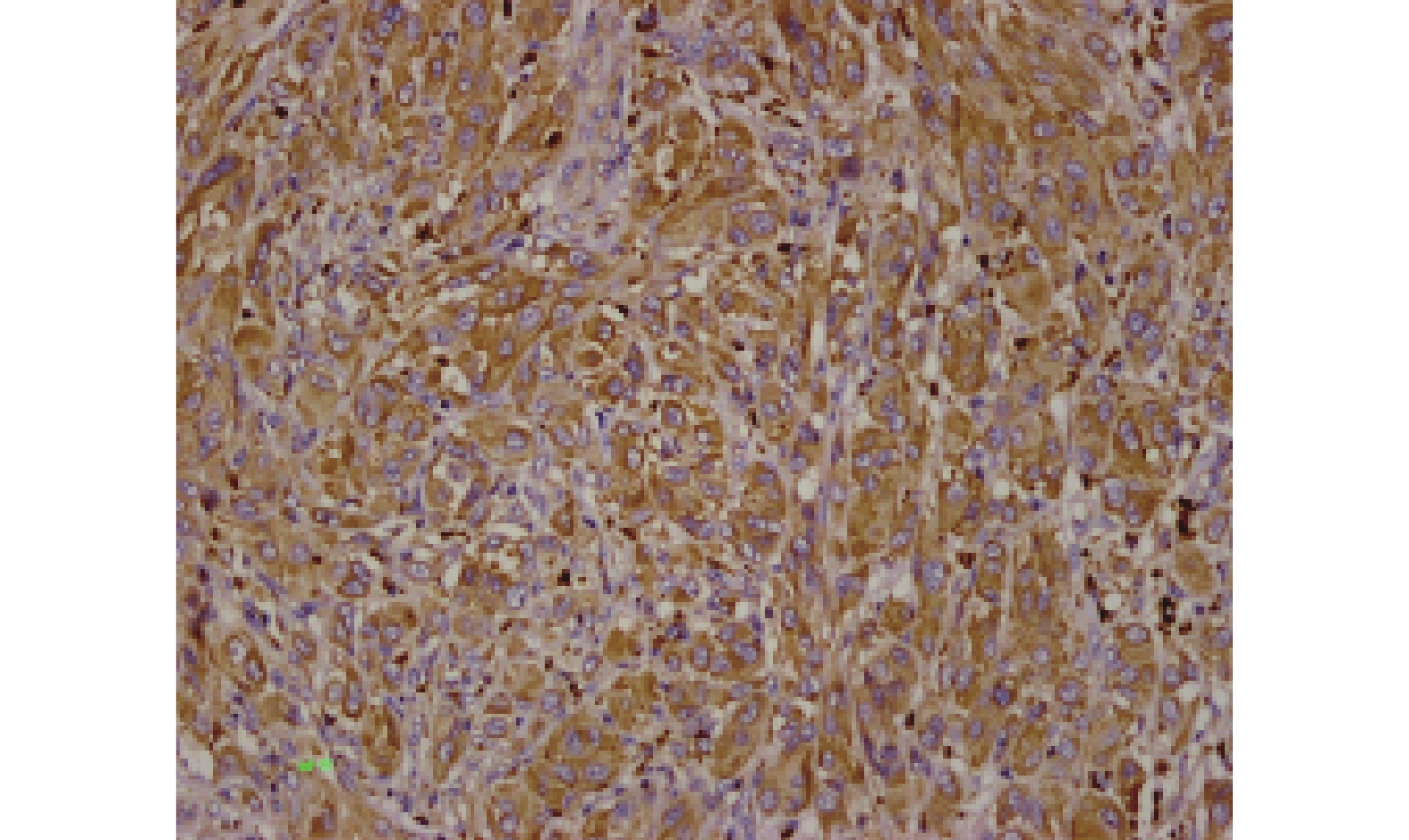
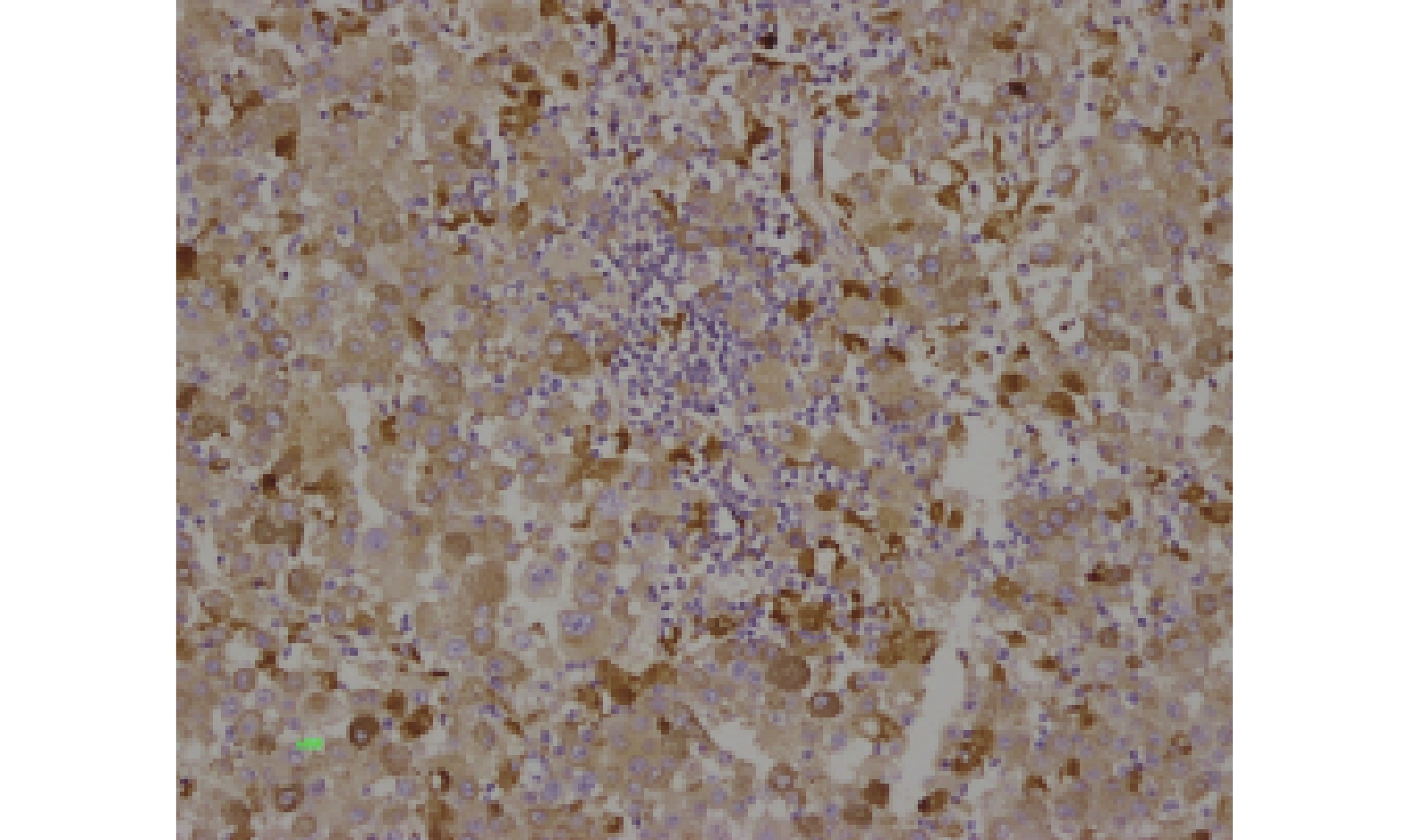
免疫组化染色步骤按试剂盒说明进行。PD-L1蛋白的阳性着色定位于胞膜/胞质,BRAFV600E阳性着色主要定位于胞质,呈淡黄色~棕黄色的细/粗颗粒。采用半定量评价标准[3]:以棕黄色颗粒清晰着色于胞膜/胞质为阳性,根据阳性细胞数百分比计分:阳性细胞≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,> 75%为4分;根据细胞染色强度计分:无着色为0分,淡黄色为1分,黄色为2分,棕黄色为3分。将两项积分相乘形成最终的评级标准:0分为阴性(-),1~4分为弱阳性(+),5~8分为阳性(++),9~12分为强阳性(+++)。
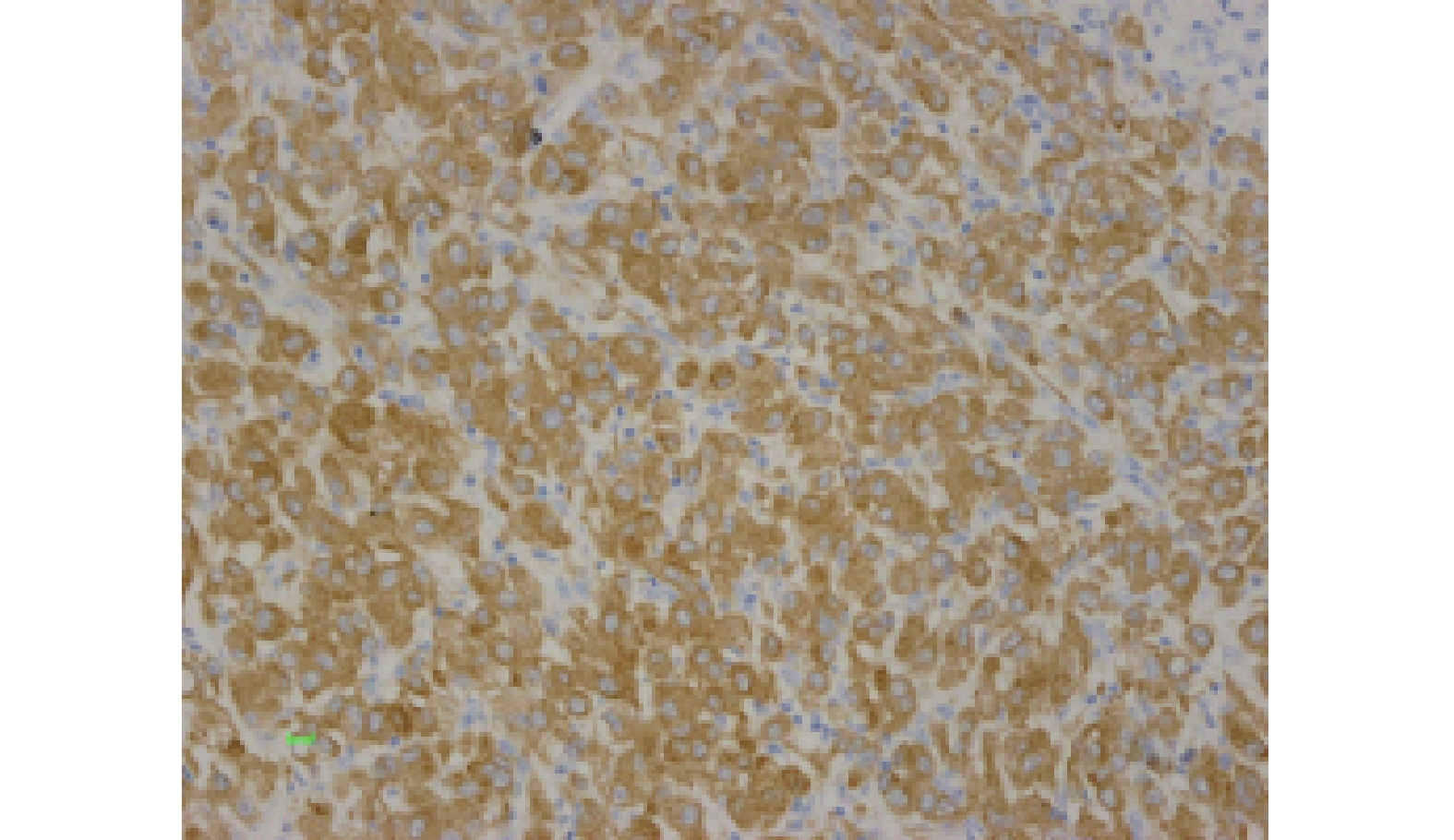
CD68蛋白表达定位于胞质。在高倍视野下选择染色均匀的区域,计数5个视野,计算阳性细胞占细胞总数的百分比[4]:未着色为0分,≤25%为1分,26%~50%为2分,> 50%为3分。着色强度判定:无着色为0分,浅棕色为1分,棕色为2分,深棕色为3分。上述2项相加为最终判定标准,阴性: < 2分;阳性:≥2分。
1.2.3 TIL百分比统计
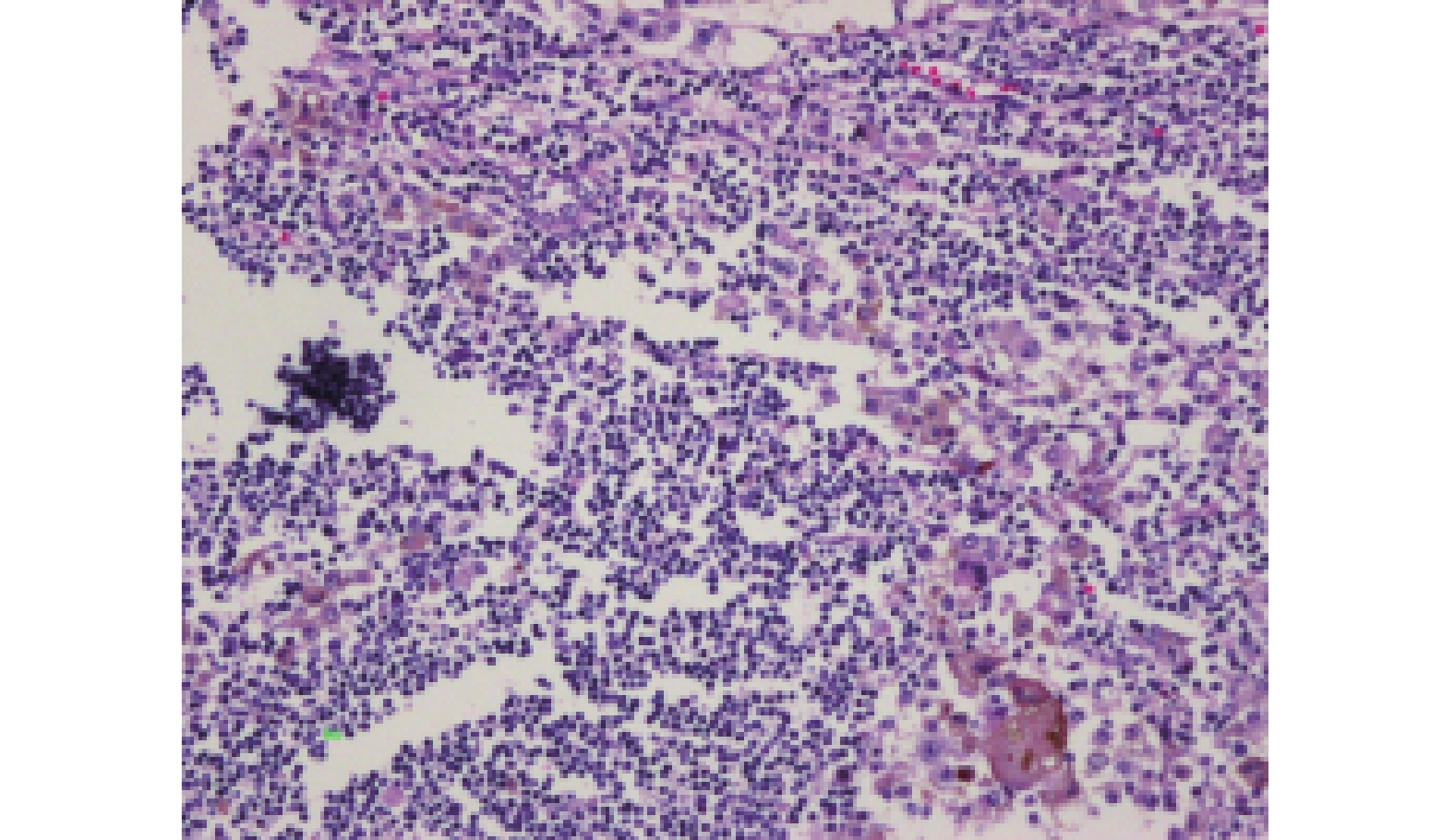
高倍镜下TIL≥50个淋巴细胞/100肿瘤细胞,为大量淋巴细胞浸润;TIL < 50个淋巴细胞/100肿瘤细胞,为小量淋巴细胞浸润。
1.3 统计学处理
所得数据应用SPSS21. 0统计软件包,各蛋白表达和TIL与临床分期、淋巴结转移和溃疡形成的关系采用等级相关分析,各蛋白表达和TIL与肿瘤大小和肿瘤浸润深度的关系采用秩和检验中的Mann-Whitney检验,检验水准α = 0.05,P < 0.05为差异有统计学意义;生存分析使用Cox回归模型。
2. 结果
2.1 病例资料
60例原发性恶性黑色素瘤患者男31例,女29例;年龄19岁~80岁,中位年龄56岁,发病高峰年龄50~65岁,≤50岁19例,> 50岁41例。18例伴淋巴结转移,转移的淋巴结数目不等;就诊时病变部位出现溃疡/和坏死者26例;皮肤的恶性黑色素瘤以肢端型黑色素瘤最多见(22/32例),躯干7例,其它部位3例;黏膜的恶性黑色素瘤共28例(消化道10例,头颈部10例,其它部位8例);肿瘤浸润深度≤2恶性黑色素瘤者12例,> 2并≤4恶性黑色素瘤者8例,浸润深度> 4恶性黑色素瘤者40例;T分期T1期30例,T2期6例,T3期4例,T4期20例;Clark’s分期Ⅰ期24例,Ⅱ期19例,Ⅲ期16例,Ⅳ期1例。
2.2 PD-L1、BRAFV600E、CD68蛋白和TIL在恶性黑色素瘤中的表达
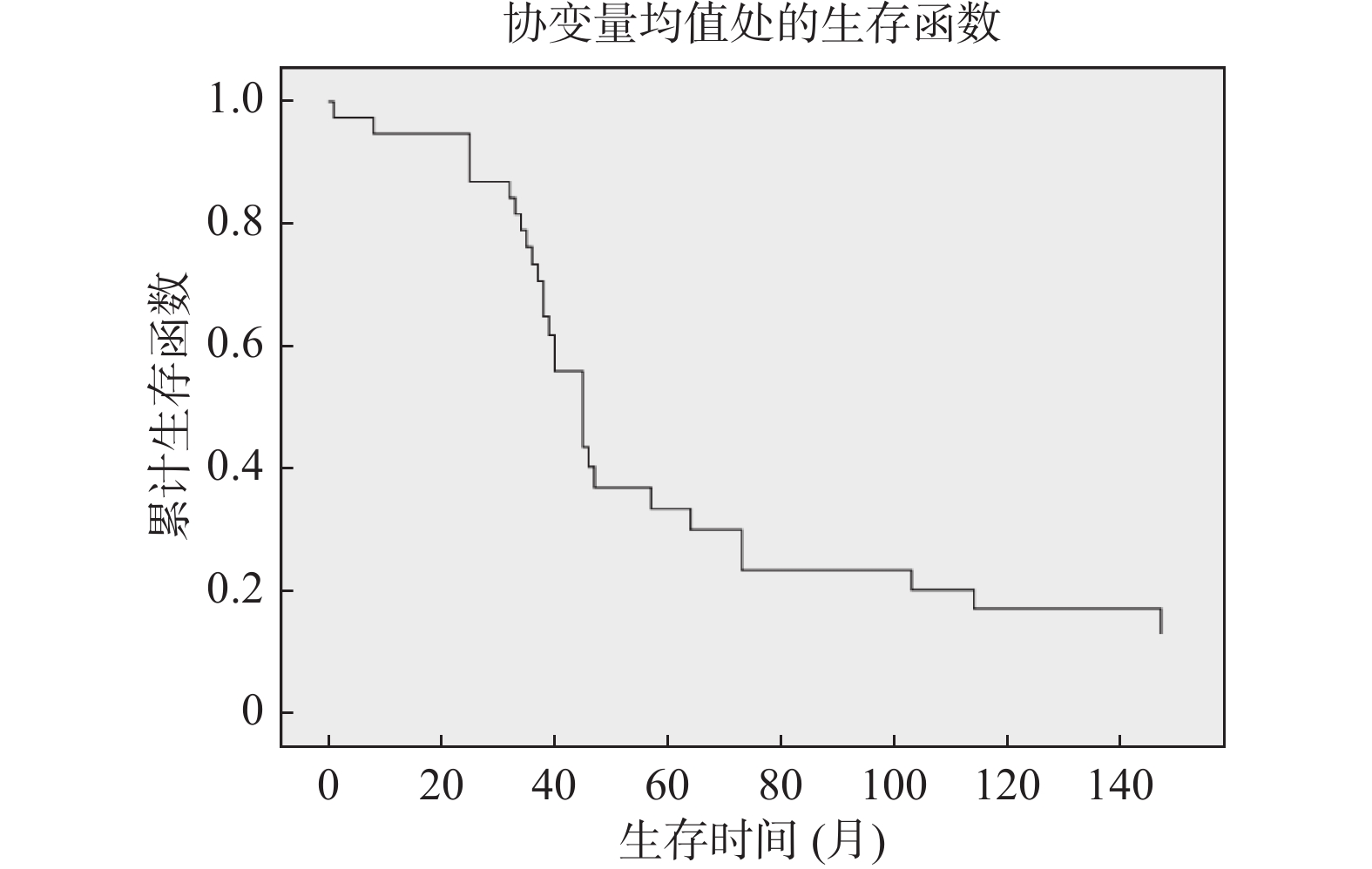
PD-L1、BRAFV600E和CD68免疫组化结果如图1~3。TIL情况如图4~5。
PD-L1、BRAFV600E和CD68蛋白在原发性恶性黑色素瘤中阳性表达率分别为43.33%(26/60)、60%(36/60)和6.7%(16/60)。
2.3 生存分析
纳入生存分析的病例数共35例,生存6例,死亡29例。Cox回归分析中可用案例29(占比82.9%),删失案例6(占比17.1%);删除案例中,带有缺失值的案例、带有负时间的案例、层中最早事件之前删失的案例均为0例。
将患者生存时间的影响因素采用Cox回归分析,协变量为患者性别、年龄、临床分期、肿瘤大小、肿瘤浸润深度、转移与否、溃疡形成与否、PD-L1、BRAF、CD68表达和TIL多少,采用向前法进行变量筛选,结果显示转移是影响恶性黑色素瘤患者预后的因素。出现转移,则患者死亡风险增大,见表1、图6。
表 1 多因素 COX比例风险回归模型Table 1. Multivariate COX proportional hazards regression model影响因素 β SE Wald P RR 95%CI 转移 0.926 0.451 4.225 0.040 2.524 1.044~6.105 3. 讨论
3.1 PD-L1蛋白与肿瘤
免疫反应中一个极其重要的协同刺激分子是B7家族[5],而PD-L1(或称B7-H1)又是B7家族中的一个重要成员,也是肿瘤微环境中的重要成员之一,为PD-1的相应的配体[6],其表达于T、B淋巴细胞、树突状细胞(DC)、内皮细胞、胎盘、心脏、肝脏等。PD-1/PD-L1对T细胞、DC、NK细胞及TIL均具有不同的调控作用[7]。PD-L1蛋白在肺癌、MM等中均有表达,且通过高表达的PD-L1与PD-1结合从而达到抑制机体抗肿瘤免疫反应的目的[8-10]。有文献认为PD-L1是黑色素瘤患者总生存期和无进展生存期的独立预后因素[11],有的却认为与总生存期无关[12]。这表明PD-L1蛋白表达与总生存期、无进展疾病期的关系还需更进一步的实验证实。
PD-L1/PD-1通路在诱导效应T细胞凋亡、抑制T细胞活化、抑制机体抗肿瘤免疫反应和肿瘤免疫逃逸过程中发挥重要作用[13],PD-L1也表达于部分TIL表面,通过结合其他TIL表面的PD-1发挥作用[14]。因此,PD-L1/PD-1通路成为引起研究者研发新一代药物的靶点。除MM外,结直肠癌等都有报道PD-L1蛋白表达与临床病理各参数的相关性[15],Cathy A Pinto等[16]的研究认为晚期黑色素瘤患者的抗PD -1治疗进展不理想,这突出了进一步研究开发新药物和优化治疗策略的必要性。笔者的研究显示PD-L1高表达的患者见于较晚的T分期,这也许是因为PD-L1/PD-1通路激活抑制了免疫反应所引起。因此,PD-L1/PD-1信号通路激活的被抑制,可能是肿瘤免疫治疗的有效方法,有望成为恶性黑色素瘤免疫治疗的新手段,但PD-L1是否可以成为预后指标还有待更进一步的研究。
3.2 BRAFV600E蛋白与肿瘤
BRAF是丝氨酸/苏氨酸蛋白酶,RAF激酶家族的3个主要成员之一,该蛋白由3个保守结构域组成,可激活MAPK信号通路。BRAF的突变类型有V600E、V600K、V600R、V600D等,但MM常见的突变是BRAFV600E,即BRAF蛋白第600位的缬氨酸被谷氨酸取代,导致BRAF激酶活性显著提高,从而激活MAPK信号通路,使黑素细胞转化成黑素瘤细胞[17]。非小细胞肺癌BRAF突变率约占3%,突变类型中V600E型占一半左右,这和MM不同[18]。Feller等[19]研究发现免疫组化是检测BRAFV600E突变的一种可靠、高度特异性的方法,能作为临床实践中筛选BRAFV600E突变的工具。本实验中肢端型MM突变率约68.2%,故对于皮肤部位的MM笔者建议行BRAFV600E突变检测。
3.3 淋巴细胞浸润与肿瘤
TIL是一种异质性的淋巴细胞群体,以T细胞为主,存在于肿瘤间质内,是机体对肿瘤的抵抗现象[20]。TIL中T细胞以CD4+、CD8+为主。在光镜下观察到,部分肿瘤组织内可见到大量淋巴细胞浸润,且和肿瘤浸润深度、淋巴结转移等有关。
随着肿瘤免疫治疗的研究,最近几年,Rosenberg等[21]通过回输前临床干预使TIL回输治疗MM的有效率高达70%。
本研究发现大多数病例的病理切片中只能见到少量或缺乏TIL,笔者认为大多数恶性黑色素瘤患者对肿瘤缺乏免疫反应。
3.4 CD68与肿瘤
肿瘤微环境包括了巨噬细胞,有研究发现实体瘤中有大量的肿瘤相关巨噬细胞(TAM)浸润,与肿瘤的发生、发展关系密切[22]。根据巨噬细胞不同的功能特性,通常分2型:(1)经典激活的巨噬细胞(M1型),主要能分泌促炎因子、趋化因子等参与炎症反应、清除病原体,参与Th1型免疫应答发挥抑制肿瘤的作用;(2)替代活化的巨噬细胞(M2型),有较弱的抗原提呈能力,从而抑制了T细胞的增殖,促进肿瘤的发生、发展及转移。相关研究资料显示,肿瘤组织周围若有明显的巨噬细胞浸润,发生肿瘤扩散转移的几率低,预后也较好;反之亦然[23]。肿瘤间质中CD68阳性巨噬细胞是降低乳腺癌风险的独立预后因素,而CD68蛋白在MM的表达研究很少,且结果不尽相同。
CD68是巨噬细胞最可靠的标志物。本实验结果显示在恶性黑色素瘤中CD68蛋白阳性表达与肿瘤T分期间存在差异,提示巨噬细胞在肿瘤的发生、发展中起着一定的潜在作用。由于CD68蛋白既标记M1型也标记M2型,故CD68蛋白在判定肿瘤浸润巨噬细胞作用方面还存在一定的局限性。
-
表 1 多因素 COX比例风险回归模型
Table 1. Multivariate COX proportional hazards regression model
影响因素 β SE Wald P RR 95%CI 转移 0.926 0.451 4.225 0.040 2.524 1.044~6.105 -
[1] Christopher P Wild, Elisabete Weiderpass, Bernard W Stewart. World cancer report-cancer research for cancer prevention[M]. Lyon: World Health Organization, 2020: 374-381. [2] Edge S B, Byrd D R, Compton C C, et al. AJCC cancer staging manual (7th ed) [M]. New York: Springer International Publishing, 2010: 325-344. [3] Liu X,Zheng S P,Peng Y,et al. Construction of the prediction model for locally advanced rectal cancer following neoadjuvant chemoradiotherapy based on pretreatment tumor-infiltrating macrophage-associated biomarkers[J]. OncoTargets and Therapy,2021,14:2599-2610. [4] 刘伟,安杰,侯会池,等. H l F-1 0c及CD68在胃癌组织中的表达及其临床意义[J]. 中国现代普通外科进展,2014,17(7):516-519. [5] Atefi M,Avramis E,Lassen A,et al. Effects of MAPK and PI3K pathways on PD-L1 expression in melanoma[J]. Clinical Cancer Research,2014,20(13):3446-3457. doi: 10.1158/1078-0432.CCR-13-2797 [6] Kim J W, Eder J P. Prospects for targeting PD-1 and PD-L1 in various tumor types [J]. Oncology, 2014, 28 (Suppl 3): 15-28. [7] Park S J,Namkoong H,Doh J,et al. Negative role of inducible PD-1 on survival of activated dendritic cells[J]. J Leukoc Biol,2014,95(4):621-629. doi: 10.1189/jlb.0813443 [8] Merelli B,Massi D,Cattaneo L,et al. Targeting the PD1/PD-L1 axis in melanoma:Biological rationale,clinical challenges and opportunities[J]. Critical Reviews in Oncology/Hematology,2014,89(1):140-165. doi: 10.1016/j.critrevonc.2013.08.002 [9] 林喜娜,李广秋,何萍,等. 非小细胞肺癌中PD-L1表达及其与肺癌相关驱动基因的关系[J]. 临床与实验病理学杂志,2019,35(7):767-771. doi: 10.13315/j.cnki.cjcep.2019.07.003 [10] 黄育刚,王 莉,汤显斌. PD-1/PD-L1免疫抑制剂在肺癌临床治疗和病理检测中的研究进展[J]. 临床与实验病理学杂志,2020,36(6):688-692. [11] Massi D,Brusa D,Merelli B,et al. PD-L1 marks a subset of melanomas with a shorter overall survival and distinct genetic and morphological characteristics[J]. Annals of Oncology,2014,25(12):2433-2442. doi: 10.1093/annonc/mdu452 [12] Gadiot J,Hooijkaas A I,Kaiser A D M,et al. Overall survival and PD-L1 expression in metastasized malignant melanoma[J]. Cancer,2011,117(10):2192-2201. doi: 10.1002/cncr.25747 [13] de Souza Malaspina T S,Gasparoto T H,Costa M R S N,et al. Enhanced programmed death 1 (PD-1) and PD-1 ligand (PD-L1) expression in patients with actinic cheilitis and oral squamous cell carcinoma[J]. Cancer Immunology,Immunotherapy,2011,60(7):965-974. [14] Muenst S,Schaerli A R,Gao F,et al. Expression of programmed death ligand 1 (PD-L1) is associated with poor prognosis in human breast cancer[J]. Breast Cancer Research and Treatment,2014,146(1):15-24. doi: 10.1007/s10549-014-2988-5 [15] 冯昌银,郑巧灵,黄建平. 等 结直肠癌肿瘤原发灶与肝脏转移灶中PD-L1表达的差异性[J]. 临床与实验病理学杂志,2018,34(12):1340-1343. [16] Pinto C A,Liu Xinyue,Li Xiaoyun,et al. Treatment and overall survival among anti-PD-1-exposed advanced melanoma patients with evidence of disease progression[J]. Immunotherapy,2022,14(4):201-214. [17] Flaherty K T,Puzanov I,Kim K B,et al. Inhibition of mutated,activated BRAF in metastatic melanoma[J]. New England Journal of Medicine,2010,363(9):809-819. doi: 10.1056/NEJMoa1002011 [18] 黄志敏,吴一龙. 非小细胞肺癌的BRAF基因突变及其临床意义[J]. 中国肺癌杂志,2012,15(3):183-186. doi: 10.3779/j.issn.1009-3419.2012.03.09 [19] Feller J K,Yang S,Mahalingam M. Immunohistochemistry with a mutation- specific monoclonal antibody as a screening tool for the BRAFV600E mutational status in primary cutaneous malignant melanoma[J]. Mod Pathol,2013,26(3):414-420. doi: 10.1038/modpathol.2012.168 [20] Halapi E. Oligoclonal T cells in human cancer[J]. Med Oncol,1998,15(4):203-211. doi: 10.1007/BF02787202 [21] Rosenberg S A,Restifo N P,Yang J C,et al. Adoptive cell transfer:A clinical path to effective cancer immunotherapy[J]. Nature Reviews Cancer,2008,8(4):299-308. doi: 10.1038/nrc2355 [22] Wang R,Zhang J,Chen S,et al. Tumor-associated macrophages provide a suitable microenvironment for non-small lung cancer invasion and progression[J]. Lung Cancer,2011,74(2):188-196. doi: 10.1016/j.lungcan.2011.04.009 [23] Leek R D,Lewis C E,Whitehouse R,et al. Association of macrophage infiltration with angiogenesis and prognosis in invasive breast carcinoma[J]. Cancer Res,1996,56(20):4625-4629. -






 下载:
下载:

 下载:
下载:

