Application Value of CBCT Imaging in Salivary Adenography
-
摘要:
目的 探讨CBCT成像技术在涎腺造影诊断涎腺疾病中的应用价值。 方法 对51例患者行涎腺造影术后,进行传统曲面体层摄影(traditional pantomography,TPAN)和CBCT扫描;利用CBCT容积数据重建多平面图像(multi-planar reconstructed ,MPR)、合成曲断面图像(synthetic pantomography,SPAN)及3D图像,并与TPAN影像对比。 结果 51例涎腺造影后的CBCT- 3D图像,能360°立体展示涎腺全貌,对涎腺导管扩张、狭窄及末梢导管“点状扩张”等病变特征的显示优势明显;其MPR三维图像对涎腺占位性病变(如阴性涎石、肿瘤)形成的充盈缺损显示更为清晰和准确。 结论 CBCT成像在涎腺造影检查中能以多种重建技术(MPR、SPAN、3D)立体展示涎腺导管系统及腺体形态改变,更有利于涎腺疾病诊断,加之体位舒适、操作简便,辐射剂量低等优点,在涎腺疾病诊断中具有独特的应用价值。 Abstract:Objective To explore the application value of CBCT imaging in the diagnosis of salivary gland disease by sialography. Methods After sialography,51 patients performed traditional pantomography and CBCT scans, Multi-planar images(MPR), synthetic pantographs(SPAN) and 3D images were reconstructed from CBCT volume data and compared with TPAN. Results 51 salivary glands after sialography can display the full picture of salivary glands in 360 degrees on CBCT 3D images, and the lesion characteristics such as duct dilation, stenosis and distal catheter “punctate dilation” were obviously better than those of TPAN. Its MPR image showed the filling defect formed by salivary gland space-occupying lesions such as negative--“punctate dilation” was obviously better than that of TPAN. Its MPR image showed the filling defect formed by salivary gland space-occupying lesions such as negative sialolith and tumors more clearly and accurately. Conclusion CBCT imaging can stereoscopically display the ductal system and glandular morphological changes of the salivary glands with a variety of reconstruction techniques (MPR, SPAN and 3D) in sialography, which is more conducive to the diagnosis of salivary gland diseases, In addition, the advantages of a comfortable position, simple operation, low radiation dose, and so on, it has unique application value in the diagnosis of salivary gland diseases. -
Key words:
- Sialography /
- CBCT /
- MPR /
- 3D Reconstruction
-
口腔颌面锥形束CT(cone beam computed tomography,CBCT)自上世纪90年代末问世以来,以其辐射剂量低、空间分辨率高、能快速获取三维及3D图像等优点被广泛应用于口腔颌面部疾病诊断[1-3],但密度分辨率低,对软组织成像能力不足的缺点,限制了其对涎腺等软组织疾病的诊断应用[4]。本研究对51例涎腺疾病患者进行常规造影后再行CBCT扫描,以探寻CBCT成像在涎腺造影诊断涎腺疾病中的应用价值。
1. 材料与方法
1.1 材料
碘化油造影剂为复方制剂,组方为植物油与碘结合的有机碘化合物,浓度为37.0%~41.0%;由山东烟台鲁银药业有限公司所生产(国药H 37022398)。
1.2 设备
锥形束CT(CBCT)设备为昆明医科大学附属口腔医院自意大利New Tew公司引进的New Tom VGi机型,主要技术参数如下:管电流:10 mA 管电压:110 kV;曝光时间:3.6 s;焦点大小:0.3 mm;扫描视野(FOV):15×15;扫描层厚:1 mm;处理软件:设备自带的NNT操作软件;拍摄传统曲面体层片(traditional pantomography,TPAN)使用的曲面断层摄影机为昆明医科大学附属口腔医院自德国西诺德公司引进的ORTHPHOS XG机型,拍摄参数:7 mA,80 kV,14 s 。
1.3 方法
1.3.1 病例资料及图像采集技术
51例涎腺患者(腮腺46例,颌下腺5例)为回顾性收集昆明医科大学附属口腔医院影像科2013年6月至2022年6月间造影成功(造影剂充盈良好)且临床资料和影像资料完整的病例。全部患者经临床检查排除造影禁忌症后,均签署了“涎腺造影知情同意书”。本研究通过云南省口腔医院医学伦理审核委员会审核。造影采用6-7号钝针头自腮腺或颌下腺导管口注入造影剂,儿童约0.8~1 mL,成人约1.5~2 mL,消毒棉球堵住导管口防止造影剂外溢后立即拍摄传统曲面体层摄影片(traditional pantomography,TPAN)再行CBCT扫描获取多平面图像(multi-planar reconstructed,MPR)、合成曲断面图像(synthetic pantomography,SPAN)及三维立体重建图像(3D)。根据病情诊断需要,部分患者30 min后再摄TPAN(分泌功能片)。采用图像后处理技术,包括利用裁剪功能剪除CBCT-3D图像中对涎腺产生重叠影响的结构以及对图像进行任意角度的旋转或翻转,还可任意赋予腺体不同色彩及调节图像灰度和对比度等,最大限度显示病变特征。
1.3.2 涎腺造影影像质量判定标准[11](造影剂充盈良好是前提条件)
优:导管或腺泡病变显示良好,图像清晰,无重叠及伪影,用“+++”表示。良:导管或腺泡病变显示欠佳,图像欠清晰,有一定重叠或伪影,用“++”表示。一般:导管或腺泡病变有一定显示但不完整或不确切,用“+”表示。差:导管或腺泡病变不能显示,用“-”表示。
根据以上质量判定标准,由2名具有一定影像诊断经验的影像科医师分别对所有CBCT和TPAN造影图像对涎腺形态、导管系统扩张及导管内和腺泡内占位病变显示的优劣情况进行评定,当对同一图像的评定结果出现差异时,由具有高级职称的影像科医师进行判定。
2. 结果
51例涎腺患者,男性28例,女性23例,最大年龄58岁,最小者6岁。腮腺46例共52个腺体,颌下腺 5例共5个腺体。全部病例根据影像特点结合临床表现分别诊断为慢性阻塞性腮腺炎29例,颌下腺炎2例;慢性复发性腮腺炎6例;导管阴性涎石3例;舍格伦综合征3例;腮腺良性肿瘤1例;腮腺导管内瘘2例;腮腺良性肥大1例及正常腮腺4例。
分析57个涎腺(腮腺52个,颌下腺5个)的CBCT图像(MPR、SPAN、3D)及TPAN图像,发现各种图像对腺体形态、主导管扩张、末梢导管扩张及导管内占位和腺泡内占位等病变特征的显示有明显差异(表1)。其中,CBCT-3D能立体展示完整腺体形态及导管系统的改变;MPR则不能显示完整形态;TPAN和SPAN虽能显示完整腺体形态及改变,但形态展示不够舒展,细微结构不够清晰;对导管内及腺泡内占位病变,MPR可逐层观察充盈缺损征象,其余图像则不同程度受限。
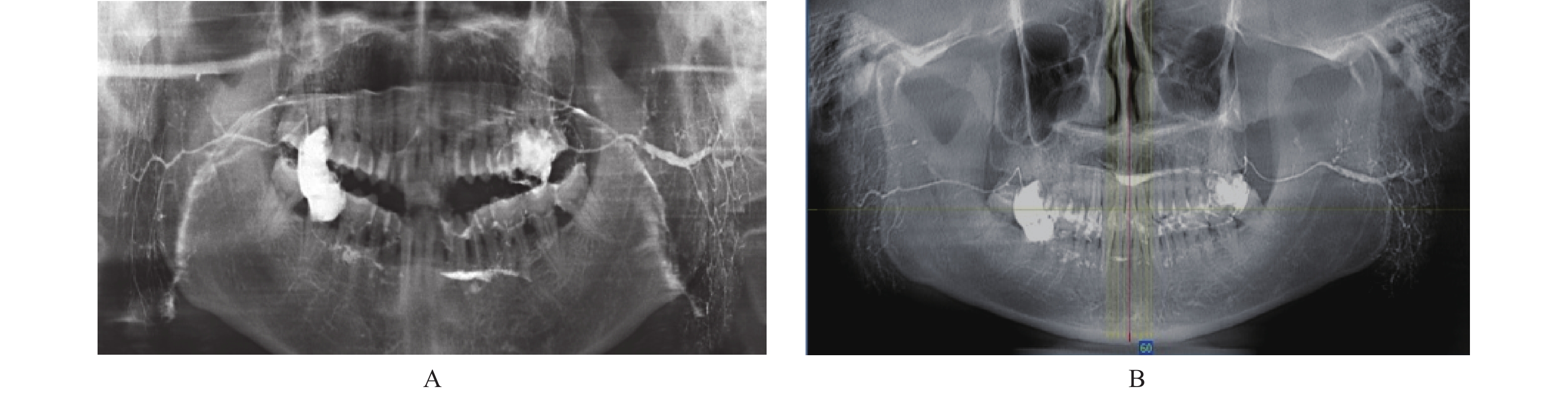
表 1 CBCT与TPAN显示涎腺造影影像的优劣情况对比Table 1. Comparison of the advantages and disadvantages of BCT and TPAN in displaying sialography images检查方法 腺体形态 主导管扩张 末梢导管点状扩张 导管内占位 腺泡内占位 TPAN ++ ++ ++ + + CBCT SPAN ++ + ++ + + MPR − + − +++ +++ 3D +++ +++ +++ ++ + 从表中可看出,对腺体形态、主导管和末梢导管扩张病变的显示,CBCT-3D优势明显。因可使用剪切功能,可将3D图像中非涎腺部分切除,获得的腺体影像几乎没有重叠,利用翻转和旋转功能,将腺体作任意角度的翻转或旋转,可立体展示导管系统的形态、直径、走行及腺实质部分的轮廓,此外还可赋于腺体不同色彩,提高了肉眼观察病变的视觉感受。对比TPAN和SPAN,二者虽也能显示完整的导管系统和腺泡形态,但因均为二维平面图像,不能剪切和翻转,导管和腺泡展示不佳,尤其TPAN影像欠清晰,左右颌骨、腺体及造影剂等均有不同程度重叠,SPAN图像相对清晰且无重叠,但因层厚较薄,不能真实显示扩张导管的改变(图1)。
本组31例慢性阻塞性涎腺炎(腮腺29例,颌下腺2例)主要病变特征是主导管和分支导管不同程度的扩张和狭窄。CBCT-3D图像多角度、立体展示了导管系统扩展、狭窄、迂曲、延长等影像特征;TPAN和SPAN也能显示导管系统的狭窄和扩张改变,但TPAN影像欠清晰,左右有重叠;SPAN虽无重叠影像,但导管系统展示欠佳(图2)。
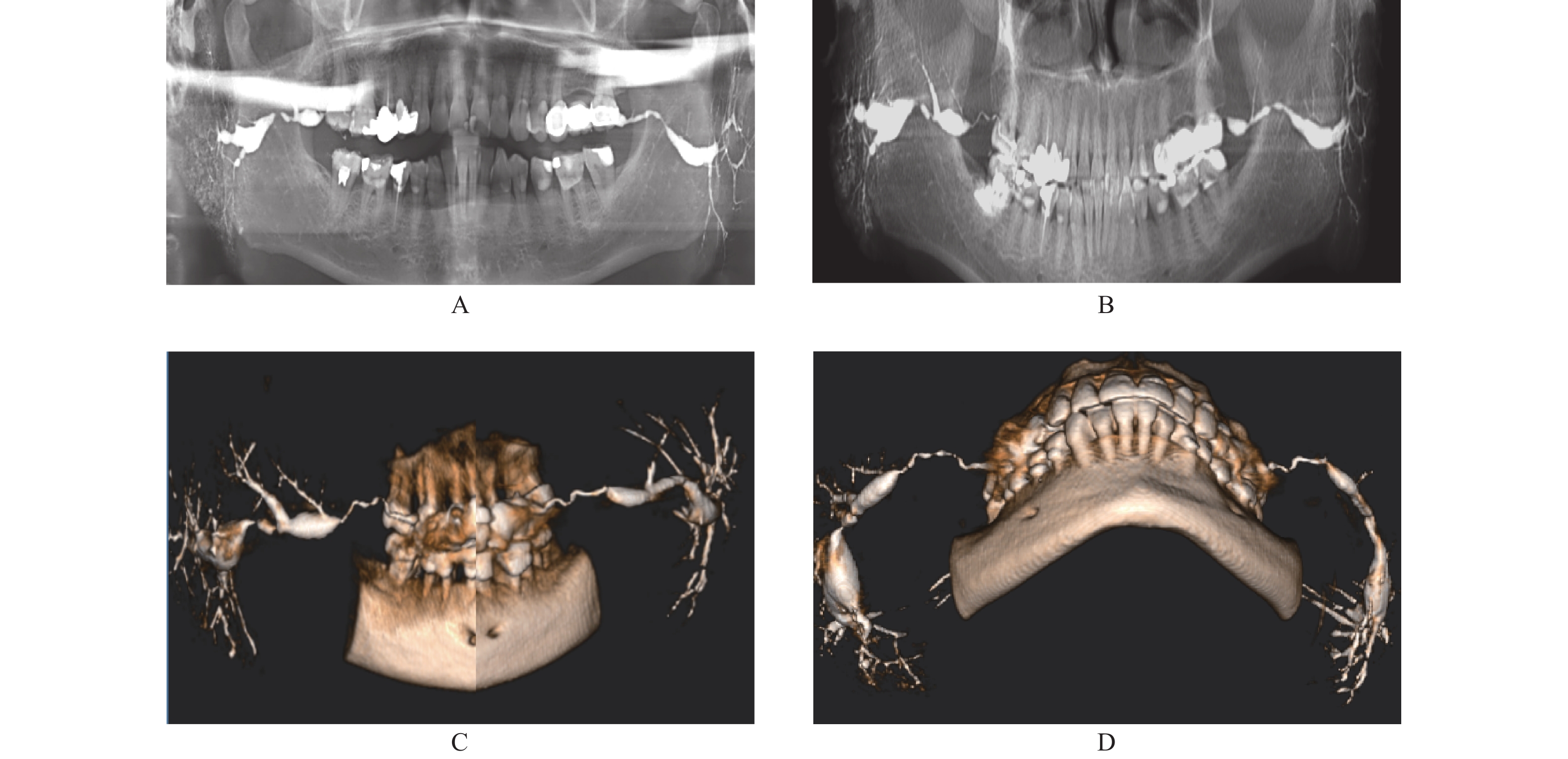
6例慢性复发性腮腺炎和3例舍格伦综合征其主要的病变特征是末梢导管发生“点状扩张”。CBCT-3D对“点扩”的显示效果特佳,TPAN 和SPAN也能显示,但TPAN重叠影像多,清晰度欠佳,SPAN虽无重叠影像,但清晰度亦欠佳(图3)
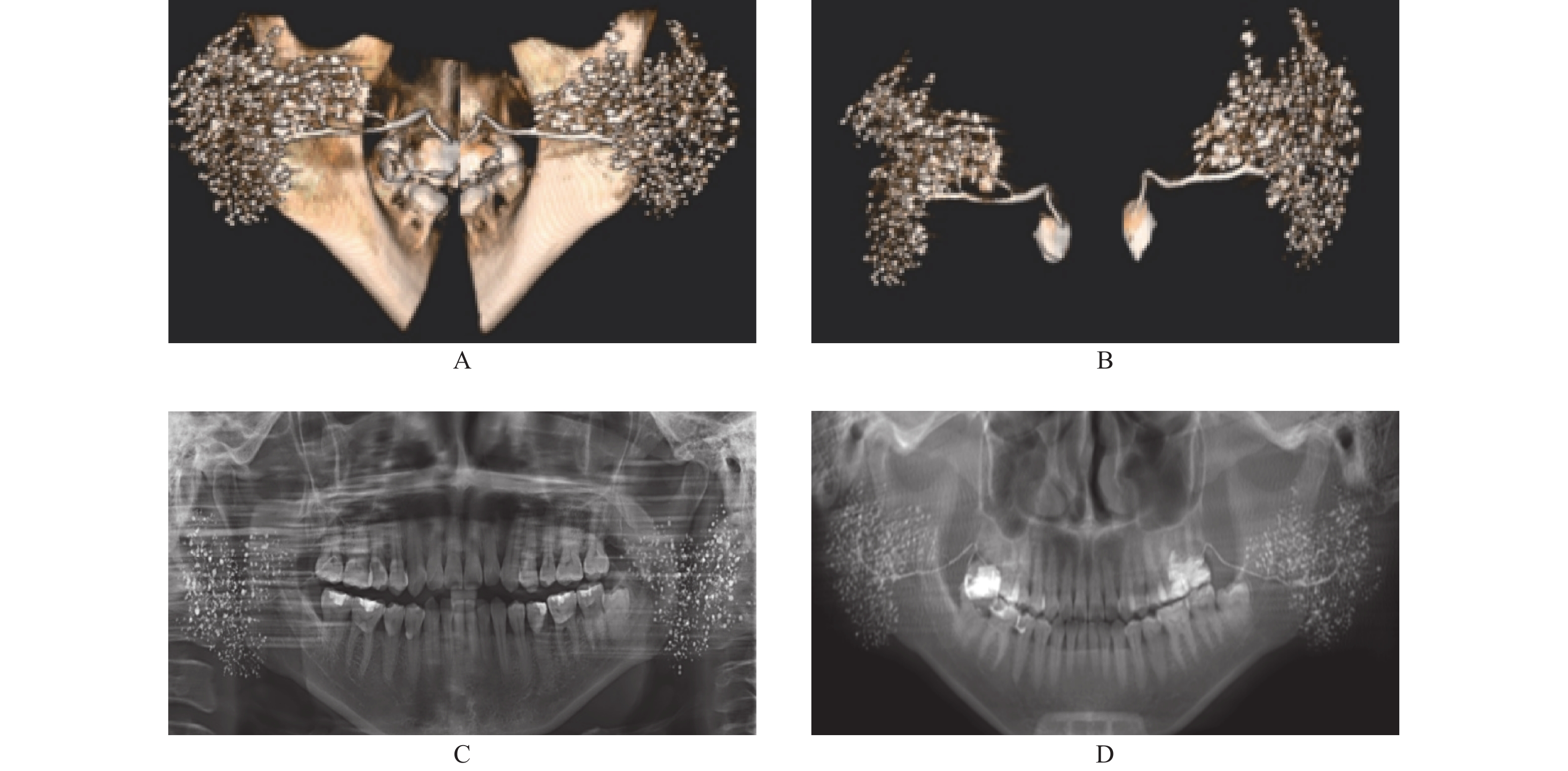
对于导管内占位病变的显示,CBCT-MPR同样优势明显,3D也有一定优势。本组3例导管内阴性涎石,MPR和3D成像均清晰显示出涎石所在位置及形成的充盈缺损影像,而TPAN则对其中一例颌下腺多发阴性小涎石未能显示(图4)。
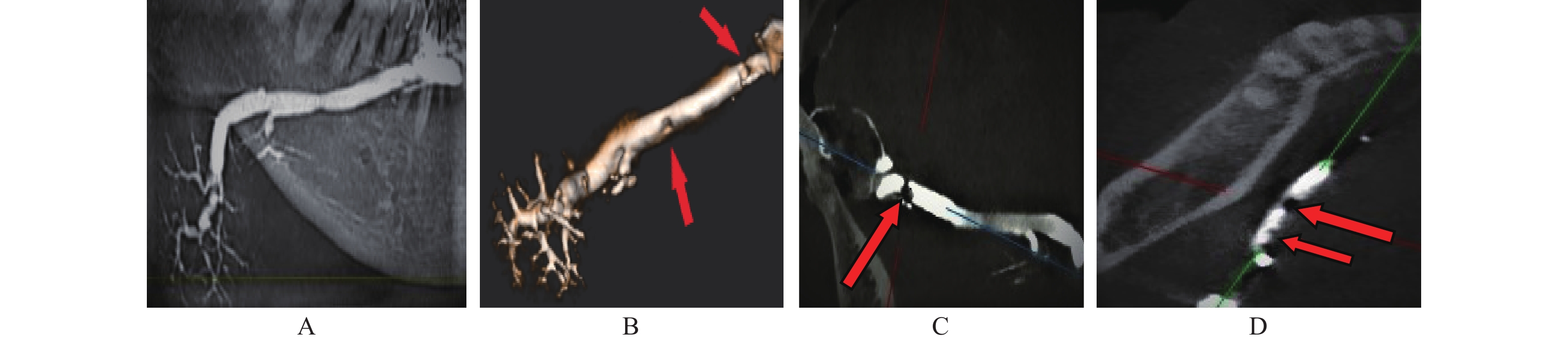
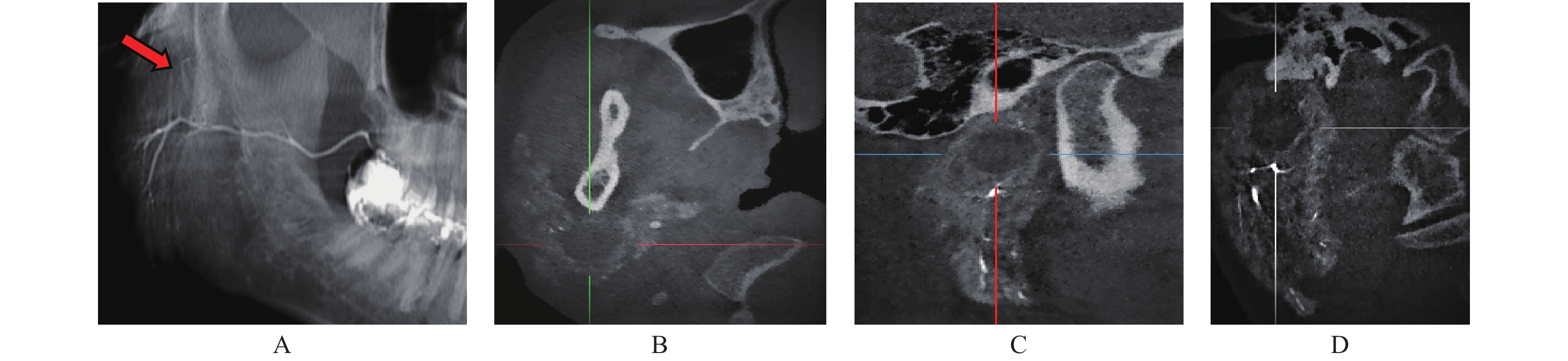
对于腺泡内占位病变的显示,CBCT-MPR优势更明显。本组1例腮腺经造影CBCT-MPR成像意外发现右腮腺深叶上部内有一1.2 cm×1.3 cm 大小的占位病变,经横断、冠状及矢状逐层观察,肿瘤部位的充盈缺损清晰显示,而TPAN则显示不明显,仅表现出局部腺泡稍稀薄(图5)。
3. 讨论
涎腺造影术(Sialography)是将阳性造影剂注入涎腺导管以增强涎腺组织密度,提高与周围组织对比度,从而有利于显示涎腺内部病变的一种检查方法,主要用于腮腺和颌下腺检查[5]。1913年Arcelin首次用铋作造影剂应用于临床[5],后因重金属不良反应停用,1926年Carlsten首次用碘化油作造影剂完成腮腺造影后一直沿用至今[5]。
传统的涎腺造影术在注入造影剂后采用拍摄腮腺造影正、侧位片和颌下腺造影侧位片获取涎腺图像[4-5];20世纪90年代有学者将曲面体层摄影应用于涎腺造影检查,并将其作为传统的检查方法之一[6-8]。但上述2种检查所得均为二维图像,无立体感,影像重叠明显;有学者用腮腺造影与X线CT相结合的方法进行腮腺肿瘤诊断,其断层影像能准确显示肿瘤大小、范围及边缘特点,能提高肿瘤诊断准确率[9-10],但存在辐射剂量大、不能显示整体的导管形态改变等不足。
锥形束CT是20世纪90年代末由意大利人Mozzo设计而成,与扇形X线束扫描,线状探测器采集一维数据成像的CT不同,它直接采用三维的锥形X线束扫描,用面状探测器采取容积数据,直接获取三维和3D图像。与CT相比,射线利用率高,平均辐射剂量仅为1.19 msv,仅为多层探测CT的1/400[ 11-12],且空间分辨率高,对牙齿、颌骨等高对比度的组织具有比CT更强的分辨力,特别有利于需多次重复影像检查的口腔颌面部疾病患者,但CBCT存在密度分辨力低,对软组织成像能力不足的缺点,限制了其对涎腺等软组织疾病诊断方面的应用[12]。
将涎腺造影与CBCT成像结合能否提高其对涎腺疾病的诊断能力?笔者多年前就开始了探索,近年来国内学者有相关报道。杜世文、孙旭、曾东林等[13-15]认为CBCT能多角度立体显示腮腺非肿瘤性病变的腺体和导管改变;于美清等[16]认为CBCT多种重建技术对腮腺肿瘤具有较大的诊断价值,应作为腮腺肿瘤有效的检查方法。
作者通过对51例,57个腺体进行造影加CBCT扫描,并将图像与TPAN对比后有以下应用体会:对于涎腺非肿瘤性病变,包括腺体先天缺失和发育不良、唾液腺结石病、唾液腺瘘、慢性阻塞性唾液腺炎、慢性复发性腮腺炎、舍格伦综合征及唾液腺良性肥大等疾病,因其病理改变主要发生在导管系统,故造影结合CBCT-3D重建能获得优于TPAN的检查效果,能360° ,多角度、多色彩立体观察导管及腺体改变;对于导管内占位病变,如阴性涎石,MPR可任意角度逐层观察能更准确显示涎石所致的充盈缺损;对于涎腺肿瘤,本组仅有的1例是在临床未知的情况下意外发现,MPR通过三维逐层滚动观察清晰显示了肿瘤所在位置及形成的充盈缺损征象。
随着影像技术的飞速发展,多普勒超声、螺旋CT及磁共振等新型影像技术在涎腺肿瘤诊断方面已逐渐取代了传统的涎腺造影术[4],在确定涎腺有无占位性病变方面B超较有优势[4];在显示涎腺肿瘤位置、范围与临近组织结构的关系,特别是对腮腺深叶肿瘤与咽旁肿瘤的鉴别及与颈鞘的关系方面,CT优势明显[4, 9-10];MRI则以无射线辐射、多参数成像、对涎腺组织分辨力明显高于CT以及流空效应等优势,更有利于涎腺肿瘤的诊断[4, 17-18]。但对于涎腺非肿瘤性疾病,认为造影仍然是目前主要的检查手段,它不仅有很好的诊断效果,对慢性炎症还有一定的治疗作用[4-5, 13-14]。
CBCT作为一种新型的影像技术,临床应用潜能还有待进一步挖掘,技术指标还需不断完善,相信不远的将来,其对涎腺等软组织成像能力不足的缺点会被攻克,但目前情况,作者建议对涎腺肿瘤,如有条件应首选增强CT或磁共振扫描,因这两项技术对于涎腺肿瘤的定位和定性诊断更为准确,与造影后再行CBCT成像相比,省去了造影操作的麻烦,检查过程显得更快捷、方便。无条件者,用造影加CBCT成像也不失为一种可选的检查方法。
总之, CBCT以其特有的成像优势加之体积小、成本低、操作简便等优点,是目前口腔颌面影像检查中最具发展潜力和应用前景的技术,近年来在国内众多的口腔医疗机构中已基本得到普及,如能将涎腺造影与CBCT成像技术相结合应用于临床,将扩大其在涎腺疾病诊断方面的应用范围,也有利于提高涎腺疾病的诊疗水平。
-
表 1 CBCT与TPAN显示涎腺造影影像的优劣情况对比
Table 1. Comparison of the advantages and disadvantages of BCT and TPAN in displaying sialography images
检查方法 腺体形态 主导管扩张 末梢导管点状扩张 导管内占位 腺泡内占位 TPAN ++ ++ ++ + + CBCT SPAN ++ + ++ + + MPR − + − +++ +++ 3D +++ +++ +++ ++ + -
[1] Mozzo P,Procacci C,Tacconi A,et al. A new volumetric CT machine for dental imaging based on the cone_beam technique:preliminary results[J]. Eer Radiol,1998(9):1558-1564. [2] William C S,Allan G F,Predag S. Clinical applications of cone beam computed tomography in dental practice[J]. J Can Dent Assoc,2006,72(1):75-78. [3] 衡士超,程勇,李波. 锥形束CT结合Simplant软件在颌面部三维测量中的初步研究[J]. 口腔医学研究,2011,27(1):60-63. [4] 张祖燕, 王虎, 马绪臣, 等. 口腔颌面医学影像诊断学[M]. 第7版. 北京人民卫生出版社, 2020: 33-34+153. [5] 邹兆菊. 涎腺疾病影像学诊断[M]. 北京: 北京医科大学、中国协和医科大学联合出版社, 1990: 7-9. [6] 吴运堂,赵燕平,吴东,等. 造影曲面体层摄影术在诊断涎腺疾病中的价值[J]. 中华口腔医学杂志,1993,28(1):12-14. [7] 杨卫东,顾云峰,孙大熙. 涎腺造影曲面体层摄影的临床应用[J]. 中华口腔医学杂志,1993,28(3):146-147. [8] 顾云峰,孙大熙,林国础. 涎腺造影曲面体层法对腮腺肿瘤的诊断价值[J]. 上海口腔医学,1995,4(3):134-135,183-184. [9] 宋大庆,靳宏星,李健民,等. 腮腺造影CT扫描的评价[J]. 医学影像杂志,2000,10(1):7-11. doi: 10.16106/j.cnki.cn14-1281/r.2000.01.002 [10] 姜晓钟,陈必胜,赵云富,等. 三维CT在涎腺造影术中的应用[J]. 临床口腔医学杂志,1994,10(4):209-211. [11] 方冬,赵堃,袁宪,等. Implagraphy牙颌面锥形束CT与多层螺旋CT的图像质量对比研究[J]. 中华老年口腔医学杂志,2008,6(4):226-229. [12] 马绪臣, 王虎, 王松灵, 等. 口腔颌面医学影像诊断学[M]. 第6版. 北京: 人民卫生出版社, 2012: 22-23. [13] 杜世文,俞创新. 锥形束CT腮腺造影技术对腮腺非肿瘤性疾病的诊断价值[J]. 中国口腔颌面外科杂志,2017,15(4):345-348. doi: 10.19438/j.cjoms.2017.04.012 [14] 孙旭,李向军,张旭东,等. 腮腺造影锥形束CT检查在慢性腮腺炎诊断中的应用[J]. 实用口腔医学杂志,2017,33(6):778-782. doi: 10.3969/j.issn.1001-3733.2017.06.014 [15] 曾东林,温亦雄,崔敏毅,等. 锥形束CT三维可视化技术在腮腺造影成像中的应用[J]. 中华口腔医学研究杂志(电子版),2013,7(3):224-227. [16] 于美清,董福生,雍平,等. 锥形束CT在腮腺肿瘤造影诊断中的应用[J]. 口腔医学研究,2013,29(9):821-824. doi: 10.13701/j.cnki.kqyxyj.2013.09.006 [17] 董金鑫,刘成业,王维丰. 3.0T磁共振在腮腺肿瘤影像诊断中价值[J]. 航空航天医学杂志,2022,33(6):657-660. [18] 文宝红,程敬亮,张会霞,等. 磁共振高清扩散加权成像鉴别腮腺良恶性上皮性肿瘤的价值[J]. 中华医学杂志,2018,98(17):1347-1351. -






 下载:
下载:
 下载:
下载:

