The Effect of 1800 MHz Electromagnetic Radiation on Learning and Cognitive Functions in 3xTg-AD Mice
-
摘要:
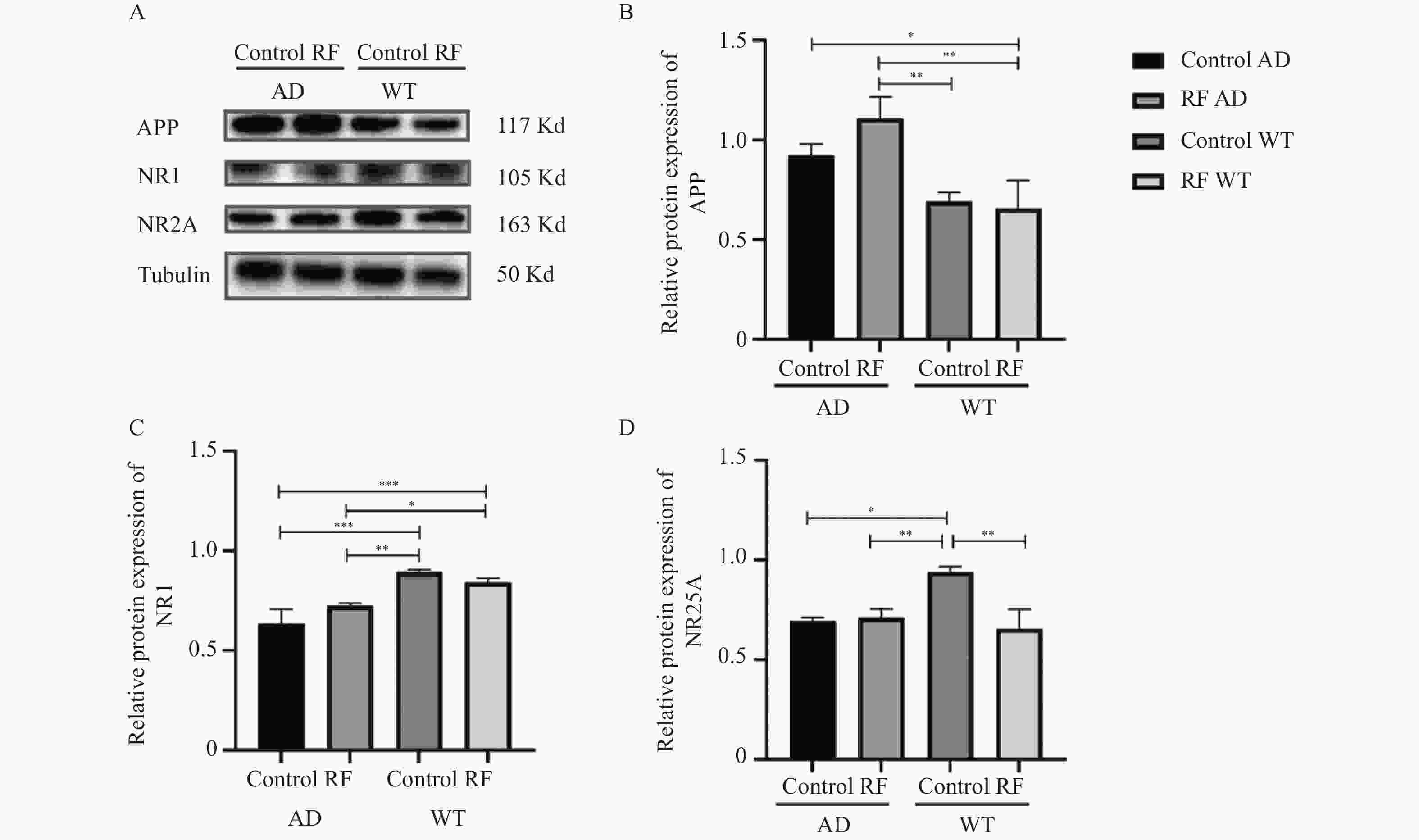
目的 探讨 1800 MHz电磁辐射(electromagnetic radiation,EMR)对3xTg-AD小鼠和57C小鼠认知功能的影响,为电磁辐射对人体的潜在影响提供理论依据。方法 以12只3xTg-AD转基因小鼠和12只野生型C57小鼠为研究对象,将1月龄的小鼠分为四组:RF WT(C57小鼠暴露组)、Control WT(C57小鼠对照组)、RF AD(3xTg-AD小鼠暴露组)、Control AD(3xTg-AD小鼠对照组),每组6只。每晚20:00至次日8:00进行 1800 MHz EMR暴露实验,持续5个月。暴露结束后进行水迷宫测试,评估EMR对3xTg-AD小鼠空间学习和记忆能力的影响,并测量体重、大脑重量及计算脑体比,最后采用Western Blot技术测量海马组织中APP、NR1、NR2A指标,分析1800 MHz EMR对3xTg-AD小鼠认知功能的影响。结果 在 1800 MHz EMR下,四组间的Morris水迷宫空间学习能力差异无统计学意义(P > 0.05),RF AD组的逃逸时间、游泳路程长度和穿越目标象限次数高于其他组(P < 0.05)。Western Blot结果显示,3xTg-AD小鼠的APP蛋白表达高于C57小鼠(P < 0.05)。WT组的NR1蛋白表达高于AD组(P < 0.05);AD组中,RF AD组高于Control WT组(P < 0.05),Control WT组的NR2A蛋白高于其他组(P < 0.05)。结论 长时间 1800 MHz EMR暴露会影响3xTg-AD及C57小鼠学习与认知功能。-
关键词:
- 电磁辐射 /
- 3xTg-AD小鼠 /
- 淀粉样前体蛋白 /
- N-甲基-D-天冬氨酸受体1 /
- N-甲基-D-天冬氨酸受体2A
Abstract:Objective To explore the effects of 1800 MHz electromagnetic radiation (EMR) on cognitive function of 3xTg-AD and 57C mice, providing a theoretical basis for the potential impacts of electromagnetic radiation on the human body.Methods A total of 12 3xTg-AD transgenic mice and 12 wild-type C57 mice were selected as research subjects. The one-month-old mice were divided into four groups: RF WT, Control WT, RF AD, and Control AD, with 6 mice in each group.The 1800 MHz EMR exposure experiments were conducted from 20:00 to 8:00 the next day for a duration of 5 months. After the exposure, a water maze test was conducted to evaluate the effects of EMR on spatial learning and memory abilities of 3xTg AD mice, along with measurements of body weight, brain weight, and calculation of the brain-to-body ratio. Finally, Western Blot technique was used to measure the levels of APP, NR1, and NR2A in hippocampal tissue to analyze effects of1800 MHz EMR on the cognitive function of 3xTg AD mice.Results Under 1800 MHz EMR exposure, there were no statistically significant differences in Morris water maze spatial learning ability among the four groups (P > 0.05). However, longer escape time, greater swimming distances, and more crossings of target quadrant were exhibited in the RF AD group compared to the other groups (P < 0.05). Western Blot results showed that the APP protein levels in 3xTg AD mice was higher than those in C57 mice (P < 0.05). The expression levels of NR1 protein in the WT group was higher than those in the AD group (P < 0.05); in the AD group, the RF AD group had higher levels than the Control WT group (P < 0.05), and the NR2A protein levels in the Control WT group were higher than in the other groups (P < 0.05).Conclusion Prolonged exposure to 1800 MHz EMR can affect the learning and cognitive function of both 3xTg AD and C57 mice. -
表 1 实验鼠的基本情况[M(P25,P75)/($\bar x \pm s $)]
Table 1. Basic information of experimental mice[M(P25,P75)/($ \bar x \pm s$)]
组别 体重(g) 大脑质量(g) 脑体比(‰) Control AD组(n=6) 12.61(9.15,14.61) 0.30±0.03 0.012(0.009,0.015) RF AD组(n=6) 13.06(11.59,13.75) 0.30±0.05 0.013(0.011,0.014) Control WT组(n=6) 14.08(12.73,15.97) 0.32±0.03 0.014(0.012,0.016) RF WT组(n=6) 14.81(14.38,15.24) 0.32±0.02 0.015(0.014,0.016) F/H值 8.505 1.038 8.552 P值 0.032* 0.389 0.036* *P < 0.05。 表 2 小鼠水迷宫空间探索实验结果($ \bar x \pm s $)
Table 2. Results of morris water maze spatial exploration test for mice ($ \bar x \pm s $)
组别 EL(S) TPL(cm) SS(S) T3/Tt D3/Dt TC(次) Control AD组(n=6) 3.69±2.11 1015.19 ±85.6817.14±1.52 0.31±0.10 0.31±0.10 2.00±0.00 RF AD组(n=6) 12.29±3.24 1210.87 ±65.7919.90±1.47 0.30±0.03 0.32±0.03 3.33±0.58 Control WT组(n=6) 2.99±0.96 980.43±97.64 18.07±2.50 0.27±0.10 0.29±0.08 2.25±0.50 RF WT组(n=6) 3.79±0.37 1036.08 ±36.9717.63±0.30 0.28±0.07 0.29±0.05 1.67±0.58 F/H值 16.590 5.539 1.406 0.116 0.164 6.748 P值 0.001* 0.020* 0.303 0.949 0.918 0.011* *P < 0.05。 -
[1] Sundaram V,Mohammed S,Zyuzikov N. Effects of 150 kHz intermediate frequency electromagnetic radiation on fertility indicators in male rats[J]. Heliyon,2022,8(12):122-143. [2] 中华人民共和国国家统计局. 2022年国民经济和社会发展统计公报[J]. 中国统计,2023,1(3):12-29. [3] Russell C L. 5 G wireless telecommunications expansion: Public health and environmental implications[J]. Environ Res,2018,165(5):484-495. [4] Banik S,Bandyopadhyay S,Ganguly S. Bioeffects of microwave:A brief review [J]. Bioresour Technol,2003,87(2): 155-164. [5] Lagorio S,Blettner M,Baaken D,et al. The effect of exposure to radiofrequency fields on cancer risk in the general and working population: A protocol for a systematic review of human observational studies[J]. Environment International,2021,157(4):238-247. [6] Jayan J,Roshi H,Ashraf F,et al. Effects of radiation exposure on brain health: A state of the art and new challenges[J]. Environmental Science and Pollution Research International,2022,29(58):87068-87081. doi: 10.1007/s11356-022-23703-4 [7] Sommer A,Streckert J,Bitz A,et al. No effects of GSM-modulated 900 MHz electromagnetic fields on survival rate and spontaneous development of lymphoma in female AKR/J mice[J]. BMC Cancer,2004,4(2):772-789. [8] Ferguson S,Sarkar S,Schmued L. Longitudinal behavioral changes in the APP/PS1 transgenic Alzheimer's disease model[J]. Behavioural Brain Research,2013,242(2):125-134. [9] Bouji M,Lecomte A,Gamez C,et al. Neurobiological effects of repeated radiofrequency exposures in male senescent rats[J]. Biogerontology,2016,17(5-6):841-857. doi: 10.1007/s10522-016-9654-8 [10] Zhao J,Liu X,Xia W,et al. Targeting Amyloidogenic processing of APP in Alzheimer's disease[J]. Frontiers in Molecular Neuroscience,2020,13(2):137-148. [11] Delport A,Hewer R. The amyloid precursor protein: a converging point in Alzheimer's disease[J]. Molecular Neurobiology,2022,59(7):4501-4516. doi: 10.1007/s12035-022-02863-x [12] Park J,Kwon J,Kim N,et al. Effects of 1950 MHz radiofrequency electromagnetic fields on Aβ processing in human neuroblastoma and mouse hippocampal neuronal cells[J]. Journal of Radiation Research,2018,59(1):18-26. doi: 10.1093/jrr/rrx045 [13] Owlett L,Belcher E,Dionisio-Santos D,et al. Space radiation does not alter amyloid or tau pathology in the 3xTg mouse model of Alzheimer's disease[J]. Life Sciences in Space Research,2020,27(2):89-98. [14] Dainauskas J,Marie H,Migliore M,et al. GluN2B-NMDAR subunit contribution on synaptic plasticity: A phenomenological model for CA3-CA1 synapses[J]. Frontiers in synaptic neuroscience,2023,15(4):1113-1148. [15] Hajdú T,Juhász T,Szűcs-Somogyi C,et al. NR1 and NR3B composed intranuclear N-methyl-d-aspartate receptor complexes in human melanoma cells[J]. International Journal of Molecular Sciences,2018,19(7):134-159. [16] Furuie H,Yamada M. Neonatal blockade of NR2A-containing but not NR2B-containing NMDA receptor induces spatial working memory deficits in adult rats[J]. Neuroscience Research,2022,176(4):57-65. [17] 袁海阳,朱梦姚,王祎,等. 保元汤对于记忆损伤小鼠的行为学以及海马体蛋白的影响[J]. 四川中医,2023,41(9):66-72. -






 下载:
下载: