Pan-Cancer Analysis for the Effects of ANGPT1 and TEK on Human Tumor Progression
-
摘要:
目的 探讨血管生成素1(angiopoietins-1,ANGPT1)及其受体TEK(tyrosine kinase)在泛癌中的表达、预后及免疫浸润的情况。 方法 应用TIMER2.0、Kaplan-Meier plotter、UALCAN等数据库分析ANGPT1及TEK在泛癌中的表达、预后;利用SangerBox3.0及R软件分析ANGPT1、TEK与肿瘤突变负荷(tumor mutation burden,TMB)、微卫星不稳定(microsatellite instability,MSI)、免疫检查点(immune checkpoint,ICP)、免疫浸润的相关性;使用String数据库、GO与KEGG分析鉴定与ANGPT1和TEK相关的蛋白及调节通路。 结果 ANGPT1和TEK在多数肿瘤中低表达(P < 0.05)。ANGPT1、TEK低表达患者预后不良 (P < 0.05)。ANGPT1和TEK的表达水平与肾透明细胞癌、膀胱尿路上皮癌、乳腺浸润性癌等临床分期相关 (P < 0.05)。ANGPT1、TEK表达与肿瘤的TMB、MSI、ICP相关(P < 0.05),与免疫浸润正相关(P < 0.05)。与ANGPT1和TEK关系密切的基因有GRB2、PIK3R1、EGFR等,主要参与Grb2-EGFR、ERBB3:ERBB2、Shc-EGFR等复合物相关的生物学过程和功能,主要涉及ErbB信号通路。 结论 ANGPT1和TEK可能通过ErbB信号通路在肿瘤发生发展中起重要作用,有望成为多种癌症的潜在临床预后标志物。 Abstract:Objective To probe the expression level, prognostic value, and immune invasion of angipoietin-1 (ANGPT1)and its receptor tyrosine kinase (TEK)in pan-cancer. Methods TIMER2.0、Kaplan-Meier plotter and UALCAN etc. databases were used to analyze the expression, prognostic value of ANGPT1 and TEK in various types of tumors. SangerBox 3.0 and R software were used to analyze the relationship between ANGPT1 and TEK tumor mutational burden (TMB), microsatellite instability (MSI), immune checkpoint (ICP) and immune cell infiltration. String database, GO and KEGG analysis were used to identify proteins and regulatory pathways related to ANGPT1 and TEK. Results ANGPT1 and TEK showed low expression in most tumors (P < 0.05). Patients with low expression of ANGPT1 and TEK had a worse prognosis (P < 0.05). The expression levels of ANGPT1 and TEK were correlated with the clinical stages of clear cell renal carcinoma, bladder urothelial carcinoma, and invasive breast carcinoma (P < 0.05). The expression of ANGPT1 and TEK was significantly correlated with TMB, MSI and ICP in various tumors (P < 0.05), and was significantly positively correlated with immune invasion (P < 0.05). The genes were closely related to ANGPT1 and TEK include GRB2, PIK3R1, EGFR, etc., which were mainly involved in a series of biological processes and functions related to Grb2-EGFR, ERBB3:ERBB2, Shc-EGFR and other complexes, mainly involved ErbB signaling pathway. Conclusion ANGPT1 and TEK may play an important role in tumorigenesis and development through the ErbB signaling pathway, and are expected to be potential clinical prognostic markers for various types of cancer. -
Key words:
- ANGPT1 /
- TEK /
- Pan-cancer analysis /
- The R Programming Language
-
癌症是死亡率居世界第二位的系统性慢性疾病[1],其进展与血管生成关系密切,因此,研究癌症中与血管生成相关的分子机制,探索相关新靶点具有重要的理论和临床意义。在肿瘤形成过程中,与血管生成有关的因素有血管内皮生长因子(vascular endothelial growth factor,VEGF)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、血管生成素(angiopoietin,ANGPT)等[2−4]。其中血管生成素/酪氨酸磷酸化激活受体(tyrosine kinase,TEK)系统已成为癌症治疗及药物开发中日益关注的靶标[5]。由TEK基因编码的酪氨酸蛋白激酶-2(tyrosine-protein kinase receptor-2,Tie2)在血管稳定性中起核心作用。在人类中,有3种已知的Tie2配体,即ANGPT1、ANGPT2和ANGPT4。其中作为一种分泌型的血管生成因子,ANGPT1是主要在内皮细胞上表达的酪氨酸激酶受体Tie 2的天然配体[6],在血管发育和生成中起着决定性作用。ANGPT1能够与血管内皮细胞Tie2受体结合,介导内皮细胞与周围基质和间充质的相互作用,抑制新生血管的生成[7-8]。尽管如此,ANGPT1 在肿瘤发生发展的影响尚存争议。研究指出,在胶质瘤中,ANGPT1表达量较高,可促进血管生长和肿瘤增殖[9]。相反,在转移性结肠癌及乳腺癌中,ANGPT1显示出增强血管稳定性的功能,从而抑制血管生成及肿瘤生长和转移[10−12];肺腺癌的研究也表明,ANGPT1的表达水平较低,且与淋巴结转移和 TNM分期(tumor node metastasis classification)呈负相关[13]。ANGPT1 对肿瘤血管系统的不同作用可能是由于不同类型的肿瘤、肿瘤中Tie2的表达程度或外源性ANGPT1 的有效性存在基本差异[14]。Tie2不仅由肿瘤血管内皮细胞表达,还可表达于肿瘤微环境中的其他细胞。文献报道,肿瘤中表达Tie2的单核细胞参与肿瘤生长[15],这意味着血管生成素可能通过表达Tie2的内皮细胞和单核细胞在肿瘤血管生成中发挥作用。总的说来,ANGPT/TEK系统在肿瘤中的作用及其机制还不清楚,值得深入探讨。
目前,关于ANGPT/TEK在肿瘤中的系统性大数据分析尚未见报道。本研究中,作者系统性分析了ANGPT1/TEK基因在多种肿瘤中的多组学数据,全面揭示了ANGPT1/TEK的表达、免疫及其与预后的关系,以阐明ANGPT1/TEK基因在肿瘤发生发展过程中的关键作用及可能的调节机制。
1. 资料与方法
1.1 样本信息
对ANGPT1和TEK进行系统性泛癌分析所需公共数据库的原始数据主要来自The Cancer Genome Atlas (https://portal.gdc.cancer.gov/) 和GTEx数据库(http://commonfund.nih.gov/GTEx/)。
1.2 基因的转录表达分析
使用TIMER2.0 (http://timer.cistrome.org/)数据库选择Cancer Exploration 进行ANGPT1和TEK在泛癌以及正常组织表达水平的在线分析,得到ANGPT1和TEK在泛癌以及正常组织的表达差异图。对于在TIMER数据库中缺乏邻近正常组织的肿瘤,应用GEPIA2数据库进行基因差异分析补充,此外,通过GEPIA2分析ANGPT1和TEK在泛癌中临床分期的表达情况。
1.3 基因的蛋白质表达分析
使用UALCAN (http://ualcan.path.uab.edu/analysisprot.html)数据库选择TCGA进行ANGPT1和TEK在泛癌以及正常组织中的表达差异分析。应用人类蛋白质图谱(human protein atlas,HPA)数据库(https://www.proteinatlas.org)检索 ANGPT1、TEK蛋白在肺、肝、肾、乳腺、结直肠中的表达图,得到以上组织和正常组织免疫组化对比图。
1.4 生存预后分析
使用Kaplan-Meier plotter (https://kmplot.com/analysis/)数据库mRNA(RNA-seq)中的泛癌分析板块,通过总生存期(overall survival,OS)、无复发生存期(relapse-free survival,RFS)分析ANGPT1和TEK表达对21种癌症预后的影响。
1.5 基因免疫分析
肿瘤突变负荷(tumor mutational burden,TMB)和微卫星不稳定性(microsatellite instability,MSI)均是实体瘤肿瘤微环境中非常重要的分子生物标志物,免疫检查点(immune checkpoint,ICP)是在肿瘤的发生发展过程中产生免疫耐受的主要原因之一。使用在线TCGA分析工具SangerBox3.0 (http://sangerbox.com/tool.html),研究ANGPTI1、TEK表达与TMB、MSI、ICP之间的关系,相关分析采用Spearman秩检验。
1.6 免疫浸润分析
从UCSC (https://xenabrowser.net/) 数据库下载TCGA TARGET GTEx (PANCAN,N=19131,G=60499)泛癌数据集,从中提取ANGPT和TEK在各样本中的表达数据。免疫浸润分析利用R软件ESTIMATE包,根据基因表达计算每类肿瘤中每个样本的基质评分(stromal score)以评估肿瘤组织中的基质细胞浸润水平、免疫评分(immune score)以评估肿瘤组织中的免疫细胞浸润水平,以及2个分数相加即得到评估分数(estimate score)用于推断肿瘤纯度。免疫浸润细胞亚型分析用R软件IOBR包的Timer方法,根据基因表达评估每类肿瘤中每个样本的B 细胞、CD4 T细胞、CD8 T 细胞、中性粒细胞、巨噬细胞、树突状细胞浸润分数。
1.7 蛋白相互作用网络分析
通过STRING(string-db.org)数据库获得ANGPT1与TEK的蛋白相互作用网络。在该数据库Multiple protein输入ANGPTI与TEK,物种来源设定为“Homo sapiens”,其他基本设置如下:主动交互源为实验,所需最低交互分数取中置信度 (0.400),要显示的最大交互器数两壳均设置为不超过50个交互体。所得数据用Cytoscape软件构建PPI网络,将结果可视化。
1.8 基因通路富集分析
从DAVID (https://david.ncifcrf.gov/summary.jsp)数据库中获取相互作用基因,利用 R 语 言Cluster Profiler包对所得数据进行筛选处理。使用SangerBox3.0平台富集分析圈图快速绘制工具,绘制生物过程(biological process ,BP)、分子功能(molecular function,MF )与细胞组分(cellular component ,CC)的和弦图,取P < 0.05的条目前十进行excel表格的建立、导入、生成相应的可视化图像。
1.9 统计学处理
采用Wilcoxon检验评估TIMER中肿瘤与癌旁正常组织的差异表达。采用Mann-Whitney U检验分析HPA数据库中获得的免疫组织化学结果。为了比较生存曲线,在Kaplan-Meier中采用logrank检验计算HR和logrank P值。基因表达的相关性采用Spearman相关性分析。采用SPSS 26.0统计软件进行统计分析,P < 0.05有统计学意义。
2. 结果
2.1 ANGPT1和TEK在泛癌中的转录表达量和蛋白表达量
TIMER数据库结果显示ANGPT1和TEK在大部分肿瘤中的差异表达有统计学意义。ANGPT1 (图1A)在 BLCA、BRCA、COAD、KIRC、KIRP、LUAD、LUSC、PRAD、READ、THCA 、UCEC (P < 0.001),CESC、SKCM ( P < 0.01) 中表达下调。相反,在KICH、LIHC (P < 0.001),GBM (P < 0.05)中表达下调。TEK(图1B)在 BLCA、BRCA、COAD、KICH、KIRC、KIRP、LIHC、LUAD、LUSC、PRAD、READ、SKCM、UCEC (P < 0.001),CESC、GBM (P < 0.01),THCA (P < 0.05)中表达下调。利用GEPIA数据库评估了ANGPT1和TEK在肿瘤与对照组织中的表达差异,ANGPT1(图1A)在BRCA、CECS、KIRP、LUAD、LUSC、OV、PRAD、UCES (P < 0.05)中的表达低于正常组织,而在GBM 、KICH(P < 0.05)中的表达高于正常组织。对于其他肿瘤未观察到显著差异。TEK(图1B)在ACC、BLCA、BRCA、CESC、KICH、KIRC、KIRP、LUAD、LUSC、OV、UCEC、UCS ( P < 0.05)中的表达低于正常组织,而在PAAD (P < 0.05)中的表达高于正常组织。对于其他肿瘤未观察到显著差异。根据GEPIA的" stage plot "模块,发现KIRC(P < 0.05)中ANGPT1的表达与肿瘤分期相关,而在其他癌症中未发现相关性(图1C)。而BLCA、BRCA、KICH、READ、SKCM、STAD和THCA(P < 0.05)中TEK的表达与肿瘤分期相关,与其他肿瘤分期无关(图1D)。同时,笔者通过DALCAN数据库分析ANGPT1和TEK在泛癌和正常组织中的表达水平。结果表明ANGPT1(图1C)在18种癌症组织中显著低表达,其中包括BLCA、BRCA、CESC等;而在CHOL、ESCA、GBM、KICH、LIHC、PCPG中表达较正常显著上调(P < 0.05)。同样地,与正常组相比,TEK在24种癌症组织中显著低表达且均具有统计学意义(P < 0.05)(图1D),其中包括BLCA、BRCA、CESC等。通过HPA数据库进一步分析了ANGPT1、TEK蛋白在肺、肝、肾、乳腺、结直肠等肿瘤组织和癌旁正常组织中的蛋白表达情况(补充图1E),与癌旁正常对照组相比,ANGPT1和TEK在大多数正常组织中呈低表达,而在大多数肿瘤组织中ANGPT1呈高表达,TEK呈低表达。因此,ANGPT1在肿瘤中高表达,TEK在肿瘤中低表达。
 图 1 通过不同数据库分析ANGPT1与TEK在正常组织和不同肿瘤组织间的转录情况及蛋白表达量A:通过TIMER数据库分析ANGPT1在不同肿瘤组织中相对于正常组织中的表达水平。B:通过TIMER数据库分析TEK在不同肿瘤组织中相对于正常组织中的表达水平。 C:通过UALCAN数据库分析ANGPT1在不同肿瘤组织的蛋白质组表达水平; D:通过UALCAN数据库分析TEK在不同肿瘤组织的蛋白质组表达水平。*P < 0.05;**P < 0.01;***P < 0.001。Figure 1. The transcription and protein expression levels of ANGPT1 and TEK in normal tissues and different tumor tissues were analyzed by different databases
图 1 通过不同数据库分析ANGPT1与TEK在正常组织和不同肿瘤组织间的转录情况及蛋白表达量A:通过TIMER数据库分析ANGPT1在不同肿瘤组织中相对于正常组织中的表达水平。B:通过TIMER数据库分析TEK在不同肿瘤组织中相对于正常组织中的表达水平。 C:通过UALCAN数据库分析ANGPT1在不同肿瘤组织的蛋白质组表达水平; D:通过UALCAN数据库分析TEK在不同肿瘤组织的蛋白质组表达水平。*P < 0.05;**P < 0.01;***P < 0.001。Figure 1. The transcription and protein expression levels of ANGPT1 and TEK in normal tissues and different tumor tissues were analyzed by different databases2.2 ANGPT1和TEK在泛癌中的预后价值
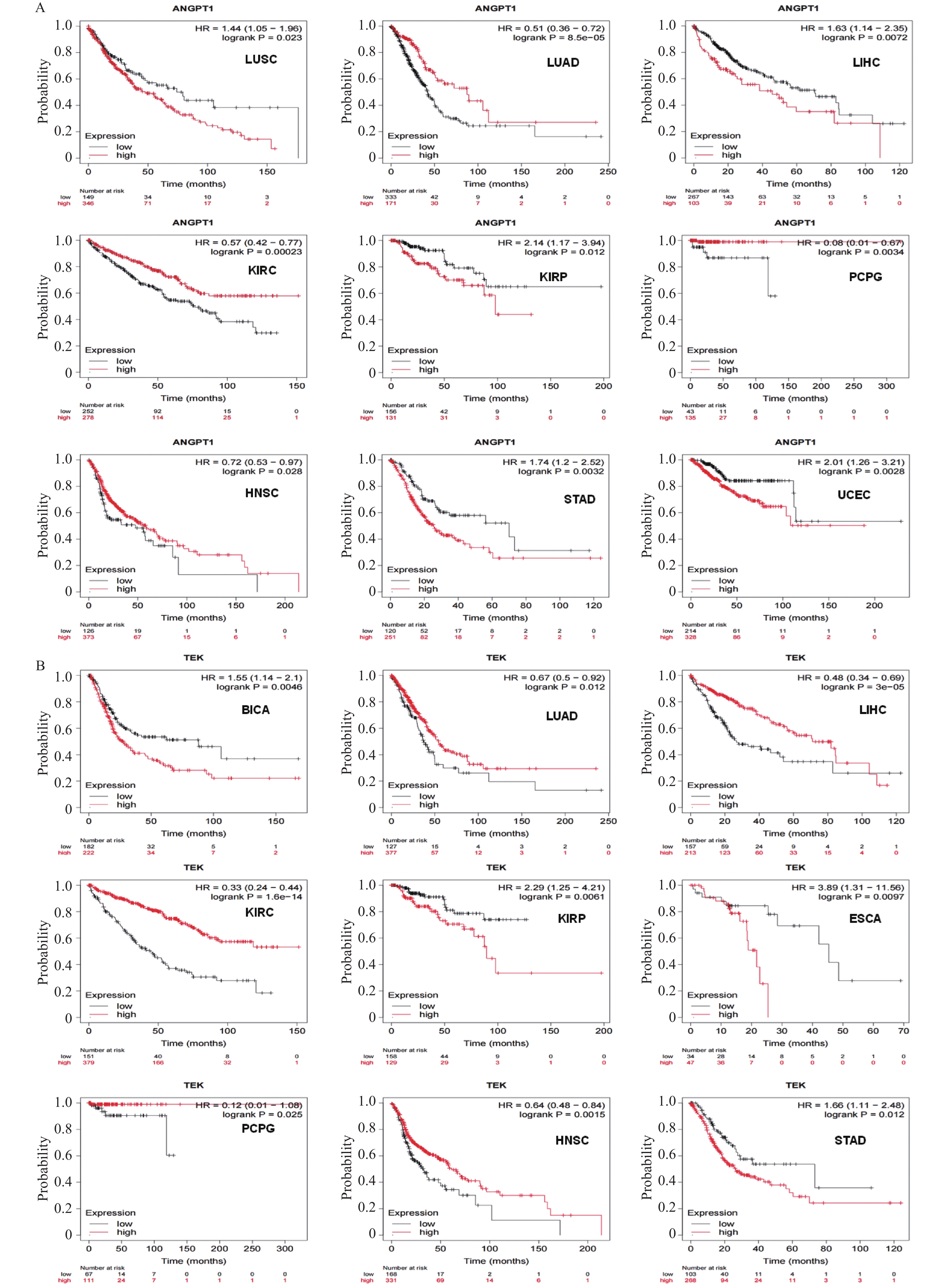
使用Kaplan-Meier plotter数据库mRNA(RNA-seq)中的泛癌分析板块分析ANGPT1和TEK表达对21种癌症预后的影响。预后分析中,具有统计学意义的OS(总生存期)表明(图2A)ANGPT1与LUSC、LUAD、LIHC、KIRC、RCC、PCPG、HNSC、STAD、UCEC相关,其中ANGPT1高表达与LUSC(HR = 1.44,P = 0.023)、LIHC(HR = 1.63,P = 0.0072)、RCC(HR = 2.14,P = 0.012)、STAD(HR = 1.74,P = 0.0032)、LICEC(HR = 2.01,P = 0.0028)患者预后不良高度相关,ANGPT1低表达与LUAD(HR = 0.51,P = 8.5e−05)、KIRC(HR = 0.57,P = 0.00023)、PCDG(HR = 0.08,P = 0.0034)、HNSC(HR = 0.72,P = 0.028)患者预后不良高度相关,因此,ANGPT1高表达对RCC和STAD患者预后不良起重要作用,低表达则加速了LUAD患者死亡的进程。预后分析中,具有统计学意义的OS(总生存期)表明(图2B)TEK与BICA、LUAD、LIHC、KIRC、RCC、ESCC、PCPG、HNSC、STAD相关,其中TEK高表达与BICA(HR = 1.55,P = 0.0046)、RCC(HR = 2.29,P = 0.0061)、ESCC(HR = 3.89,P = 0.0097)、STAD(HR = 1.66,P = 0.012)患者预后不良高度相关,TEK低表达与PAAD(HR = 0.67,P = 0.012)、LIHC(HR = 0.48,P = 3e−05)、KIRC(HR = 0.33,P = 1.6e−14)、PCPG(HR = 0.12,P = 0.025)、HNSC(HR = 0.64,P = 0.0015)、患者预后不良高度相关,因此,TEK高表达对RCC和STAD患者预后不良起重要作用,低表达则加速了LUAD和LIHC患者死亡的进程。此外,通过绘制ROC曲线评估ANGPT1、TEK在GBM、CRC、OV、BRCA中的诊断价值,AUC值均>0.5,预测结果具有一定的准确性(补充图2)。 以上结果表明,ANGPT1与TEK高表达的RCC和STAD患者预后较差,低表达则均加速了READ患者死亡的进程。
2.3 基因表达与TMB、MSI和ICP的相关性
在ANGPT1对TMB的影响的分析中(图3A),ANGPT1在15种肿瘤中与TMB显著相关,其中在3种肿瘤中显著正相关,如:GBMLGG、BLCA(P < 0.05),在12种肿瘤中显著负相关,如:LUAD、COADREAD、ESCA等(P < 0.05); MSI (图3B)在10种肿瘤中显著相关,其中在2种肿瘤中显著正相关,如:TGCT、SKCM (P < 0.05),在9种肿瘤中显著负相关,如:GBMLGG、LUAD、STES、STAD、PRAD、HNSC、LUSC、DLBC (P < 0.05); ICP分析(图3C)得到ANGPT1与泛癌中的大多数免疫检查点呈正相关。TEK对TMB影响的分析中(图3D),TEK在20种肿瘤中与TMB显著相关,其中,在THYM (P <0.01)中呈显著正相关,在19种肿瘤中显著负相关,如:GBMLGG、CESC、LUAD等(P < 0.05);TEK与MSI (图3E)在13种肿瘤中显著相关,其中,在GBMLGG (P < 0.01)中显著正相关,在12种肿瘤中显著负相关,如:BRCA、STES、KIPAN等(P < 0.05);ICP分析(图3F)得到TEK与泛癌中的大多数免疫检查点呈正相关。
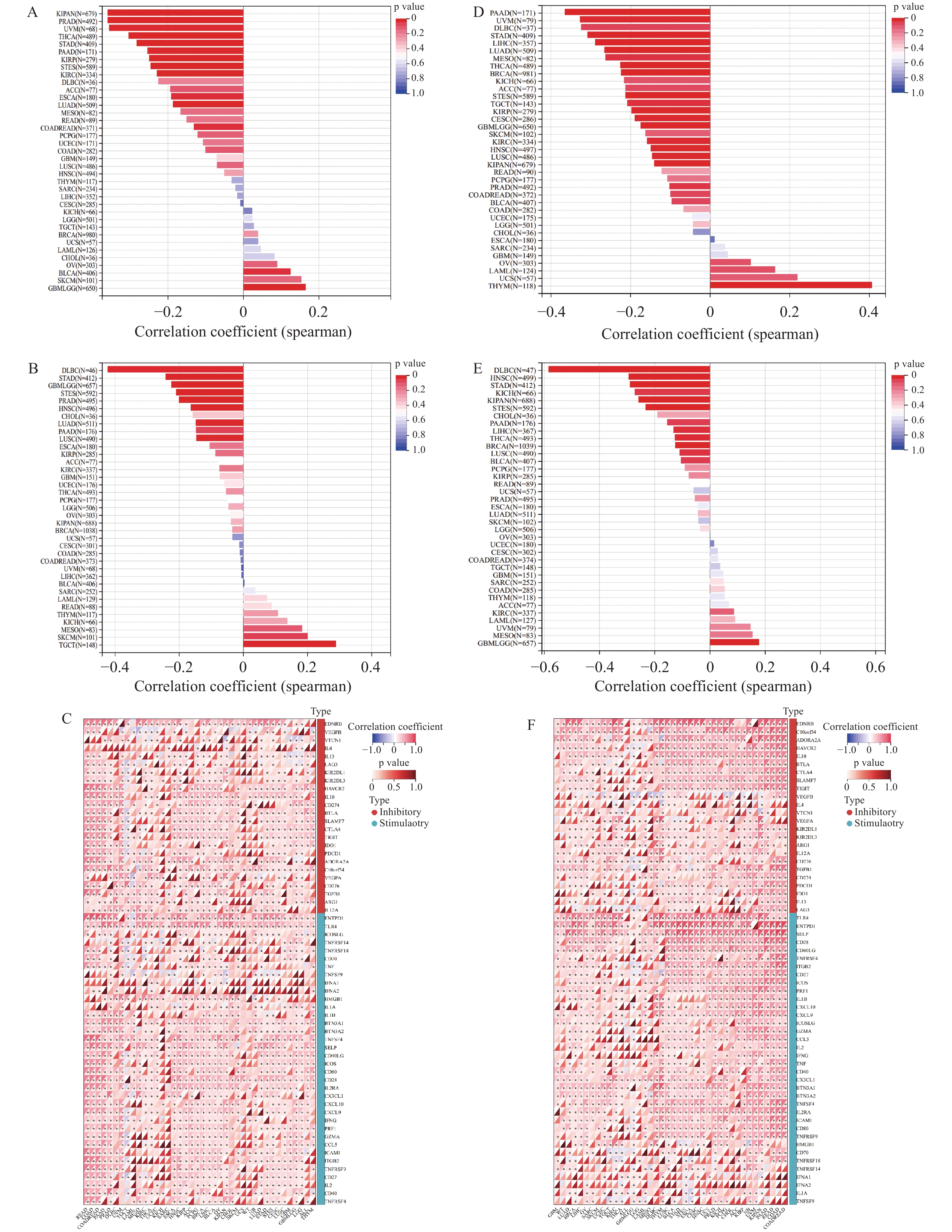 图 3 ANGPT1和TEK在不同癌症类型中的基因免疫分析A:ANGPT1表达水平与不同癌症类型的TMB(Tumor mutation burden)的相关性; B:ANGPT1表达水平与不同癌症类型的MSI(Microsatellite instability)评分的相关性; C:ANGPT1表达水平与不同癌症类型的免疫检查点的相关性; D:TEK表达水平与不同癌症类型的TMB(Tumor mutation burden)的相关性; E:TEK表达水平与不同癌症类型的MSI(Microsatellite instability)评分的相关性; F:TEK表达水平与不同癌症类型的免疫检查点的相关性。Figure 3. Gene immunoassays of ANGPT1 and TEK in different cancer types
图 3 ANGPT1和TEK在不同癌症类型中的基因免疫分析A:ANGPT1表达水平与不同癌症类型的TMB(Tumor mutation burden)的相关性; B:ANGPT1表达水平与不同癌症类型的MSI(Microsatellite instability)评分的相关性; C:ANGPT1表达水平与不同癌症类型的免疫检查点的相关性; D:TEK表达水平与不同癌症类型的TMB(Tumor mutation burden)的相关性; E:TEK表达水平与不同癌症类型的MSI(Microsatellite instability)评分的相关性; F:TEK表达水平与不同癌症类型的免疫检查点的相关性。Figure 3. Gene immunoassays of ANGPT1 and TEK in different cancer types2.4 ANGPT1和TEK表达与泛癌免疫浸润相关性及免疫浸润细胞亚型分析
本团队分析了在不同类型的恶性肿瘤中,ANGPT1和TEK的表达水平对其免疫浸润的影响。在26种癌症中,ANGPT1与22种肿瘤微环境中的免疫浸润呈显著正相关(P < 0.05),与4种肿瘤呈显著负相关(P < 0.05)(补充图3A)。在31种癌症中,TEK与26种肿瘤微环境中的免疫浸润呈显著正相关,与5种肿瘤呈显著负相关(补充图3B)。此外,分析了在不同类型的恶性肿瘤中,ANGPT1和TEK的表达水平对其免疫浸润细胞亚型的影响。ANGPT1(图4A)与TEK(图4B)在大多数恶性肿瘤中的表达与不同免疫细胞的浸润有统计学意义(P < 0.05)。其中,中性粒细胞、巨噬细胞和树突状细胞在癌症中的浸润程度均与ANGPT1和TEK的表达呈正相关,而CD4T细胞在癌症中的浸润程度均与ANGPT1和TEK的表达呈负相关。 此外,在与ANGPT1和TEK表达成正相关的癌症中,ANGPT1和TEK的表达使CD4 T细胞、巨噬细胞在COAD中浸润程度升高,CD8 T细胞在PAAD中的浸润度升高,中性粒细胞在DLBC中浸润度升高;在与ANGPT1和TEK表达成负相关的癌症中,以CD4 T 细胞浸润相关性最显著,但肿瘤类型各不相同。
 图 4 在不同癌症类型中ANGPT1和TEK的表达水平与免疫浸润细胞亚型的相关性分析(其中x轴为不同免疫细胞亚型,y轴为不同癌症类型,红色表示癌症和免疫细胞亚型之间的正相关。蓝色表示负相关。颜色越深,相关性越大。相关系数和P值显示在每个单元格中)A:在不同癌症类型中ANGPT1表达水平与免疫浸润细胞亚型的相关性; B:在不同癌症类型中TEK表达水平与免疫浸润细胞亚型的相关性,*P < 0.05。Figure 4. Correlation analysis of ANGPT1 and TEK expression levels with immune-infiltrating cell subtypes in different cancer types (The x-axis is for different immune cell subtypes,the y-axis is for different cancer types,and red indicates a positive correlation between cancer and immune cell subtype. Blue indicates a negative correlation. The darker the color,the greater the relevance. The correlation coefficient and P-value are displayed in each cell)
图 4 在不同癌症类型中ANGPT1和TEK的表达水平与免疫浸润细胞亚型的相关性分析(其中x轴为不同免疫细胞亚型,y轴为不同癌症类型,红色表示癌症和免疫细胞亚型之间的正相关。蓝色表示负相关。颜色越深,相关性越大。相关系数和P值显示在每个单元格中)A:在不同癌症类型中ANGPT1表达水平与免疫浸润细胞亚型的相关性; B:在不同癌症类型中TEK表达水平与免疫浸润细胞亚型的相关性,*P < 0.05。Figure 4. Correlation analysis of ANGPT1 and TEK expression levels with immune-infiltrating cell subtypes in different cancer types (The x-axis is for different immune cell subtypes,the y-axis is for different cancer types,and red indicates a positive correlation between cancer and immune cell subtype. Blue indicates a negative correlation. The darker the color,the greater the relevance. The correlation coefficient and P-value are displayed in each cell)2.5 ANGPT1和TEK相关基因蛋白相互作用网络与富集通路分析
通过TIMER数据库分析ANGPT1对TEK表达量的影响,本团队发现ANGPT1的表达水平与TEK的表达量呈负相关(图5A)。通过STRING数据库检索得到的59个与ANGPT1和TEK相关的基因,构建了包含59个节点,332条边的蛋白相互作用网络(图5B)。通过Cytoscape软件将网络可视化,并利用CytoCNA 插件进一步进行网络拓扑分析。GRB2、PIK3R1、EGFR与ANGP1和TEK的关系最密切。在通路富集分析中,GO分析得到270个生物过程(BP)富集分析条目、49个细胞组分(CC)富集分析条目和64个分子功能(MF)富集分析条目,取各条目得分前10的条目为主要分析对象,各条目结果用弦图表示(图5C-E)。由各条目可知,ANGPT1和TEK可能在辅助性T细胞渗出、血小板衍生生长因子受体-α信号通路的调控、Grb-EGFR复合物、ErbB-3类受体结合等方面发挥重要作用。KEGG通路富集分析(图5F)共得到115个条目,主要涉及ErbB、Ras、Rap1、磷脂酶D信号通路和EGFR酪氨酸激酶抑制剂耐药性等。
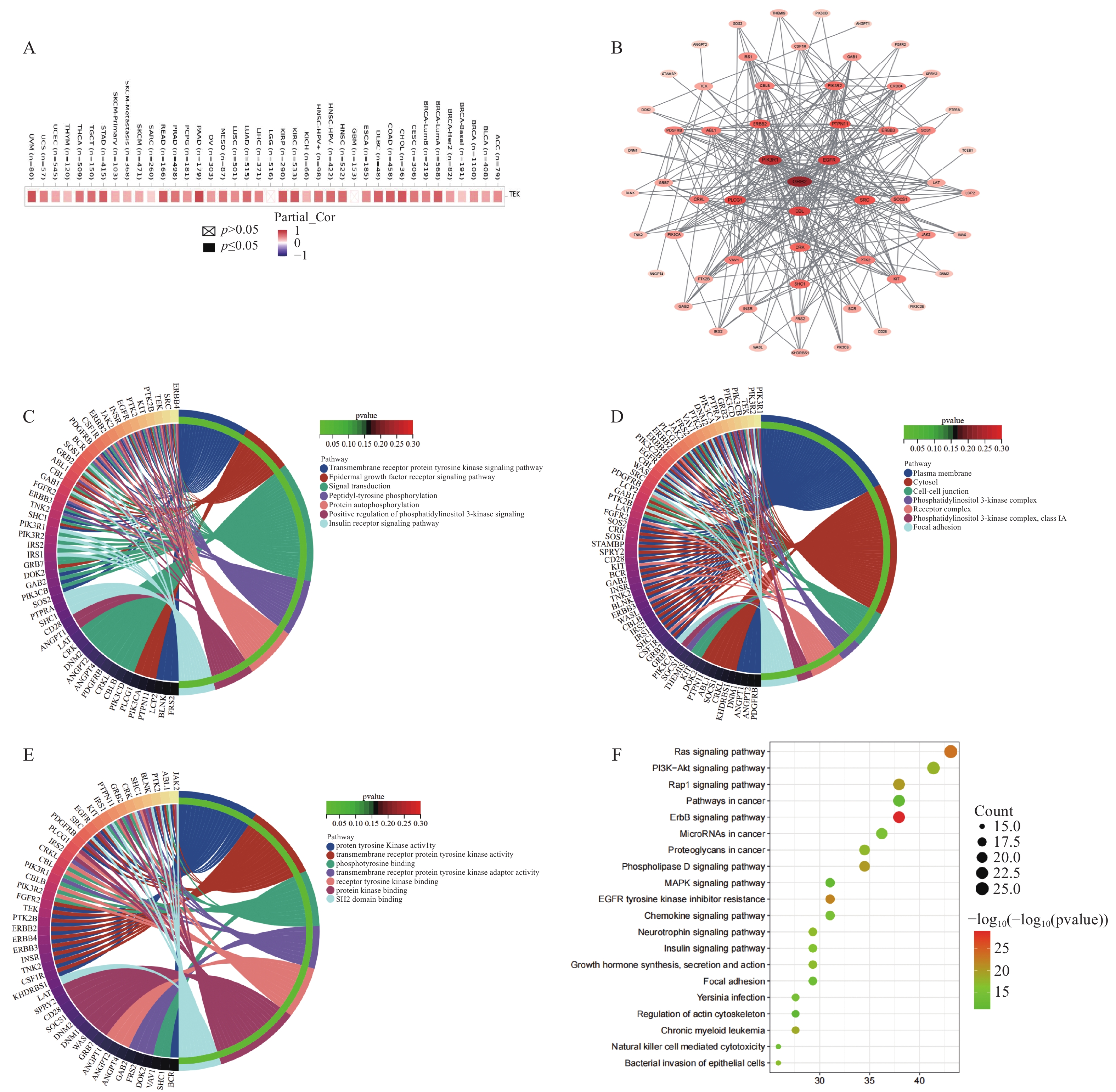 图 5 ANGPT1和TEK相关基因的蛋白相互作用网络与富集通路分析A:通过TIMER数据库分析在不同癌症类型中ANGPT1对TEK表达量的影响; B:59个相关基因的蛋白质相互作用网络。通过STRING数据库检索得到的59个与ANGPT1和TEK相关的基因,利用Cytoscape软件将网络可视化,颜色节点代表已识别的蛋白质,从内到外,节点面积大小和颜色深浅程度代表节点的重要性强弱; C:ANGPT1和TEK相关基因GO分析的生物过程(BP)富集分析条目; D:ANGPT1和TEK相关基因GO分析的细胞组分(CC)富集分析条目; E:ANGPT1和TEK相关基因GO分析的分子功能(MF)富集分析条目; F:ANGPT1和TEK相关基因KEGG通路富集分析条目,*P < 0.05。Figure 5. Analysis of protein interaction network and enrichment pathway of ANGPT1 and TEK-related genes
图 5 ANGPT1和TEK相关基因的蛋白相互作用网络与富集通路分析A:通过TIMER数据库分析在不同癌症类型中ANGPT1对TEK表达量的影响; B:59个相关基因的蛋白质相互作用网络。通过STRING数据库检索得到的59个与ANGPT1和TEK相关的基因,利用Cytoscape软件将网络可视化,颜色节点代表已识别的蛋白质,从内到外,节点面积大小和颜色深浅程度代表节点的重要性强弱; C:ANGPT1和TEK相关基因GO分析的生物过程(BP)富集分析条目; D:ANGPT1和TEK相关基因GO分析的细胞组分(CC)富集分析条目; E:ANGPT1和TEK相关基因GO分析的分子功能(MF)富集分析条目; F:ANGPT1和TEK相关基因KEGG通路富集分析条目,*P < 0.05。Figure 5. Analysis of protein interaction network and enrichment pathway of ANGPT1 and TEK-related genes3. 讨论
3.1 ANGPT1-TEK信号对血管重塑发挥重要作用
血管重塑是许多疾病的一种重要病理特征[16],与肿瘤生长、侵袭、转移密切相关。肿瘤血管重塑主要与肿瘤细胞和间质细胞分泌促血管生成因子增加有关。其中ANGPT-TEK受体信号控制周细胞覆盖率,是除VEGF外血管稳定和重塑的关键调节信号。生理状态下周细胞源性ANGPT1是内皮细胞受体Tie2最主要的激动剂,通过旁分泌诱导受体磷酸化[18]。值得注意的是,ANGPT 2与ANGPT1同源且与TEK受体有同样高的亲和力,但其功能却大不相同。目前认为ANGPT2竞争性抑制ANGPT1,阻断TEK受体磷酸化,使内皮细胞处于激活状态[16-17]。近年的研究表明,促血管生成素及TEK受体是新发现的在机体的生理、病理性血管形成中发挥调节作用的重要信息途径,尤其在调节肿瘤血管新生过程中起着复杂而重要的作用。但目前对ANGPT1、TEK在泛癌中的表达尚无系统文献报道,因此本团队通过联合多个在线数据库,首次从整体角度分析ANGPT1和TEK在转录、蛋白水平的表达、预后价值、基因改变、免疫浸润及参与的相关细胞通路,探讨ANGPT1和TEK在不同肿瘤发病或临床预后中的潜在分子机制,从而为肿瘤的治疗提供新方向。
3.2 ANGPT1和TEK在34种肿瘤中的转录、蛋白表达及相关预后分析
ANGPT和TEK在调节肿瘤血管结构中起显著作用,特别对周围新生血管区的调节。研究表明,ANGPT1在乳腺癌[19]中呈低表达,在肝癌[20]中表达无明显变化,而在膀胱癌[21]等肿瘤组织中呈现高表达。TEK在肿瘤组织如乳腺癌[22]、透明细胞肾细胞癌[23]、胃癌[24]、甲状腺癌[23]中均有表达。本课题组利用TIMER和UALCAN数据库分析了ANGPT1和TEK转录和蛋白表达水平。本结果发现:ANGPT1在BLCA、BRCA、COAD等14种癌症中低表达,在3种癌症(KICH、LIHC、GBM)中高表达;TEK在BLCA、BRCA、COAD等16种癌症中低表达。上述分析结果提示,由于肿瘤微环境的不同,其在不同类型肿瘤中的表达存在差异。Nong[23]报道在子宫内膜癌中ANGPT1表达下调,Katoh[25]证实TEK在子宫内膜癌中呈低表达,上述结果与本研究分析结果一致。在癌组织中,ANGPT1来源于癌细胞和周围新生血管的分泌,由于癌组织的新生血管缺乏周细胞覆盖,因此周细胞源性的ANGPT1减少。TEK表达于多种细胞中,包括内皮细胞、造血干细胞和多数肿瘤细胞中,与受体ANGPT1结合后可抑制血管异常增生进而抑制肿瘤的生长,并可提高对肿瘤治疗的敏感度[26]。笔者还发现TEK在PAAD癌组织中的转录和蛋白表达情况并不一致。导致此现象的原因可能是,mRNA表达水平只能决定30-85%的蛋白表达,另外15-70%可以由转录后调解、翻译后调解以及抽样误差来解释。
本团队发现与预后有统计学意义的有21种肿瘤。研究发现[20],患者血清 ANGPT1/ANGPT2 与鼻咽癌分级和分期相关;ANGPT1在肺癌患者血清中低表达[27],ANGPT2和VEGF在肺癌患者血清中的表达升高[28],Ⅱ期肺癌患者的血清中ANGPT2的表达要高于Ⅰ期患者。本团队分析了ANGPT1和TEK的表达水平与肿瘤分期之间的关系,发现KIRC中ANGPT1的表达与肿瘤分期相关,而在其他肿瘤中未发现相关性,同时发现BLCA、BRCA、KICH、READ、SKCM、STAD和THCA中TEK的表达与肿瘤分期相关,与其他肿瘤分期无关。以上结果提示,随着肿瘤的恶化进展,ANGPT2表达量逐步增多,提示ANGPT2具有促癌作用。程阳[14]等研究表明ANGPT2在肝癌组织中大量表达,且表达量同肝癌病理分级成正相关,随着病理分级的进展,ANGPT2表达量也逐渐增高。以往研究表明,随着肿瘤分级越来越严重,ANGPT1/ANGPT2倒置。随后,笔者进一步对OS和PFS分析,结果提示ANGPT1高表达与LUSC、LIHC、KIRC、STAD、UCEC不良预后和较短的生存时间具有相关性;ANGPT1低表达与LUAD、KIRC、PCPG、HNSC患者的不良预后和较短的生存时间具有相关性,总生存期和无复发生存期分析结果高度一致。相同地,TEK高表达与BICA、KIRC、ESCA、STAD患者预后不良高度相关,TEK低表达与LUAD、LIHC、KIRC、PCPG、HNSC患者预后不良高度相关。以上结果提示,在部分肿瘤中,随着肿瘤恶性程度加重,ANGPT1/ANGPT2比例倒置,且ANGPT1表达增高是肿瘤预后良好的保护因素。
3.3 在34种肿瘤中ANGPT1和TEK与免疫、免疫浸润及细胞亚型的关系分析
笔者首次分析了ANGPT1和TEK的表达与TMB、MSI、ICP之间的关系,结果表明ANGPT1和TEK与TMB、MSI在大多数肿瘤中呈显著负相关,与ICP在泛癌中呈正相关。 为探明 ANGPT1和TEK与泛癌的免疫浸润及浸润细胞亚型的相关性,笔者通过在线平台进行相关分析,得到ANGPT1和TEK的表达与大多数肿瘤的免疫浸润呈正相关。ANGPT1和TEK的表达使CD4 T细胞、巨噬细胞在COAD中浸润程度升高,且以巨噬细胞浸润为主。Lei Zhang[29]等研究表明,特定巨噬细胞为肿瘤微环境中细胞串扰的关键介质,Li[30]等人发现灵芝多糖可通过下调IL-1β、iNOS和COX-2表达从而抑制巨噬细胞浸润,说明结肠腺癌肿瘤微环境中IL-1β、iNOS和COX-2的高表达可募集巨噬细胞浸润其中,发挥促癌作用。中性粒细胞是最丰富的粒细胞类型,是宿主对不同病原体反应的基本组成部分。笔者的分析结果表明,中性粒细胞在DLBC中浸润度升高。Li等[17]的研究表明,中性粒细胞细胞外陷阱(NET)通过唤醒休眠癌细胞、捕获循环肿瘤细胞、覆盖和屏蔽癌细胞、从而防止CD8 T细胞和NK细胞介导的细胞毒性,进而促进肿瘤生长和转移形成。NET的形成最主要是通过高度纯化的中性粒细胞产生和释放预先形成的VEGF-A、ANGPT1、VEGF-B实现,因此,ANGPT1可促进NET的释放,从而在体内外发挥促血管生成作用。此外,笔者的分析结果表明,ANGPT1高表达使B细胞在THYM中浸润程度升高,而TEK高表达使B细胞在KICH中浸润程度最高。这些结果表明,ANGPT1和TEK可能对肿瘤微环境中免疫细胞的调控发挥重要作用。
3.4 ANGPT1和TEK的相互作用蛋白及通路富集分析
笔者发现ANGPT1的表达水平与TEK的表达量呈负相关,通过蛋白相互作用网络分析得到59个相关蛋白与ANGPT1和TEK存在相互作用,其中GRB2、PIK3R1、EGFR 与ANGPT1和TEK作用最为密切,GO富集分析进一步表明,大多数基因主要参与了与Grb2-EGFR复合物、ERBB3:ERBB2复合物、Shc-EGFR复合物相关的一系列生物学过程和功能。KEGG通路富集分析表明主要涉及ErbB信号通路。ERBB家族包括ERBB1-4四个受体,即EGFR、HER2、HER3和HER4。这四个受体可以形成同源或异源二聚体,受体与配体结合后激活下游信号,下游信号通路相互联系和重叠。其中,PI3K-AKT和MAPK通路是比较重要的信号通路, ANGPT1磷酸化TIE2受体导致PI3K/AKT活化,这导致转录因子FOXO1的磷酸化(失活)而使血管稳定。ANGPT2是TIE2受体的拮抗剂,可使PI3K/AKT失活并阻止FOXO1磷酸化,诱导BEC释放ANGPT2。在病理条件下,例如癌症中,ANGPT2与ANGPT1竞争性结合TIE2受体,引起的AKT磷酸化导致Foxo1的激活和ANGPT2的表达[17]。此外, EGFR信号通过PI3K-Akt信号与干扰素调节因子IRF1共同下调趋化因子配体CXCL10,导致效应CD8+ T细胞减少,从而促进肿瘤的生长与转移[26]。
3.5 宫颈癌中ANGPT1和TEK的表达、预后、免疫分析
本课题组长期致力于宫颈癌的研究,在此对宫颈癌的相关结果进行简要分析。ANGPT1与TEK启动子的甲基化水平在宫颈癌中的水平较高,使ANGPT1与TEK在宫颈癌中无论是转录组水平还是蛋白表达水平均有所降低(P < 0.05);在预后方面,无复发生存期中,ANGPT1与TEK高表达的宫颈癌患者比低表达的患者预后更差;在免疫方面,TEK的肿瘤突变负荷与宫颈癌呈负相关;此外,ANGPT1表达与CD8+ T细胞和巨噬细胞浸润呈显著正相关,TEK表达与巨噬细胞浸润程度呈显著正相关,其次与中性粒细胞和树突状细胞浸润程度正相关。
综上所述,本研究发现ANGPT1与TEK在大多数肿瘤中呈低表达,并且在生存预后、免疫浸润及浸润细胞亚型等方面来探究ANGPT1与TEK在泛癌中作用。最后,GRB2、PIK3R1、EGFR等基因与ANGPTI和TEK密切相关,可能通过ErbB信号通路在肿瘤发生发展中起着重要作用,有望成为多种类型癌症的潜在临床预后标志物。不足的是,本研究主要通过数据挖掘、R软件及在线平台进行了ANGPT1和TEK对泛癌进展影响的探究,且由于部分数据库中缺乏有些肿瘤数据,而使这些肿瘤无法得到分析。后续,本团队将通过实验验证ANGPT1和TEK在宫颈癌中的表达、生存预后、免疫浸润及作用通路的情况,以探明其在宫颈癌肿瘤血管形成中的具体作用及机制。
-
图 1 通过不同数据库分析ANGPT1与TEK在正常组织和不同肿瘤组织间的转录情况及蛋白表达量
A:通过TIMER数据库分析ANGPT1在不同肿瘤组织中相对于正常组织中的表达水平。B:通过TIMER数据库分析TEK在不同肿瘤组织中相对于正常组织中的表达水平。 C:通过UALCAN数据库分析ANGPT1在不同肿瘤组织的蛋白质组表达水平; D:通过UALCAN数据库分析TEK在不同肿瘤组织的蛋白质组表达水平。*P < 0.05;**P < 0.01;***P < 0.001。
Figure 1. The transcription and protein expression levels of ANGPT1 and TEK in normal tissues and different tumor tissues were analyzed by different databases
图 3 ANGPT1和TEK在不同癌症类型中的基因免疫分析
A:ANGPT1表达水平与不同癌症类型的TMB(Tumor mutation burden)的相关性; B:ANGPT1表达水平与不同癌症类型的MSI(Microsatellite instability)评分的相关性; C:ANGPT1表达水平与不同癌症类型的免疫检查点的相关性; D:TEK表达水平与不同癌症类型的TMB(Tumor mutation burden)的相关性; E:TEK表达水平与不同癌症类型的MSI(Microsatellite instability)评分的相关性; F:TEK表达水平与不同癌症类型的免疫检查点的相关性。
Figure 3. Gene immunoassays of ANGPT1 and TEK in different cancer types
图 4 在不同癌症类型中ANGPT1和TEK的表达水平与免疫浸润细胞亚型的相关性分析(其中x轴为不同免疫细胞亚型,y轴为不同癌症类型,红色表示癌症和免疫细胞亚型之间的正相关。蓝色表示负相关。颜色越深,相关性越大。相关系数和P值显示在每个单元格中)
A:在不同癌症类型中ANGPT1表达水平与免疫浸润细胞亚型的相关性; B:在不同癌症类型中TEK表达水平与免疫浸润细胞亚型的相关性,*P < 0.05。
Figure 4. Correlation analysis of ANGPT1 and TEK expression levels with immune-infiltrating cell subtypes in different cancer types (The x-axis is for different immune cell subtypes,the y-axis is for different cancer types,and red indicates a positive correlation between cancer and immune cell subtype. Blue indicates a negative correlation. The darker the color,the greater the relevance. The correlation coefficient and P-value are displayed in each cell)
图 5 ANGPT1和TEK相关基因的蛋白相互作用网络与富集通路分析
A:通过TIMER数据库分析在不同癌症类型中ANGPT1对TEK表达量的影响; B:59个相关基因的蛋白质相互作用网络。通过STRING数据库检索得到的59个与ANGPT1和TEK相关的基因,利用Cytoscape软件将网络可视化,颜色节点代表已识别的蛋白质,从内到外,节点面积大小和颜色深浅程度代表节点的重要性强弱; C:ANGPT1和TEK相关基因GO分析的生物过程(BP)富集分析条目; D:ANGPT1和TEK相关基因GO分析的细胞组分(CC)富集分析条目; E:ANGPT1和TEK相关基因GO分析的分子功能(MF)富集分析条目; F:ANGPT1和TEK相关基因KEGG通路富集分析条目,*P < 0.05。
Figure 5. Analysis of protein interaction network and enrichment pathway of ANGPT1 and TEK-related genes
-
[1] Bray F,Laversanne M,Weiderpass E,et al. The ever-increasing importance of cancer as a leading cause of premature death worldwide[J]. Cancer-Am Cancer Soc,2021,127(16):3029-3030. [2] 林国享,朱小东. 肿瘤血管生成的促进因素及其在肿瘤发生发展中的作用研究进展[J]. 广西医学,2020,42(3):334-337. [3] Chen W Z,Jiang J X,Yu X Y,et al. Endothelial cells in colorectal cancer[J]. World J Gastrointest Oncol,2019,11(11):946-956. doi: 10.4251/wjgo.v11.i11.946 [4] Lugano R,Ramachandran M,Dimberg A. Tumor angiogenesis: Causes,consequences,challenges and opportunities[J]. Cell Mol Life Sci,2020,77(9):1745-1770. doi: 10.1007/s00018-019-03351-7 [5] Omiyale A O. Primary vascular tumours of the kidney[J]. World J Clin Oncol,2021,12(12):1157-1168. doi: 10.5306/wjco.v12.i12.1157 [6] 何丹华,陈知英,陈国菊. 婴幼儿血管瘤异常表达基因分析[J]. 现代医药卫生,2023,39(2):199-203. [7] Li Y Y,Liu P,Zhou Y L,et al. Activation of angiopoietin-Tie2 signaling protects the kidney from ischemic injury by modulation of endothelial-specific pathways[J]. J Am Soc Nephrol,2023,34(6):969-987. doi: 10.1681/ASN.0000000000000098 [8] 徐文婵,刘珍银,陈钦谕,等. Tie2突变与儿童静脉畸形相关性研究[J]. 中华介入放射学电子杂志,2021,9(4):415-418. [9] Cam M,Charan M,Welker A M,et al. ΔNp73/ETS2 complex drives glioblastoma pathogenesis- targeting downstream mediators by rebastinib prolongs survival in preclinical models of glioblastoma[J]. Neuro Oncol,2020,22(3):345-356. doi: 10.1093/neuonc/noz190 [10] Liu W X,Gu S Z,Zhang S,et al. Angiopoietin and vascular endothelial growth factor expression in colorectal disease models[J]. World J Gastroentero,2015,21(9):2645-2650. doi: 10.3748/wjg.v21.i9.2645 [11] Zhou M,Wang B,Li H,et al. RNA-binding protein SAMD4A inhibits breast tumor angiogenesis by modulating the balance of angiogenesis program[J]. Cancer Sci,2021,112(9):3835-3845. doi: 10.1111/cas.15053 [12] Wu F T,Lee C R,Bogdanovic E,et al. Vasculotide reduces endothelial permeability and tumor cell extravasation in the absence of binding to or agonistic activation of Tie2[J]. Embo Mol Med,2015,7(6):770-787. doi: 10.15252/emmm.201404193 [13] Qin S,Yi M,Jiao D C,et al. Distinct Roles of VEGFA and ANGPT2 in lung adenocarcinoma and squamous cell carcinoma[J]. J Cancer,2020,11(1):153-167. doi: 10.7150/jca.34693 [14] 程阳,王一喆,金悦,等. ANGPT1基因在肺腺癌组织中的表达及其预后价值分析[J]. 现代肿瘤医学,2020,28(4):587-591. [15] Xue R,Sheng Y,Duan X,et al. Tie2-expressing monocytes as a novel angiogenesis-related cellular biomarker for non-small cell lung cancer[J]. Int J Cancer,2021,148(6):1519-1528. doi: 10.1002/ijc.33381 [16] Cai Z,Gong Z,Li Z,et al. Vascular extracellular matrix remodeling and hypertension[J]. Antioxid Redox Signal,2021,34(10):765-783. doi: 10.1089/ars.2020.8110 [17] Li Y,Chen D,Sun L,et al. Induced expression of VEGFC,ANGPT,and EFNB2 and their receptors characterizes neovascularization in proliferative diabetic retinopathy[J]. Invest Ophthalmol Vis Sci,2019,60(13):4084-4096. doi: 10.1167/iovs.19-26767 [18] Li Y,Liu P,Zhou Y,et al. Activation of angiopoietin-Tie2 signaling protects the kidney from ischemic injury by modulation of endothelial-specific pathways[J]. J Am Soc Nephrol,2023,34(6):969-987. doi: 10.1681/ASN.0000000000000098 [19] Staton C A,Hoh L,Baldwin A,et al. Angiopoietins 1 and 2 and Tie-2 receptor expression in human ductal breast disease[J]. Histopathology,2011,59(2):256-263. doi: 10.1111/j.1365-2559.2011.03920.x [20] G ü veli M E,Duranyildiz D,Karadeniz A,et al. Circulating serum levels of angiopoietin-1 and angiopoietin-2 in nasopharynx and larynx carcinoma patients[J]. Tumor Biol,2016,37(7):8979-8983. doi: 10.1007/s13277-015-4777-0 [21] Wen J,Li H Z,Ji Z G,et al. Expressions of receptor tyrosine kinases mRNA and protein in carcinoma of bladder[J]. Zhongguo Yi Xue Ke Xue Yuan Xue Bao,2011,33(4):393-396. [22] Yang F,Hu Y,Shao L,et al. SIRT7 interacts with TEK (TIE2) to promote adriamycin induced metastasis in breast cancer[J]. Cell Oncol,2021,44(6):1405-1424. doi: 10.1007/s13402-021-00649-2 [23] Ha M,Son Y R,Kim J,et al. TEK is a novel prognostic marker for clear cell renal cell carcinoma[J]. Eur Rev Med Pharmaco,2019,23(4):1451-1458. [24] Zhou S J,Xu B,Qi L,et al. Next-generation sequencing reveals mutational accordance between cell-free DNA from plasma,malignant pleural effusion and ascites and directs targeted therapy in a gastric cancer patient[J]. Cancer Biol Ther,2019,20(1):15-20. doi: 10.1080/15384047.2018.1504720 [25] Nong B,Su T,Jin M,et al. Immune-related gene ANGPT1 is an adverse biomarker for endometrial carcinoma[J]. Transl Cancer Res,2021,10(6):2962-2976. doi: 10.21037/tcr-21-671 [26] Katoh Y,Katoh M. Comparative integromics on Angiopoietin family members[J]. Int J Mol Med,2006,17(6):1145-1149. [27] Yao S,Dong S S,Ding J M,et al. Sex-specific SNP-SNP interaction analyses within topologically associated domains reveals ANGPT1 as a novel tumor suppressor gene for lung cancer[J]. Gene Chromosome Canc,2020,59(1):13-22. doi: 10.1002/gcc.22793 [28] Di Tacchio M,Macas J,Weissenberger J,et al. Tumor Vessel Normalization,Immunostimulatory Reprogramming,and Improved Survival in Glioblastoma with Combined Inhibition of PD-1,Angiopoietin-2,and VEGF[J]. Cancer Immunol Res,2019,7(12):1910-1927. doi: 10.1158/2326-6066.CIR-18-0865 [29] Zhang L,Li Z Y,Skrzypczynska K M,et al. Single-cell analyses inform mechanisms of myeloid-targeted therapies in colon cancer[J]. Cell,2020,181(2):442-459. doi: 10.1016/j.cell.2020.03.048 [30] Li G L,Tang J F,Tan W L,et al. The anti-hepatocellular carcinoma effects of polysaccharides from Ganoderma lucidum by regulating macrophage polarization via the MAPK/NF-κB signaling pathway[J]. Food Funct,2023,14(7):3155-3168. doi: 10.1039/D2FO02191A -






 下载:
下载:
 下载:
下载:

