The Spation-temporal Expression of SOX9 during the Development of Mandibular Condylar Cartilage and Tibial Growth Plate Cartilage in SD Rats
-
摘要:
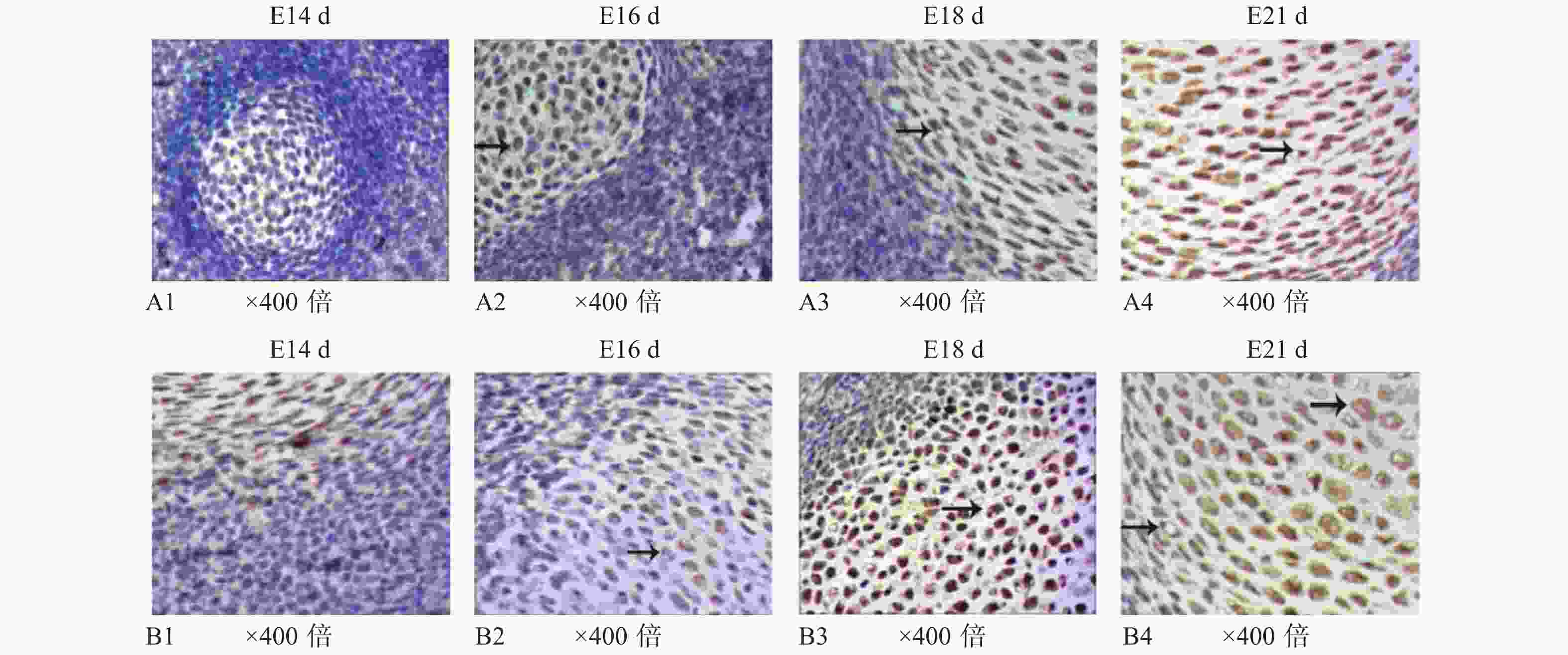
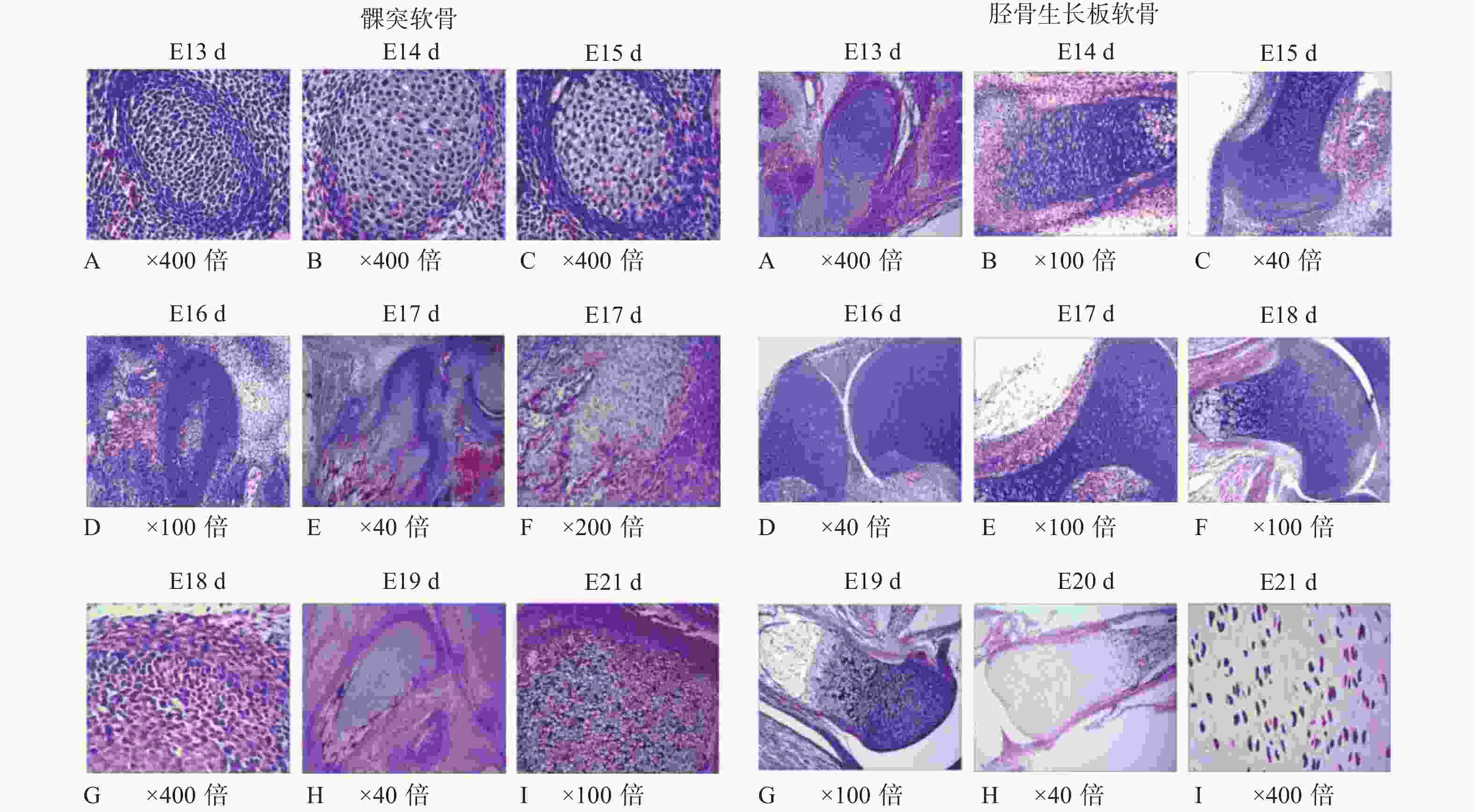
目的 通过建立SD大鼠的发育模型,观察髁突软骨与胫骨生长板软骨在胚胎发育过程中的不同生长特性,探讨比较SOX9在2种不同性质软骨生长发育过程中的表达变化及其意义。 方法 30只成年SD大鼠按2雌1雄的比例合笼,观察雌鼠于合笼后是否发现阴栓作为怀孕的标志,计为妊娠0 d,隔离常规饲养。分别于孕鼠妊娠13 d、14 d、15 d、16 d、17 d、18 d、19 d、20 d、21 d剖腹取出胎鼠(embryo,E),连续切片获得E13 d~E21 d的髁突软骨和胫骨生长板软骨不同发育时间的切片标本。利用HE染色、免疫组织化学方法观察2种软骨胚胎发育中的组织学结构特点并检测SOX9在两种软骨胚胎发育中的表达变化。采用SPSS17.0软件包对数据进行单因素方差分析和两独立样本t检验。 结果 E14 d~E21 d,髁突软骨和胫骨生长板软骨的HE染色观察发现其组织学形态结构存在显著差异;免疫组化染色结果显示,E15 d、E17 d、E20 d胎鼠胫骨生长板软骨SOX9阳性表达强于髁突软骨,有统计学意义(P < 0.05)。2种软骨组织中SOX9阳性细胞的分布规律基本一致,且均多位于增殖层。 结论 髁突软骨和胫骨生长板软骨组织结构具有相似的胚胎发育,其差异主要表现为细胞分层排列的方式,而早期胚胎发育相关基因SOX9在髁突软骨、胫骨生长板软骨中均有表达,呈现一定的时空变化,提示SOX9与2种软骨细胞的分化和软骨发育密切相关。 Abstract:Objective To explore the spation-temporal expression changes of SOX9during the development of condylar cartilage and tibial growth plate cartilage in SD rats. Methods Thirty adult SD rats were caged at the female-male ratio of 2∶1. The vaginal plug appeared was designated as gestation day 0 (GD0) and the rats were isolated then and raised in the routine way. The embryos were obtained from day 13 to day 21 respectively and the condylar cartilage and tibial growth plate cartilage were harvested. Serial section was performed to obtain the slices of the two kinds of cartilages at different development stages (E13 d-E21 d). HE staining and immunohistochemical detection were employed to compare the structure distinguish between two kinds of cartilages and examine the expressional changes of SOX9. The data were analyzed by applying single factor analysis of variance and two independent sample t test in SPSS17.0 software package. Results Some morphological differences, mainly in the forms, stratification and arrangements of cells, were observed between the condylar cartilage and the tibial growth plate cartilage during E14 d-E21 d indicated by HE staining. In tibial growth plate cartilage, the SOX9 positive expression in E15 d, E17 d and E20 d were stronger than those in condylar cartilage (P < 0.05). The distribution of positive cells in tibial growth plate and cartilage condylar cartilage was basically identical. SOX9 was mainly positive in the proliferation layer of the two kinds of cartilage. Conclusions The main structures of condylar cartilage and tibial growth plate cartilage during the development process are similar. The minority distinguished part is the layered form, which indicates different growth characteristics during embryonic development. During embryonic development, SOX9 is expressed in the two kinds of cartilages above and mainly distributes in the proliferative zone, which shows SOX9 is involved in the cell proliferation and differentiation associated with the differentiation of cartilage cell and development of cartilage. -
Key words:
- Condylar cartilage /
- Tibial growth plate cartilage /
- Embryonic development /
- SOX9
-
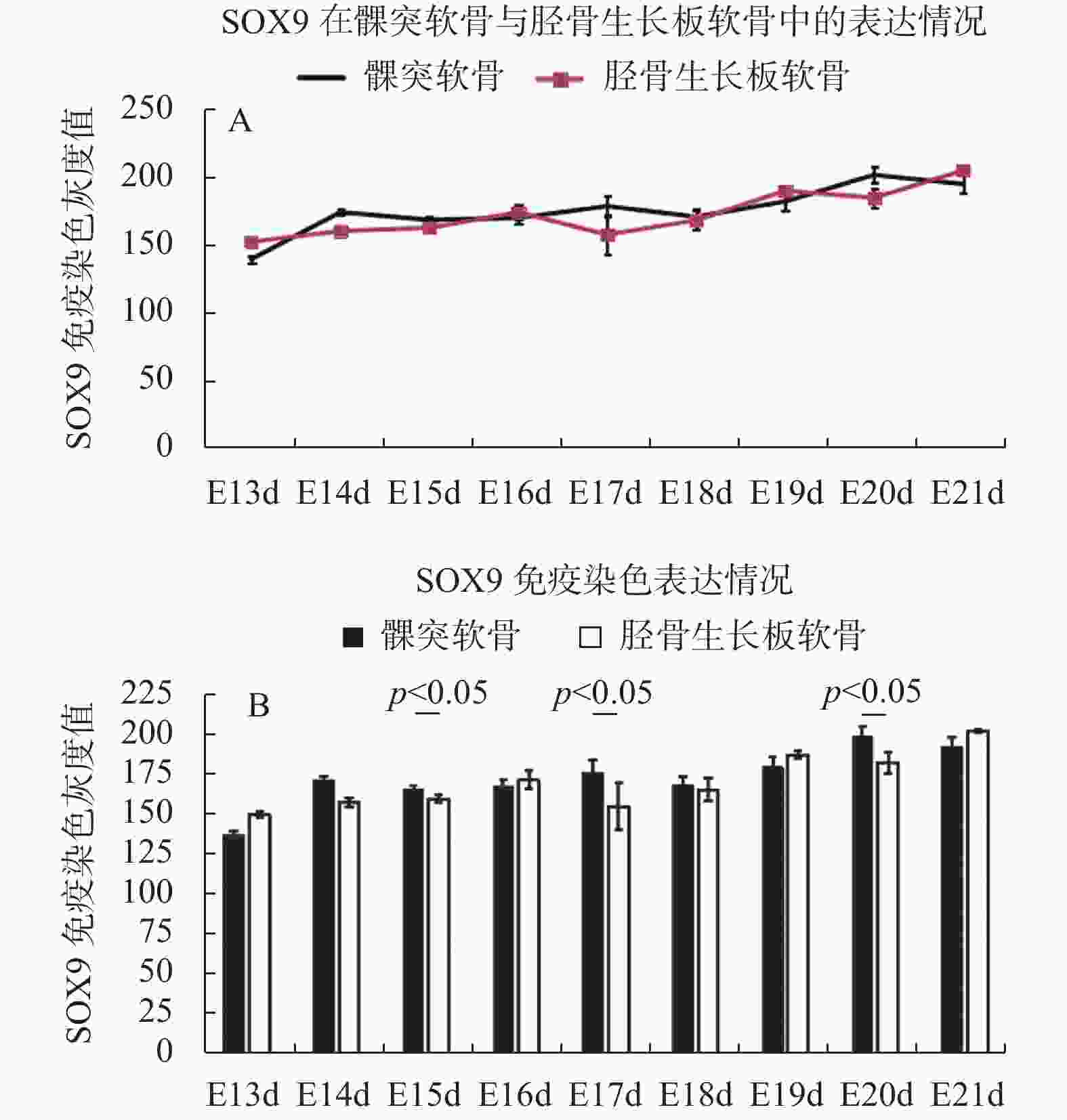
表 1 SOX9在SD大鼠不同阶段胚胎发育期髁突软骨与胫骨生长板软骨的免疫染色光密度值检测结果(
$\bar x \pm s $ )Table 1. The gray value of the immunohistochemical staining of SOX9 in the mandibular condylar cartilage and tibial growth plate cartilage during embryonic development of SD rats (
$\bar x \pm s $ )胚胎时期 髁突软骨 胫骨生长板软骨 E13d 138 ± 6.1 151 ± 1.9 E14d 173 ± 2.4 159 ± 2.6 E15d 167.3 ± 2.5* 161.3 ± 2 E16d 168.7 ± 4.6 173 ± 5.6 E17d 177.5 ± 8.1* 156.3 ± 15 E18d 169.6 ± 6 167 ± 7.2 E19d 181 ± 6.8 189 ± 2.5 E20d 200.8 ± 6* 183.7 ± 6.7 E21d 194 ± 6.1 204 ± 0.7 与胫骨生长板软骨比较,*P < 0.05。 -
[1] Wegner M. From head to toes:The multiple facets of sox proteins[J]. Nucleic Acids Res,1999,27(6):1409-1020. doi: 10.1093/nar/27.6.1409 [2] Song H,Park K H. Regulation and function of SOX9 during cartilage development and regeneration[J]. Semin Cancer Biol,2020,67(Pt1):12-23. doi: 10.1016/j.semcancer.2020.04.008 [3] Sarkar A,Hochedlinger K. The Sox Family of Transcripyion Factors:Versatile Regulators of Stem and Progenitor Cell Fate[J]. Cell Stem Cell,2013,12(1):15-30. doi: 10.1016/j.stem.2012.12.007 [4] Lefebvre V,Angelozzi M,Haseeb A. SOX9 in cartilage development and disease[J]. Curr Opin Cell Biol,2019,61:39-47. doi: 10.1016/j.ceb.2019.07.008 [5] Guerit D,Philipot D,Chuchana P,et al. Sox9-regulated miRNA-574-3p inhibits chondrogenic differentiation of mesenchymal stem cells[J]. PLoS One,2013,8(4):e62582. doi: 10.1371/journal.pone.0062582 [6] Cairns D M,Liu R,Sen M,et al. Interplay of Nkx3.2,Sox9 and Pax3 regulates chondrogenic differentiation of muscle progenenitor cells[J]. PLoS One,2012,7(7):e39642. doi: 10.1371/journal.pone.0039642 [7] Quintana L,zur Nieden N I,Semino C E. Morphogenetic and regulatory mechanisms during developmental chondrogenesis new paradigms for cartilage tissue engineering[J]. Tissue Eng Part B Rev,2009,15(1):29-41. doi: 10.1089/ten.teb.2008.0329 [8] Akiyama H. Transcriptional regulation in chondrogenesis by Sox9[J]. Clin Calcium,2011,21(6):845-851. [9] 刘戈力,陈蔚,姜丽红,等. 生长激素对宫内发育迟缓大鼠生长板的影响[J]. 天津医科大学学报,2004,10(1):47-49. [10] Lee S K,Kim Y S,Oh H S,et al. Prenatal development of the human mandible[J]. Anat Rec,2001,263(3):314-325. doi: 10.1002/ar.1110 [11] Wright E,Hargrave M R,Christiansen J,et al. The Sry-related gene Sox9 is expressed during chondrogenesis in mouse embryos[J]. Nat Genet,1995,9(1):15-20. doi: 10.1038/ng0195-15 [12] Ng L J,Wheatley S,Muscat G E,et al. SOX9 binds DNA,activates transcription,and coexpresses with type II collagen during chondrogenesis in the mouse[J]. Dev Biol,1997,183(1):108-121. doi: 10.1006/dbio.1996.8487 [13] Zhao Q,Eberspaecher H,Lefebvre V,De Crombrugghe B. Parallel expression of Sox9 and Col2a1 in cells undergoing chondrogenesis[J]. Dev Dyn,1997,209(4):377-386. doi: 10.1002/(SICI)1097-0177(199708)209:4<377::AID-AJA5>3.0.CO;2-F -





 下载:
下载: