Effects of Ranibizumab and Odix on the Microvascular Structure of the Macular Region
-
摘要:
目的 探讨雷珠单抗和傲迪适对视网膜静脉阻塞-黄斑水肿(RVO-ME)患者黄斑区微血管结构的影响。 方法 将眼科收治并确诊的RVO-ME所有患者纳入筛选范围,选取101例患者作为研究对象,纳入时间2020年1月至2021年12月,按治疗方法差异将其分成A、B组(观察组、对照组),各51例、50例,A组给予玻璃体腔注射雷珠单抗治疗,B组给予玻璃体腔注射傲迪适治疗,将2组年龄、性别及治疗前后的最佳矫正视力(BCVA)、黄斑中心凹厚度(CMT)及视网膜浅层毛细血管层(SCP)、深层毛细血管层血流密度(DCP)及其他治疗有效率等指标纳入SPSS21.0软件处理,比较其治疗治疗差异。 结果 (1)A、B组治疗前BCVA、CMT、SCP、DCP相比差异无统计学意义(P > 0.05),随着治疗时间的后延,A、B组的BCVA、CMT、SCP、DCP均显著改善,且B组较A组更优,差异有统计学意义(P < 0.05);(2)A组治疗后3、6个月时治疗总有效率各94.12%、98.04%,B组各84.00%、88.00%,且B组较A组更优,差异有统计学意义(P < 0.05)。 结论 傲迪适治疗能有效的改善RVO-ME患者的黄斑区微血管结构。 Abstract:Objective To investigate the effect of ranibizumab and odix on the microvascular structure of the macular region in patients with retinal vein occlusion-macular edema (RVO-ME). Methods All patients with RVO-ME admitted and diagnosed in the ophthalmology department of our hospital were included in the screening scope, and 101 of them were selected as the research subjects. The inclusion time was from January 2020 to December 2021, and they were divided into the observation group and the control group according to the differences in treatment methods, with 51 cases and 50 cases in each group. The observation group was given intravitreal injection of ranibizumab, and the control group was given intravitreal injection of AODEX. The age, gender, best corrected visual acuity (BCVA), macular fovea thickness (CMT), shallow retinal capillary layer (SCP), deep capillary layer blood flow density (DCP) and other effective rates of the two groups before and after the treatment were included in spss21.0 software to compare the treatment differences. Results (1) There was no significant difference in BCVA, CMT, SCP, and DCP between the two groups before the treatment (P > 0.05). With the delay of treatment time, BCVA, CMT, SCP and DCP of the two groups were significantly improved ,the control group was better than the observation group and the difference was statistically significant (P < 0.05) and (2) The total effective rates of the observation group were 94.12% and 98.04% at 3 and 6 months after the treatment while the total effective rates of the control group were 84.00% and 88.00%, showing that the control group was better than the observation group and the difference was statistically significant (P < 0.05). Conclusion Autodix treatment can effectively improve the macular microvascular structure in RVO-ME patients. -
Key words:
- Ranibizumab /
- AODIX /
- Retinal vein occlusion /
- Macular edema /
- Microvascular structure of macular region
-
视网膜静脉阻塞(retinal vein occlusion,RVO)有众多的并发症,其中对患者的中心视力威胁最严重的便是黄斑水肿(macular edema,ME)。据统计[1],随着人们不健康用眼或过度用眼现象及某些发病因素的影响,导致视网膜静脉阻塞-黄斑水肿(retinal vein occlusion-macular edema,RVO-ME)的发病形式越来越严峻。雷珠单抗是一类抗VEGF类的药物,可促进黄斑水肿吸收,减轻新生血管产生,使黄斑能够恢复原来形态,尽可能达到视力恢复效果[2]。雷珠单抗在年轻人当中,常用在中心性浆液性视网膜脉络膜病变、静脉阻塞引起的黄斑水肿,也常用于那年轻人高度近视引起的脉络膜新生血管病变[3]。而在老年人当中,雷珠单抗常用于老年性黄斑病变、老年性脉络膜新生血管引起黄斑水肿或新生血管出血[4]。炎症在RVO中扮演十分关键的角色,而抗炎也变成了RVO-ME治疗中的重要措施[5]。傲迪适针对RVO患眼内的炎症情况,有效降低玻璃体腔内MCP-1、IL-1等炎症因子,减轻血-视网膜屏障(blood-retinal barrier,BRB)的进一步破坏,抑制ME进展[6-7]。本研究探讨雷珠单抗和傲迪适对RVO-ME患者黄斑区微血管结构的影响。
1. 资料与方法
1.1 病例资料
选取沈阳爱尔眼视光医院眼底病科室2020年1月至2021年12月收治并确诊的RVO-ME患者101例作为研究对象,纳入标准[5-6]:(1)符合《视网膜静脉阻塞诊疗指南(2019年版)》[8];(2)既往RVO或相关并发症者(尤其是ME);中央黄斑厚度 > 300 μm者;(3)首次就诊,未行其他治疗者;(4)对本研究内容知情同意,并签署知情同意书者。排除标准:(1)既往阿柏西普、康柏西普、雷珠单抗等药物治疗史、过敏史、禁忌症者,以及既往使用过糖皮质激素的患者;(2)合并青光眼等视力降低疾病者;(3)眼部感染;(4)既往有白内障手术、激光治疗及玻璃体切除手术史,玻璃体腔注药史者;(5)有免疫抑制剂、免疫调节剂、抗代谢药等使用者;(6)精神、神经及语言、肢体障碍而无法参与本次实验者;(7)血常规、血沉(ESR)、C反应蛋白(CRP)异常者,合并恶性血液系统疾病、骨髓瘤或者炎症性疾病者。上述纳入与排除标准均按《视网膜静脉阻塞诊疗指南(2019年版)》[8](欧洲视网膜专家学会大会)相关筛选标准纳入与执行,101例RVO-ME患者均签署《知情同意书》且临床资料完整。按患者意愿将101例RVO-ME患者分成A组(Ozurdex单针治疗)、B(联合治疗)组,分别为51例、50例,两组年龄、性别、患眼眼数等常规资料,相比差异无统计学意义(P > 0.05),见表1。本课题均符合《赫尔辛基宣言》(世界医学会)中的医学研究伦理原则。
表 1 A、B组常规资料统计情况表[$\bar x \pm s $ /n(%)]Table 1. Statistics of routine data of groups A and B [$\bar x \pm s $ /n]组别 年龄区间(岁) 平均年龄(岁) 性别 患眼眼数(n) 男 女 A组 44~70 60.52 ± 5.78 31 20 51 B组 45~70 60.23 ± 5.56 29 21 50 χ2/t 0.257 0.081 P < 0.001* < 0.001* *P < 0.05。 1.2 治疗方法
2组RVO-ME患者术前均进行科学、合理的最佳矫正视力(best corrected visual acuity,BCVA)、非接触式眼压(non-contact tonometer,NCT)等检查。A组给予玻璃体腔注射雷珠单抗(通用名称:雷珠单抗注射液,商品名称:诺适得,规格:10 mg/mL,每瓶装量0.20 mL,批准文号:S20110085,生产企业:Novartis Pharma Schweiz AG)治疗,玻璃体注射0.5 mg,每月1次,对不能耐受者,可改为每3个月注射1次。B组给予玻璃体腔注射傲迪适(通用名称:地塞米松玻璃体内植入剂,商品名/品牌:傲迪适,批准文号 注册证号:H20170377,生产企业:Allergan Pharmaceuticals Ireland,包装规格:0.7 mg/支)治疗,玻璃体内注射后,应监控患者是否有眼压升高和眼内炎。监控方式包括注射后立即检查视神经乳头血流量、注射后30 min内进行眼压检查以及注射后2~7 d间进行生物显微镜检查。应告知患者若有任何疑似眼内炎的症状,应立即报告。若发生感染或眼压升高,应尽早治疗。
均持续治疗6个月。
1.3 观察指标
治疗前、治疗后1 d、3个月、6个月时的最佳矫正视力(best corrected visual acuity,BCVA)、黄斑中心凹厚度(central macular thickness,CMT)、黄斑区浅层毛细血管丛(superficial retinal capillary plexus,SCP)、深层毛细血管丛(deep capillary plexus,DCP)血管指标差异。BCVA 采用国际标准视力表检测,CMT、SCP及DCP采用光相干断层扫描(optical coherence tomography,OCT) (Optovue,USA)扫描获得,对直径1 mm的黄斑中心凹区视网膜厚度进行测量并计算CMT,观察ME情况。
1.4 统计学处理
建立Excel数据库,将101例RVO-ME患者的各基线资料、研究数据纳入SPSS21.0软件处理。计数资料用χ2检验。满足参数检验前提条件及球对称检验(H-F条件)的定量资料则用重复测量方差分析,若部分满足参数检验前提条件时,需适当变换变量或用混合模型分析,以(
$\bar x \pm s $ )表示。P < 0.05为差异有统计学意义。2. 结果
2.1 A、B组治疗前后的最佳矫正视力(BCVA)差异比较
A、B组治疗前的BCVA相比差异无统计学意义(P > 0.05),随着治疗时间的后延,A、B组的BCVA均显著改善,且B组较A组更优,差异有统计学意义(P < 0.05),见表2。
表 2 A、B组治疗前后的BCVA差异比较[($ \bar x \pm s $ ),μm]Table 2. Comparison of BCVA differences between groups A and B before and after treatment [($ \bar x \pm s $ ),μm]组别 n 治疗前 治疗后 1 d 3个月 6个月 A组 51 1.09 ± 0.43 0.76 ± 0.47 0.67 ± 0.24* 0.58 ± 0.13* B组 50 1.12 ± 0.41 0.82 ± 0.35 0.51 ± 0.19 0.41 ± 0.21 t 0.359 −0.729 3.719 4.902 P 0.720 0.468 < 0.001* < 0.001* *P < 0.05。 2.2 A、B组治疗前后黄斑中心凹厚度(CMT)差异比较
A、B组治疗前的CMT相比差异无统计学意义(P > 0.05),随着治疗时间的后延,A、B组的CMT均显著改善,且B组较A组更优,差异有统计学意义(P < 0.05),见表3。
表 3 A、B组治疗前后的CMT差异比较[($ \bar x \pm s $ ),μm]Table 3. Comparison of CMT differences between groups A and B before and after treatment [($ \bar x \pm s $ ),μm]组别 n 治疗前 治疗后 1 d 3个月 6个月 A组 51 470.35 ± 113.54 425.76 ± 100.47 376.67 ± 103.24* 342.14 ± 112.31* B组 50 472.32 ± 101.37 400.82 ± 102.36 320.51 ± 101.19 297.14 ± 106.52 t 0.092 1.236 2.861 2.078 P 0.927 0.219 0.007* 0.038* *P < 0.05。 2.3 A、B组治疗前后视网膜浅层毛细血管层(SCP)差异比较
A、B组治疗前的SCP相比差异无统计学意义(P > 0.05),随着治疗时间的后延,A、B组的SCP均显著改善,且B组较A组更优,差异有统计学意义(P < 0.05),见表4。
表 4 A、B组治疗前后的SCP差异比较[($ \bar x \pm s $ ),%]Table 4. Comparison of SCP differences between groups A and B before and after treatment[($ \bar x \pm s $ ),%]组别 n 治疗前 治疗后 1 d 3个月 6个月 A组 51 51.09 ± 11.43 43.76 ± 8.47 46.67 ± 6.24* 54.58 ± 4.13* B组 50 40.12 ± 10.41 45.82 ± 8.35 52.51 ± 5.86 61.41 ± 4.26 t 0.014 −1.231 −4.849 −8.298 P 0.989 0.221 < 0.001* < 0.001* *P < 0.05。 2.4 A、B组治疗前后深层毛细血管层血流密度(DCP)差异比较
A、B组治疗前的DCP相比差异无统计学意义(P > 0.05),随着治疗时间的后延,A、B组的DCP均显著改善,且B组较A组更优,差异有统计学意义(P < 0.05),见表5。
表 5 A、B组治疗前后的DCP差异比较[($ \bar x \pm s $ ),%]Table 5. Comparison of DCP differences between groups A and B before and after treatment [($ \bar x \pm s $ ),%]组别 n 治疗前 治疗后 1 d 3个月 6个月 A组 51 41.09 ± 8.47 43.76 ± 6.47* 48.67 ± 7.24* 53.58 ± 8.13* B组 50 40.12 ± 8.43 46.82 ± 7.35 54.51 ± 7.19 62.34 ± 8.21 t 0.577 −2.219 −4.067 −5.387 P 0.565 0.029* < 0.001* < 0.001* *P < 0.05。 2.5 A、B组治疗前后视网膜下积液(SRF)差异比较
A、B组治疗前的SRF相比差异无统计学意义(P > 0.05),随着治疗时间的后延,A、B组的SRF均显著改善,且B组较A组更优,差异有统计学意义(P < 0.05),见表6。
表 6 A、B组治疗前后的SRF差异比较[($ \bar x \pm s $ ),μm]Table 6. Comparison of SRF differences between groups A and B before and after treatment[($ \bar x \pm s $ ),μm]组别 n 治疗前 治疗后 1 d 3个月 6个月 A组 51 211.09 ± 38.46 188.46 ± 41.35* 148.64 ± 31.65* 43.64 ± 8.48* B组 50 210.46 ± 35.33 171.82 ± 37.75 124.51 ± 27.19 28.53 ± 6.73 t 0.085 2.112 4.113 9.929 P 0.576 0.037 < 0.001* < 0.001* *P < 0.05。 2.6 A、B组治疗前后高反射物质(HRF)差异比较
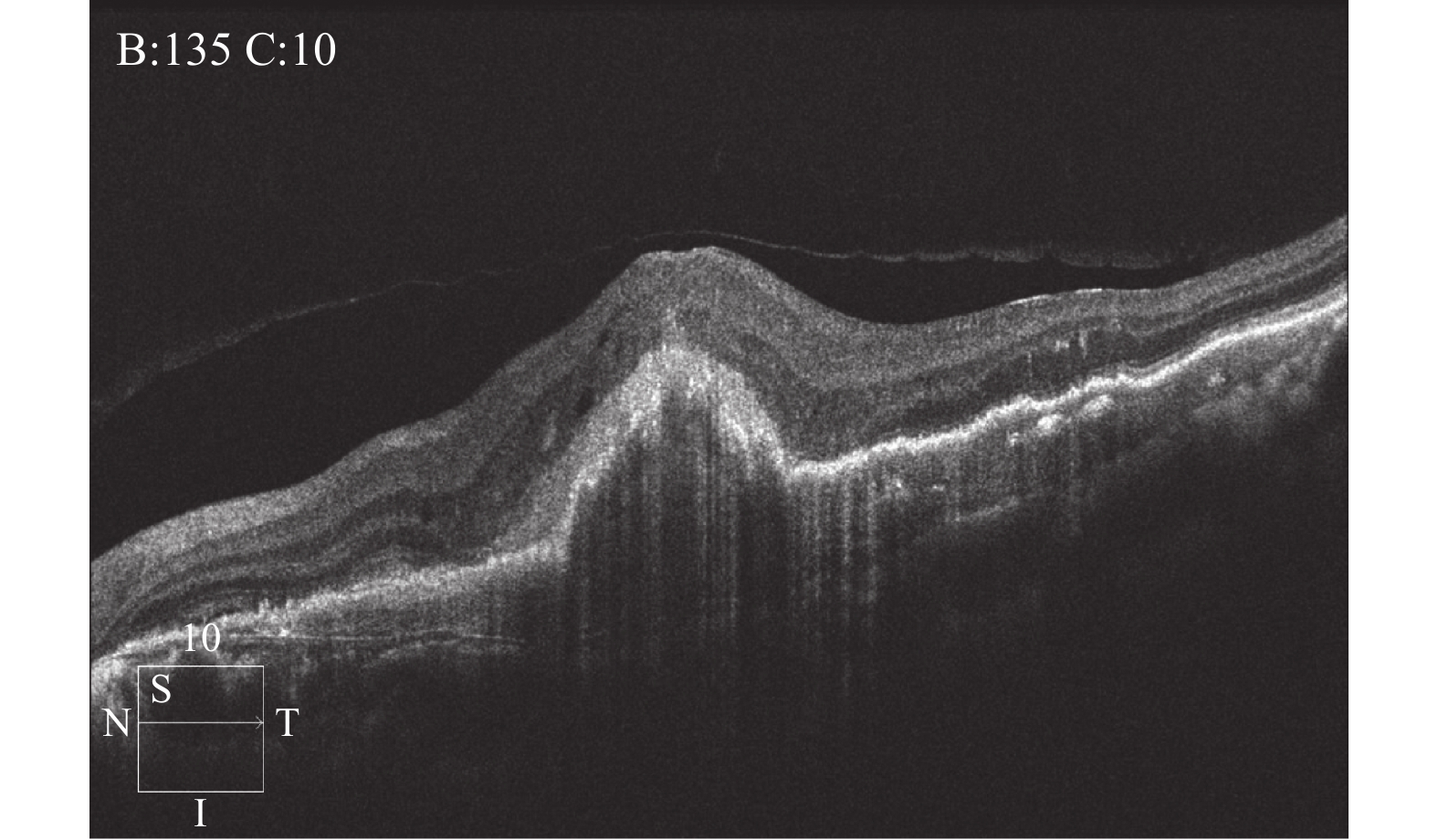
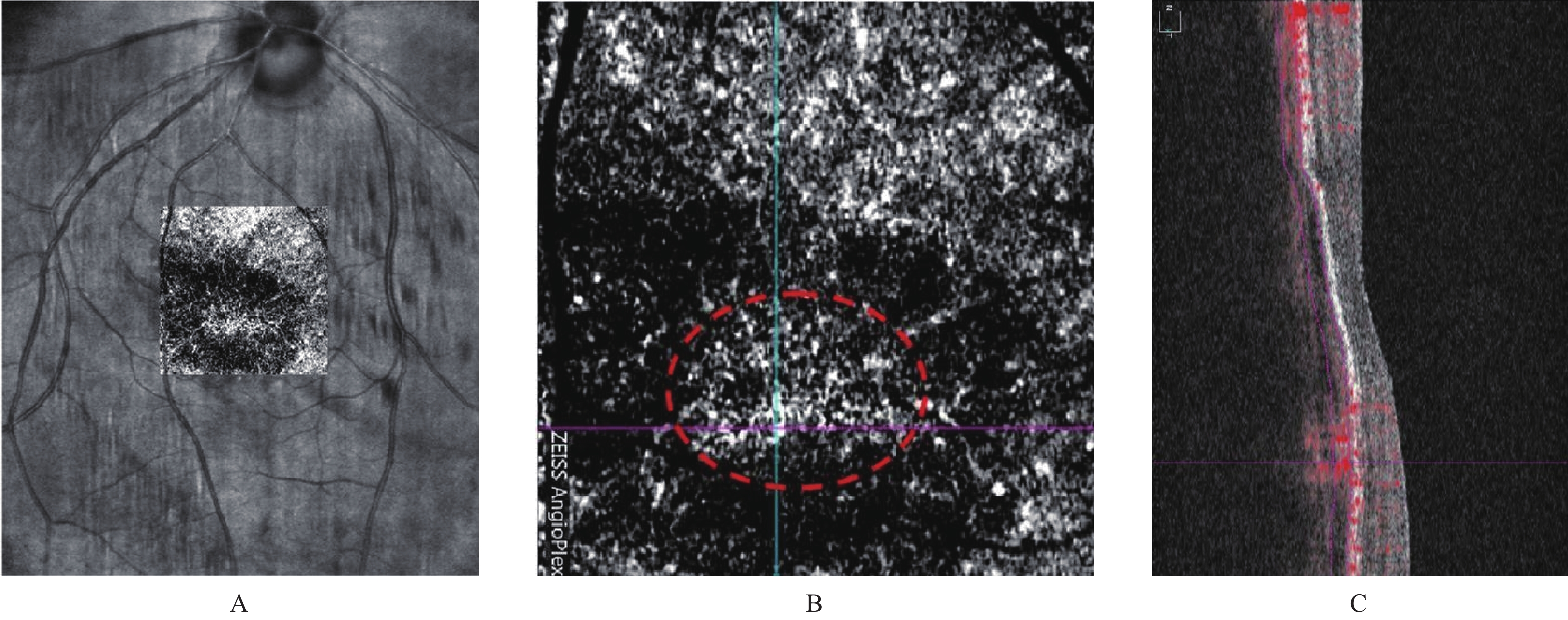
治疗前,黄斑区视网膜内病灶呈高反射;治疗后,脉络膜新生血管信号减弱,高反射物质信号转为低平,见图1、图2。
3. 讨论
视网膜静脉阻塞是40岁以上的人群最常见的眼底血管病。有研究调研,静脉阻塞的发病率接近2%,有1.3%左右的患者是分支静脉阻塞,还有0.6%左右的是一个中央视网膜静脉阻塞,这2种视网膜静脉阻塞70%以上都会因为黄斑水肿导致视力减退,严重的可以导致失明[9-12]。据统计,目前我国约有740万RVO患者,占所有眼部疾病患者的28%[13-14]。既往研究发现[14]视网膜静脉阻塞-黄斑水肿(RVO-ME)的发生在不同年龄阶段的发病因素存在一定差异,其中有高血压、高血脂、高血糖等“三高”疾病的年龄偏大者患RVO及其相关并发症的概率更高,原因可能与心脑血管疾病和动脉硬化等有关。而对于年龄人群而言,RVO的发生却多与炎性反应有关。但应注意的是,上述情况也并非绝对的。有学者通过比较研究大量门诊病例发现[15-16],包括RVO-ME在内的眼部疾病的发病机制依旧有显著的时移世易之特征。因此,对于RVO-ME患者病因的评估,万万不可再简单地依据年龄进行判断。结合既往研究与本次研究结果来看,笔者建议在RVO-ME的临床诊断过程中除常规检查项目之外,还需注意对血压、血糖、血脂和同型半胱氨酸的检查,并在此基础上制定科学、合理的治疗方案,如手术与药物方案等。
结合本文来看,随着治疗时间后延,虽然A、B组的BCVA、CMT及视网膜浅层毛细血管层(SCP)、深层毛细血管层血流密度(DCP)较治疗前均具有一定程度的改善,但A组较B组更显著(P < 0.05),另外文中A组的临床治疗有效率在不同阶段(治疗后3、6个月)均较B组更优(P < 0.05)。
综上所述,傲迪适治疗能有效的改善RVO-ME患者的黄斑区微血管结构。尽管如此,本文中仍有不足之处尚待完善,(1)样本纳入量相对较少,可能导致研究结果与临床实际情况出现偏差;(2)缺乏与RVO-ME相关的炎症、趋化因子等相关指标,可能造成整体临床治疗结果与临床实际情况不符。因此在未来的临床工作中希望更加努力,提供更强有力的佐证依据。
-
表 1 A、B组常规资料统计情况表[
$\bar x \pm s $ /n(%)]Table 1. Statistics of routine data of groups A and B [
$\bar x \pm s $ /n]组别 年龄区间(岁) 平均年龄(岁) 性别 患眼眼数(n) 男 女 A组 44~70 60.52 ± 5.78 31 20 51 B组 45~70 60.23 ± 5.56 29 21 50 χ2/t 0.257 0.081 P < 0.001* < 0.001* *P < 0.05。 表 2 A、B组治疗前后的BCVA差异比较[(
$ \bar x \pm s $ ),μm]Table 2. Comparison of BCVA differences between groups A and B before and after treatment [(
$ \bar x \pm s $ ),μm]组别 n 治疗前 治疗后 1 d 3个月 6个月 A组 51 1.09 ± 0.43 0.76 ± 0.47 0.67 ± 0.24* 0.58 ± 0.13* B组 50 1.12 ± 0.41 0.82 ± 0.35 0.51 ± 0.19 0.41 ± 0.21 t 0.359 −0.729 3.719 4.902 P 0.720 0.468 < 0.001* < 0.001* *P < 0.05。 表 3 A、B组治疗前后的CMT差异比较[(
$ \bar x \pm s $ ),μm]Table 3. Comparison of CMT differences between groups A and B before and after treatment [(
$ \bar x \pm s $ ),μm]组别 n 治疗前 治疗后 1 d 3个月 6个月 A组 51 470.35 ± 113.54 425.76 ± 100.47 376.67 ± 103.24* 342.14 ± 112.31* B组 50 472.32 ± 101.37 400.82 ± 102.36 320.51 ± 101.19 297.14 ± 106.52 t 0.092 1.236 2.861 2.078 P 0.927 0.219 0.007* 0.038* *P < 0.05。 表 4 A、B组治疗前后的SCP差异比较[(
$ \bar x \pm s $ ),%]Table 4. Comparison of SCP differences between groups A and B before and after treatment[(
$ \bar x \pm s $ ),%]组别 n 治疗前 治疗后 1 d 3个月 6个月 A组 51 51.09 ± 11.43 43.76 ± 8.47 46.67 ± 6.24* 54.58 ± 4.13* B组 50 40.12 ± 10.41 45.82 ± 8.35 52.51 ± 5.86 61.41 ± 4.26 t 0.014 −1.231 −4.849 −8.298 P 0.989 0.221 < 0.001* < 0.001* *P < 0.05。 表 5 A、B组治疗前后的DCP差异比较[(
$ \bar x \pm s $ ),%]Table 5. Comparison of DCP differences between groups A and B before and after treatment [(
$ \bar x \pm s $ ),%]组别 n 治疗前 治疗后 1 d 3个月 6个月 A组 51 41.09 ± 8.47 43.76 ± 6.47* 48.67 ± 7.24* 53.58 ± 8.13* B组 50 40.12 ± 8.43 46.82 ± 7.35 54.51 ± 7.19 62.34 ± 8.21 t 0.577 −2.219 −4.067 −5.387 P 0.565 0.029* < 0.001* < 0.001* *P < 0.05。 表 6 A、B组治疗前后的SRF差异比较[(
$ \bar x \pm s $ ),μm]Table 6. Comparison of SRF differences between groups A and B before and after treatment[(
$ \bar x \pm s $ ),μm]组别 n 治疗前 治疗后 1 d 3个月 6个月 A组 51 211.09 ± 38.46 188.46 ± 41.35* 148.64 ± 31.65* 43.64 ± 8.48* B组 50 210.46 ± 35.33 171.82 ± 37.75 124.51 ± 27.19 28.53 ± 6.73 t 0.085 2.112 4.113 9.929 P 0.576 0.037 < 0.001* < 0.001* *P < 0.05。 -
[1] Bandah-Rozenfeld D,Littink K W,Ben-Yosef T,et al. Novel null mutations in the EYS gene are a frequent cause of autosomal recessive retinitis pigmentosa in the Israeli population[J]. Investigative Ophthalmology & Visual Science,2010,51(9):4387-4394. [2] Quinn P M,Mulder A A,Alves C H,et al. Loss of CRB2 in Müller glial cells modifies a CRB1-associated retinitis pigmentosa phenotype into a Leber congenital amaurosis phenotype[J]. Human Molecular Genetics,2019,28(1):105-123. doi: 10.1093/hmg/ddy337 [3] Garweg JG,Zandi S. Retinal vein occlusion and the use of a dexamethasone intravitreal implant (Ozurdex®) in its treatment[J]. Graefes Arch Clin Exp Ophthalmol,2016,254(7):1257-65. doi: 10.1007/s00417-016-3350-x [4] Rosenblatt A,Udaondo P,Cunha-Vaz J,et al. A collaborative retrospective study on the efficacy and safety of intravitreal dexamethasone implant (Ozurdex) in patients with diabetic macular edema:The European DME registry study[J]. Ophthalmology,2020,127(3):377-393. doi: 10.1016/j.ophtha.2019.10.005 [5] Talib M,Cauwenbergh C V,Zaeytijd J D,et al. CRB1-associated retinal dystrophies in a Belgian cohort:Genetic characteristics and long-term clinical follow-up[J]. Br J Ophthalmol,2022,106(5):696-704. doi: 10.1136/bjophthalmol-2020-316781 [6] Yeen-Fey H,Chao A,Chen K J,et al. Clinical outcomes and predictors of response to photodynamic therapy in symptomatic circumscribed choroidal hemangioma:A retrospective case series[J]. PLoS ONE,2018,13(5):e0197088. doi: 10.1371/journal.pone.0197088 [7] 郭丽莉,程湧,邓洵,等. 激光视网膜光凝与抗VEGF疗法治疗I型ROP后远期黄斑区形态比较及其对视力预后的影响[J]. 中华实验眼科杂志,2022,40(1):47-53. [8] Salerno F R,Alireza A,Sandrine L,et al. Outcomes and predictors of skin sodium concentration in dialysis patients[J]. Clin Kidney J,2022,15(6):1129-1136. doi: 10.1093/ckj/sfac021 [9] Satoshi E,Koji O,Kosuke K,et al. Predictors of Rituximab Effect on Modified Rodnan Skin Score in Systemic Sclerosis:a machine learning analysis of the DESIRES trial[J]. Rheumatology(Oxford),2020,15(7):171-173. [10] 鞠晓妮. 眼底激光联合雷珠单抗对糖尿病性视网膜病变患者视力及并发症的影响[J]. 当代医学,2021,27(10):182-183. doi: 10.3969/j.issn.1009-4393.2021.10.077 [11] Van der Wijk AE,Canning P,Van Heijningen RP,et al. Glucocorticoids exert differential effects on the endothelium in an in vitro model of the blood-retinal barrier[J]. Acta Ophthalmol,2019,97(2):214-224. doi: 10.1111/aos.13909 [12] 郭建新,韩佳欣,李明新,等. 糖尿病视网膜病变患者泪膜脂质层厚度与黄斑微血管改变的相关性[J]. 国际眼科杂志,2020,20(3):449-454. [13] 彭立,张小花,劳娜,等. 康柏西普与雷珠单抗治疗视网膜静脉阻塞继发黄斑水肿的Meta分析[J]. 国际眼科杂志,2020,20(3):455-463. [14] 陈敏华,张小花,谢青,等. 地塞米松玻璃体内植入剂对比雷珠单抗治疗糖尿病黄斑水肿的疗效及安全性的荟萃分析[J]. 临床与病理杂志,2021,41(3):615-622. [15] 刘俐娜,钟兴武,刘红山,等. 雷珠单抗或加减驻景方对形觉剥夺性近视豚鼠眼轴和脉络膜厚度的短期影响[J]. 国际眼科杂志,2020,3(4):599-602. doi: 10.3980/j.issn.1672-5123.2020.4.04 [16] 季红英,杨林青,郭黎霞,等. 视网膜激光联合球内注射雷珠单抗治疗视网膜静脉阻塞黄斑水肿对黄斑区微血管结构变化的影响[J]. 中国医师杂志,2021,23(10):1555-1558. 期刊类型引用(3)
1. 赵树颖,张莹洁,李彦,王璐. 用于细菌生物膜感染治疗的纳米纤维的研究进展. 现代纺织技术. 2023(01): 248-258 .  百度学术
百度学术2. 安鸿雪,张婉玉,薛飞,白玉玮,宁静,李再兴. 盐度对序批式生物膜反应器性能及微生物活性影响. 工业水处理. 2023(06): 117-124 .  百度学术
百度学术3. 韩永萍,贾新宇,何江川. 基于新型抗菌策略——抗菌肽大分子偶联物的制备及抗菌性能研究. 化学研究与应用. 2022(10): 2390-2397 .  百度学术
百度学术其他类型引用(3)
-








 下载:
下载:











 下载:
下载:

